A Prova Atrás Natural de Intervenções Não-alcoólica Fígado Gordo Doença: Plantas, Nutrientes, e Probióticos para o Tratamento Desta Doença Comum,
devido ao aumento no número de não-alcoólica fígado gordo doença (NAFLD) em adultos e em pediatria e a falta de um indicado de assistência farmacêutica, natural de estratégias para o tratamento desta condição está bem-posicionada como “a próxima melhor coisa. Vários suplementos nutricionais e botânicos têm sido estudados clinicamente e mostram a promessa de tratamento do NAFLD e seu equivalente inflamatório, esteatohepatite não-alcoólica (NASH). Dada a quantidade destas terapias abordar os fatores que contribuem para o desenvolvimento do NAFLD, não é preciso muito raciocínio para entender como eles podem efetivamente abordar algumas das causas profundas da doença, em vez de apenas abordar um sintoma.
Cinco intervenções suplementares com evidência clínica ou epidemiológica para a sua utilização no contexto do NAFLD são a fosfatidil colina, que fornece fosfolípidos e colina, vitamina E, tanto como tocoferóis alfa como uma mistura de delta e tocotrienóis gama, extracto de sementes de cardo de leite, berberina e probióticos.Alterações do fígado gordo: correlacionadas com uma deficiência de fosfatidil colina?
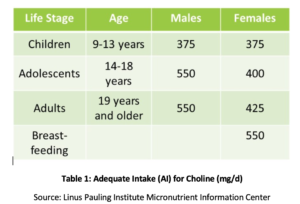
fosfatidil colina (PC) é essencial para a saúde de todas as células do corpo e é um dos principais fosfolípidos dos quais as membranas celulares são compostas., PC compreende mais de 90% do conteúdo total de fosfolípidos biliares e facilita a emulsificação, absorção e transporte de gordura. Os estudos demonstraram que a ingestão adequada recomendada (AI) de colina (Ver Tabela 1) pode não ser suficiente para a prevenção de sintomas de deficiência, tais como alterações hepáticas gordas ou lesões musculares. Além disso, um estudo recente descobriu que apenas 8% de nós adultos encontram a IA recomendada de colina, com vegetarianos, mulheres pós-menopáusicas e homens em maior risco de inadequação., Polimorfismos genéticos também podem aumentar a necessidade de colina, que também é uma fonte de grupos metil no corpo.
em mulheres pós-menopáusicas com NAFLD, demonstrou-se que a diminuição da ingestão de colina está significativamente associada a um aumento do risco de fibrose. Em animais, demonstrou-se que o PC protege contra a fibrose associada a inflamação hepática. O aumento da ingestão de PC demonstrou aumentar a secreção lipídica biliar, prevenindo assim a colestase e danos hepáticos subsequentes através de numerosos mecanismos, incluindo a supressão do fator nuclear kappa B (NF-kB), um gatilho molecular bem compreendido da inflamação., Num modelo animal de obstrução biliar, foi demonstrado que o PC suplementar reduz a lesão hepática, a proliferação ductal e a fibrose.
PC também é essencial para a saúde do intestino e é um componente primário da camada protectora do muco intestinal. Em culturas celulares, o tratamento com PC demonstrou reduzir a migração da endotoxina através das células epiteliais intestinais, suprimindo ainda mais a resposta inflamatória associada à citoquina. O PC também reduz a translocação da endotoxina em caso de aumento da permeabilidade intestinal induzido pelo álcool. Este efeito benéfico foi proposto como um dos mecanismos através dos quais o PC pode ser considerado terapêutico na doença hepática alcoólica.
- Vitamina E
- Berberina
- probióticos
- conclusão
- Dr. Carrie Decker, ND graduou-se com honras no National College of Natural Medicine (agora a Universidade Nacional de Medicina Natural) em Portland, Oregon. Dr. Decker vê pacientes remotamente, com foco em doenças gastrointestinais, desequilíbrios de humor, distúrbios alimentares, doenças auto-imunes, e fadiga crônica. Antes de se tornar um médico naturopático, Dr. Decker era engenheiro, e obteve graduação em Engenharia Biomédica e mecânica da Universidade de Wisconsin-Madison e da Universidade de Illinois em Urbana-Champaign, respectivamente. Dr. Decker continua a desfrutar de pesquisa acadêmica e escrita e usa essas habilidades para apoiar a educação de Medicina Integrativa como um escritor e contribuinte para vários recursos. Dr. Decker apoia o Allergy Research Group como membro de sua equipe de educação e desenvolvimento de produtos.
- fontes:
- Spengler EK, Loomba R. recomendações para diagnóstico, consulta para biópsia hepática, e tratamento de doença hepática gorda não-alcoólica e esteatohepatite não-alcoólica. Procedimentos Da Clínica Mayo. 2015;90(9):1233–1246.Berardis S, Sokal E. Pediátrica doença hepática gorda não alcoólica: um problema crescente de saúde pública. EUR J Pediatr. 2014 Fev;173 (2): 131-9.
- Jadeja R, et al. Medicamentos à base de plantas para o tratamento de esteatohepatite não-alcoólica: cenário actual e perspectivas futuras. Evid Based Complement Alternat Med. 2014:648308.
- Pomorski T, et al. Distribuição lipídica e transporte através das membranas celulares. Semin Cell Dev Biol. 2001 Abr; 12(2):139-48.Yamaji-Hasegawa A, et al. Distribuição assimétrica de fosfolípidos em biomembranes. Touro De Biol Pharm. 2006 Ago; 29 (8):1547-53.
- Hişmioğullari AA, et al. Secreção lipídica biliar. Turk J Gastroenterol. 2007 Jun; 18(2):65-70.
- Fischer LM, et al. O sexo e o estado da menopausa influenciam as necessidades alimentares humanas para o nutriente colina. Sou J Clin Nutr. 2007 May; 85 (5):1275-85.
- Wallace TC, et al. A ingestão habitual de colina está associada ao consumo de ovos e proteínas alimentares nos Estados Unidos. Nutriente. 2017 ago 5; 9(8).
- Zeisel SH. Os elementos de resposta genética, os polimorfismos genéticos e a epigenética influenciam a necessidade alimentar humana da colina. Vida de IUBMB. 2007 Jun; 59(6):380-7.
- Zeisel SH. Os elementos de resposta genética, os polimorfismos genéticos e a epigenética influenciam a necessidade alimentar humana da colina. Vida de IUBMB. 2007 Jun; 59(6):380-7.Guerrerio AL, et al. Ingestão de colina numa grande coorte de doentes com doença hepática gorda não-alcoólica. Sou J Clin Nutr. 2012 Abr; 95 (4):892-900.
- Ma X, et al. A polienilfosfatidilcolina atenua a fibrose hepática não alcoólica e acelera a sua regressão. Hepatol. 1996 May; 24 (5): 604-13.
- Lieber CS, et al. A fosfatidilcolina protege contra fibrose e cirrose no babuíno. Gastrenterologia. 1994 Jan; 106 (1): 152-9.
- Chanussot F, et al. Prevenção, por via alimentar (n-6), fosfatidilcolinas poliinsaturadas de colestase intra-hepática induzida pela Ciclosporina A em animais. Life Sci. 2003 Jun 13; 73 (4): 381-92.Karaman A, et al. Efeito protector da fosfatidilcolina poliinsaturada na lesão hepática induzida por obstrução biliar em ratos. J Pediatr Surg. 2003 Sep; 38 (9):1341-7.Karaman A, et al. Efeito protector da fosfatidilcolina poliinsaturada na lesão hepática induzida por obstrução biliar em ratos. J Pediatr Surg. 2003 Sep; 38 (9):1341-7.
- Stremmel W, et al. Protecção das mucosas pela fosfatidilcolina. Cava Dis. 2012; 30 Suppl 3: 85-91.
- Parlesak A, et al. Os sais biliares primários conjugados reduzem a permeabilidade da endotoxina através das células epiteliais intestinais e sinergizam com a fosfatidilcolina na supressão da produção de citoquinas inflamatórias. Hematócrito Med. 2007 Out; 35 (10):2367-74.Mitzscherling K, et al. A fosfatidilcolina reverte o aumento da permeabilidade das endotoxinas transepiteliais induzido pelo etanol e elimina a activação dos leucócitos transepiteliais. Alcohol Clin Exp Res. 2009 Mar;33(3):557-62.Buzzetti E, et al. A patogénese múltipla da doença hepática gorda não alcoólica (NAFLD). Metabolismo. 2016 ago; 65 (8):1038-48.
- El Hadi H, et al. Vitamina E como um tratamento para a doença hepática gordurosa não-alcoólica: realidade ou mito? Antioxidantes (Basileia). 2018 Jan 16; 7(1).
- Bugianesi e, et al. Um ensaio controlado aleatório com metformina versus vitamina e ou dieta prescritiva em doença hepática gorda não-alcoólica. Am J Gastroenterol. 2005 May; 100 (5): 1082-90.
- Sanyal AJ, et al. Pioglitazona, vitamina e ou placebo para esteatohepatite não-alcoólica. N Engl J Med. 2010 May 6; 362 (18):1675-85.
- Lavine JE. Tratamento da vitamina E da esteatohepatite não-alcoólica em crianças: um estudo piloto. J Pediatra. 2000 Jun; 136 (6): 734-8.
- Peh HY, et al. Terapia de vitamina E para além do cancro: tocoferol versus tocotrienol. Farmacol Ther. 2016 Jun; 162: 152-69.
- Qureshi AA, et al. Modulação Dose-dependente dos parâmetros lipídicos, citoquinas e ARN pelo delta-tocotrienol em indivíduos hipercolesterolémicos limitados à dieta Aha Step-1. Brit J of Med & Med Res. 2015;6(4):351-66.
- Qureshi AA, et al. Impacto do delta-tocotrienol nos biomarcadores inflamatórios e stress oxidativo em indivíduos hipercolesterolémicos. Cardiologia Clin Exp. 2015;6(4):1000367.
- Zaiden N, et al. Os tocotrienóis gama delta reduzem a síntese hepática de triglicéridos e a secreção VLDL. J Ateroscler Thromb. 2010 Oct 27; 17(10):1019-32.
- Magosso e, et al. Tocotrienóis para a normalização da resposta hepática ecogénica no fígado gordo nãoalcoólico: um ensaio clínico aleatorizado, controlado com placebo. Nutr J. 2013 Dec 27; 12(1):166.
- Pervez MA, et al. Efeitos da suplementação com Delta-tocotrienol nas enzimas hepáticas, inflamação, stress oxidativo e esteatose hepática em doentes com doença hepática gorda não-alcoólica. Turk J Gastroenterol. 2018 Mar; 29(2):170-176.
- Abenavoli L, et al. Cardo de leite em doenças hepáticas: passado, presente, futuro. Phytother Res. 2010 Oct;24(10):1423-32.Valenzuela A, et al. Selectividade da silimarina no aumento do teor de GSH em diferentes tecidos do rato. Planta Med. 1989 Out;55 (5): 420-2.
- Rui YC. Avanços nos estudos farmacológicos da silimarina. Madame Inst Oswaldo Cruz. 1991; 86 Suppl 2: 79-85.
- Gu m, et al. A silimarina Ameliora a disfunção metabólica associada à obesidade induzida pela dieta através da activação do Receptor Farnesil X. Farmacol Frontal. 2016 set 28; 7: 345.
- Ali AH, et al. Avanços recentes no desenvolvimento de agonistas do receptor x farnesóide. Ann Transl Med. 2015 Jan; 3(1):5.
- Traussnigg S, et al. Eficácia e segurança do agonista px-104 do receptor do farnesóide X não esteróide em doentes com doença hepática gorda não alcoólica (NAFLD). Zeitschrift für Gastroenterologie. 2017 May; 55(05):A71.
- Zhong S, et al. O efeito terapêutico da silimarina no tratamento da doença gorda não-alcoólica: uma meta-análise (PRISMA) de ensaios de controlo aleatorizados. Medicine (Baltimore). 2017 Dec; 96 (49):e9061.
- Hajiaghamohammadi AA, et al. Efeitos do tratamento com metformina, pioglitazona e silimarina em doença hepática gorda não alcoólica: um estudo-piloto controlado aleatorizado. Hepat Mon. 2012 ago; 12 (8):e6099.
- Birdsall TC, et al. Berberina: potencial terapêutico de um alcalóide encontrado em várias plantas medicinais. Altern Med Rev. 1997; 2: 94-103.
- Imanshahidi M, et al. Efeitos farmacológicos e terapêuticos de Berberis vulgaris e da sua constituinte activa, Berberina. Phytother Res. 2008 Ago;22(8):999-1012.
- Zhu X, et al. Os mecanismos potenciais da berberina no tratamento da doença hepática gorda não-alcoólica. Molecula. 2016 out 14; 21 (10).
- Lan J, et al. Meta-análise do efeito e segurança da berberina no tratamento da diabetes mellitus tipo 2, hiperlipemia e hipertensão. J Ethnopharmacol. 2015 Fev 23; 161: 69-81.
- Sun R, et al. A berberina administrada por via oral modula o metabolismo lipídico hepático alterando o metabolismo do ácido biliar microbiano e a via de sinalização Intestinal FXR. Mol Pharmacol. 2017 Fev; 91(2):110-122.
- Guo T, et al. A berberina Ameliora a esteatose hepática e suprime a inflamação do fígado e do tecido adiposo em ratinhos com obesidade induzida pela dieta. SIC Rep. 2016 Mar 3; 6: 22612.
- Schattenberg JM, et al. JNK1 mas não JNK2 promove o desenvolvimento de esteatohepatite em ratos. Hepatologia. 2006 Jan; 43 (1): 163-72.
- Han J, et al. Modular a microbiota intestinal como um mecanismo anti-diabético da berberina. Med Sci Monit. 2011; 17: RA164-7.
- Gu L, et al. A berberina ameliorata as lesões epiteliais intestinais da junção estanque e regula as vias da quinase da cadeia de luz da myosina num modelo de endotoxinemia em ratos. J Infect Dis. 2011 Jun 1; 203(11):1602-12.
- Li N, et al. A berberina atenua a perturbação da junção apertada induzida pela citoquina pro-inflamatória num modelo in vitro de células epiteliais intestinais. Eur J Pharm Sci. 2010 Abr 16; 40(1):1-8.
- Ma X, et al. A patogénese da Diabetes Mellitus por Stress oxidativo e inflamação: a sua inibição pela Berberina. Farmacol Frontal. 2018 Jul 27; 9: 782.
- Yan HM, et al. Eficácia da berberina em doentes com doença hepática gorda não alcoólica. PLoS Um. 2015 ago 7; 10(8):e0134172.
- Ma YY, et al. Efeitos dos probióticos na doença do fígado gordo não-alcoólica: uma meta-análise. World J Gastroenterol. 2013 out 28; 19(40):6911-8.
- Vajro P, et al. Efeitos do Lactobacillus rhamnosus estirpe GG na doença hepática pediátrica relacionada com a obesidade. J Pediatra Gastroenterol Nutr. 2011 Jun; 52 (6):740-3.
- Alisi A, et al. Ensaio clínico aleatorizado: os efeitos benéficos da VSL#3 em crianças obesas com esteatohepatite não alcoólica. Farmacol De Pimentão. 2014 Jun; 39(11):1276-85.
- Pérez-Rubio KG, et al. Efeito da administração de Berberina na síndrome metabólica, sensibilidade à insulina e secreção de insulina. Metab Syndr Relat Disord. 2013 out; 11 (5):366-9.
- Iacono A, et al. Probióticos como uma estratégia terapêutica emergente para tratar o NAFLD: foco em mecanismos moleculares e bioquímicos. J Nutr Biochem. 2011 ago; 22 (8):699-711.
- Honda Y, et al. Eficácia da glutationa no tratamento da doença do fígado gordo não-alcoólica: um estudo piloto aberto, multicêntrico de braço único. BMC Gastroenterol. 2017 ago 8; 17(1):96.
- Dentico P, et al. . Recenti Prog Med. 1995 Jul-Ago; 86 (7-8): 290-3.
- Khoshbaten M, et al. A N-acetil-cisteína melhora a função hepática em doentes com doença hepática gorda não alcoólica. Hepatite Mon. 2010;10(1):12-16.
- Muto C, et al. O gama-tocotrienol reduz o nível de triacilglicerol nos hepatócitos primários no rato através da regulação do metabolismo dos ácidos gordos. J Clin Biochem Nutr. 2013;52(1):32-37.
- Parker HM, et al. Suplementação Omega-3 e doença hepática gorda não alcoólica: uma revisão sistemática e meta-análise. Hepatol. 2012;56(4):944-51.
Vitamina E
Como um estresse oxidativo bater e diminuição das defesas antioxidantes tem sido proposta como um fator que leva ao desenvolvimento de NAFLD, não deve ser surpreendente que os antioxidantes têm sido investigados como um potencial tratamento para a condição.
 vitamina E foi estudada em vários ensaios clínicos para o tratamento do NAFLD, tanto como terapêutica autónoma como adjuvante. Numa revisão destes estudos, a dose de vitamina e variou entre 400 e 1200 UI/dia e a duração do estudo foi de 24 semanas a mais de dois anos. Os resultados foram geralmente positivos, mostrando que, quando a vitamina E foi incluída, foram observadas melhorias na histologia, esteatose e/ou níveis de transaminases., Na pediatria com NAFLD, a vitamina E também foi estudada como terapia. Em um estudo piloto open-label, incluindo 11 crianças com NAFLD, a suplementação de entre 400 a 1200 UI de vitamina E, de quatro a dez meses foi encontrado a normalização das transaminases e da fosfatase alcalina níveis durante o tratamento, no entanto, voltaram para a anormal, uma vez que o tratamento foi interrompido. A ecogenicidade hepática não se alterou no decurso do tratamento.
vitamina E foi estudada em vários ensaios clínicos para o tratamento do NAFLD, tanto como terapêutica autónoma como adjuvante. Numa revisão destes estudos, a dose de vitamina e variou entre 400 e 1200 UI/dia e a duração do estudo foi de 24 semanas a mais de dois anos. Os resultados foram geralmente positivos, mostrando que, quando a vitamina E foi incluída, foram observadas melhorias na histologia, esteatose e/ou níveis de transaminases., Na pediatria com NAFLD, a vitamina E também foi estudada como terapia. Em um estudo piloto open-label, incluindo 11 crianças com NAFLD, a suplementação de entre 400 a 1200 UI de vitamina E, de quatro a dez meses foi encontrado a normalização das transaminases e da fosfatase alcalina níveis durante o tratamento, no entanto, voltaram para a anormal, uma vez que o tratamento foi interrompido. A ecogenicidade hepática não se alterou no decurso do tratamento.
tocotrienóis são a família menos estudada das formas naturais de vitamina E, com os tocoferóis, mais frequentemente encontrados na natureza, dominando a investigação científica. No entanto, os tocotrienóis são antioxidantes potentes, citados em algumas pesquisas como tendo 40 a 60 vezes o potencial antioxidante dos tocoferóis. Foi demonstrado que os tocotrienóis melhoram o colesterol total e as suas fracções, reduzindo o colesterol total e o colesterol LDL em 15 a 20% e os triglicéridos em quase 30%. Os tocotrienóis também demonstraram ter efeitos anti-inflamatórios e antioxidantes in vivo, reduzindo os níveis de proteína C-reactiva de alta sensibilidade (hs-CRP) e reduzindo a oxidação das LDL.
tocotrienóis também foram estudados como tratamento para o NAFLD. Em doentes com NAFLD diagnosticado por ultra-som, 200 mg de tocotrienóis misturados (obtidos a partir de óleo de palma, com uma fracção gama elevada e um adicional de 61 mg de alfa-tocoferóis) tomados duas vezes por dia durante um ano, demonstrou normalizar significativamente a resposta hepática ecogénica e a taxa de remissão em comparação com o placebo. Em um segundo estudo, incluindo pacientes com ultra-som-diagnosticado NAFLD e elevação das transaminases, 300 mg de tocotrienóis (90:10 delta:gama mistura) duas vezes ao dia por 12 semanas, diminuiu significativamente a aspartato aminotransferase (AST), alanina aminotransferase (ALT), hs-CRP, e malondialdehyde (um marcador de estresse oxidativo) níveis, bem como fígado gordo pontuação do índice em comparação com o placebo.O cardo de leite (Silybum marianum) é possivelmente o mais conhecido Botânico Protector do fígado. A silimarina, uma mistura dos constituintes activos do cardo do leite, e a silibinina, o composto mais activo encontrado no seu interior, foram demonstradas em estudos em animais para reduzir as lesões hepáticas causadas pelo acetaminofeno, álcool, sobrecarga de ferro e radiação entre outras substâncias conhecidas tóxicas para o fígado. A silimarina demonstrou aumentar os níveis de glutationa, um poderoso antioxidante, tanto no fígado como nos intestinos. Também reduz a peroxidação lipídica, que danifica membranas celulares, alterando sua função, e possivelmente causando morte celular.
silibinina e silimarina demonstraram activar um receptor de ácido biliar nuclear conhecido como receptor farnesóide X (FXR) no fígado, vias inflamatórias para baixo e correcção da resistência à insulina e dislipidemia induzidas pela alimentação com dieta rica em gorduras. FXR é um regulador chave do ácido biliar, glicose e equilíbrio lipídico no corpo. Medicamentos que interagem com FXR de uma forma semelhante a estes cardo de leite compostos derivados também estão sendo investigados para o tratamento da NAFLD e metabólicas relacionadas desafios.
os estudos clínicos também demonstraram que o cardo lácteo melhora vários parâmetros associados ao NAFLD. Uma meta-análise de 2017 concluiu que o tratamento com cardo leiteiro reduz significativamente a ALT e a AST em-5, 08 UI/L e-5, 44 UI/L, respectivamente, em doentes com NAFLD. As doses variaram entre 140 mg uma vez ao dia e 200 mg três vezes ao dia, durante 8 a 24 semanas. Na dose mais baixa de 140 mg diários, após 8 semanas, observaram-se melhorias significativas na glucose sanguínea em jejum (FBG), no perfil lipídico e nos níveis séricos de insulina para além das reduções de AST e ALT de 56 para 37.77 UI/L e 78, 73 A 53, 05 UI / L, respectivamente.
Berberina
Berberina, o alcalóide amarelo-alaranjado encontrado em vegetais, como a raiz e casca de uva de Oregon, goldenseal e barberry, é outra substância botanicamente derivada que tem numerosos mecanismos pelos quais pode ajudar a proteger contra o NAFLD e apoiar a sua resolução.,,
os efeitos antidiabéticos e de equilibragem lipídica da berberina foram demonstrados em vários ensaios clínicos, e  podem ser meios através dos quais a berberina afecta positivamente a função hepática. A berberina demonstrou alterar a expressão genética relacionada com o metabolismo e o metabolismo do ácido biliar através de vias que também envolvem FXR. Em estudos em animais, a berberina demonstrou ter o efeito de prevenir a obesidade associada a HFD e a acumulação hepática de triglicéridos em ratinhos de tipo selvagem (normal), mas não naqueles que tiveram a eliminação genética da expressão intestinal FXR. A berberina também demonstrou suprimir a inflamação associada à obesidade e a esteatose hepática em ratinhos, diminuindo a fosforilação do complexo inflamatório conhecido como JNK1, uma proteína cinase implicada no desenvolvimento de esteatohepatite. O JNK1 é fortemente ativado por estressores ambientais e citocinas pró-inflamatórias.
podem ser meios através dos quais a berberina afecta positivamente a função hepática. A berberina demonstrou alterar a expressão genética relacionada com o metabolismo e o metabolismo do ácido biliar através de vias que também envolvem FXR. Em estudos em animais, a berberina demonstrou ter o efeito de prevenir a obesidade associada a HFD e a acumulação hepática de triglicéridos em ratinhos de tipo selvagem (normal), mas não naqueles que tiveram a eliminação genética da expressão intestinal FXR. A berberina também demonstrou suprimir a inflamação associada à obesidade e a esteatose hepática em ratinhos, diminuindo a fosforilação do complexo inflamatório conhecido como JNK1, uma proteína cinase implicada no desenvolvimento de esteatohepatite. O JNK1 é fortemente ativado por estressores ambientais e citocinas pró-inflamatórias.
Berberina também actua no intestino. Afecta não só o equilíbrio microbiano intestinal, mas também influencia directamente a permeabilidade intestinal, melhorando a integridade da junção apertada em animais sujeitos a endotoxemia ou culturas celulares tratadas com citoquinas pró-inflamatórias.Foram também demonstrados efeitos anti-inflamatórios directos.
os benefícios da berberina no NAFLD também foram demonstrados clinicamente num ensaio clínico aleatorizado, controlado em paralelo, aberto. Em doentes com NAFLD, a berberina demonstrou restaurar a arquitectura hepática normal, os lípidos e o metabolismo do açúcar no sangue, com melhorias significativas observadas na população que apenas implementou alterações no estilo de vida.
probióticos
dada a relação entre os muitos distúrbios do sistema digestivo e elevação das enzimas hepáticas, não é surpreendente que os probióticos também tenham sido estudados como um tratamento para o NAFLD. Uma meta-análise recente resume bem as descobertas coletivas.
cento e trinta e quatro pacientes com diagnóstico de NAFL/NASH biópsia hepática foram incluídos nesta análise, e cada intervenção utilizada em quatro randomizados, controlados elegíveis para esta meta-análise foi única (Lactobacillus bulgaricus e Streptococcus thermophilus, por três meses; Lactobacillus GG por oito semanas; Bifidobacterium longum e fructooligosaccharides (FOS) por 24 semanas; e uma combinação patenteada de Lactobacillus plantarum, L. delbrueckii, L. acidophilus, L. rhamnosus, e Bifidobacterium bifidum seis meses). A dosagem de probióticos variou de 500 milhões a 12 bilhões de unidades formadoras de colônias (CFO) diariamente. Os tratamentos probióticos demonstraram diminuir significativamente os níveis de ALT e AST em -23, 71 UI/L e -19, 77 UI / L, respectivamente. Observaram-se também melhorias significativas nos níveis de colesterol total, factor de necrose tumoral (TNF) – α e resistência à insulina.
dois ensaios clínicos adicionais investigaram probióticos como tratamento para o NAFLD pediátrico. Num estudo piloto com dupla ocultação, controlado por placebo, 12 crianças, com uma idade média de 10 anos.Aos 7 anos de idade, com alterações hepáticas de gordura diagnosticadas por ultra-som e elevação persistente das transaminases, foram administrados 12 mil milhões de CFO de L. rhamnosus GG ou placebo diariamente durante 8 semanas. O tratamento com probiótico reduziu significativamente os níveis de ALT em comparação com o placebo, no entanto, a ecogenicidade hepática e os níveis de AST não se alteraram. Adicionalmente, os anticorpos anti-peptidoglicanos-polissacáridos, um indicador de bactérias ou de translocação da membrana bacteriana através da barreira intestinal, diminuíram significativamente em crianças a receber o probiótico em comparação com o placebo. O segundo estudo investigou o tratamento de crianças com NAFLD comprovado por biopsia com VSL # 3, uma mistura de alta potência de 8 estirpes probióticas (incluindo Streptococcus thermophilus, 3 Bifidobacteria spp., e 4 Lactobacillus spp.), em comparação com o placebo. Em crianças que recebem o probiótico, fígado gordo pontuação significativamente melhorada com a probabilidade de nenhum, leve, moderado, ou grave fígado gordo no final do estudo, sendo 21%, 70%, 9% e 0% em comparação com 0%, 7%, 76% e 17% no grupo placebo.
conclusão
há uma ampla gama de opções seguras e eficazes disponíveis que suportam a restauração da saúde em aqueles com NAFLD. Embora cada indivíduo possa ter diferentes mecanismos subjacentes que contribuem para a disfunção hepática e alterações inflamatórias, cada um destes agentes naturais de suporte—e muitos outros (Ver Tabela 2)—pode suportar a função hepática normal em indivíduos com estes desafios.
Table 2: Nutritional and botanical interventions for NAFLD. Nutrientes como estes devem ser utilizados sob a orientação de um profissional de saúde qualificado e licenciado.
| Nutrientes | Dosagem | Mecanismo de |
| a Fosfatidilcolina (PC), uma fonte dietética de colina | 1,5 g duas vezes por dia com as refeições (PC) OU 200 mg duas vezes ao dia (colina) | Colina mais comum é a deficiência dietética. O PC é necessário para a produção de barreira biliar e protetora da mucosa gastrointestinal. |
| sementes de cardo de leite | 140 a 200 mg uma a três vezes ao dia | Hepatoprotecção. Suporta os níveis de glutationa hepática, estabiliza a bomba de exportação de sal biliar (bsep) e activa as vias FXR. |
| o HCl de Berberina | 500 mg duas a três vezes ao dia | melhora os perfis da glucose sérica e dos lípidos, reduzindo também o teor de gordura hepática. |
| probióticos, incluindo estirpes como B. longo, B. bifidum, S. thermophilus, L. rhamnosus, L. acidophilus, e L. plantarum | 12 mil milhões de unidades formadoras de colónias (CFO) diariamente | melhorou a função da barreira epitelial intestinal e reduziu a inflamação intestinal e sistémica. |
| acetil-glutationa | 300 mg por dia | melhora a capacidade de desintoxicação dos hepatócitos. |
| N-acetilcisteína (NAC) | 500-600 mg duas vezes por dia, melhor tomada com o estômago vazio | NAC bloqueia a propagação da peroxidação lipídica e suporta os níveis hepáticos de glutationa. |
| a Vitamina E (tocoferóis)
OU Tocotrienóis |
400 1200 UI diárias com alimentos
200 a 300 mg duas vezes por dia com alimentos |
Protecção antioxidante.
tocotrienóis atenuam a acumulação de triglicéridos regulando a sintetase de ácidos gordos e as enzimas palmitoiltransferase da carnitina, conduzindo a uma redução da inflamação hepática e do stress reticulum endoplásmico. |
| Omega-3 os ácidos gordos essenciais | 2 – 4 g / dia, com as refeições | Omega-3 ácidos graxos poliinsaturados são conhecidos para downregulate sterol regulatory element-binding protein-1c e regular o receptor activado receptor alfa, assim, favorecendo a oxidação dos ácidos gordos e reduzir a esteatose. |