modele comune de legătură în structurile organice
metodele revizuite mai sus pentru desenarea structurilor Lewis și determinarea sarcinilor formale pe atomi sunt un punct de plecare esențial pentru un chimist organic novice și funcționează destul de bine atunci când se ocupă de structuri mici și simple. Dar, după cum vă puteți imagina, aceste metode devin nerezonabil de obositoare și consumă mult timp atunci când începeți să vă ocupați de structuri mai mari. Ar fi nerealist, de exemplu, să vă cerem să desenați structura Lewis de mai jos (a unuia dintre cele patru blocuri nucleozidice care alcătuiesc ADN-ul) și să determinați toate sarcinile formale prin adăugarea, pe bază atom cu atom, a electronilor de valență.
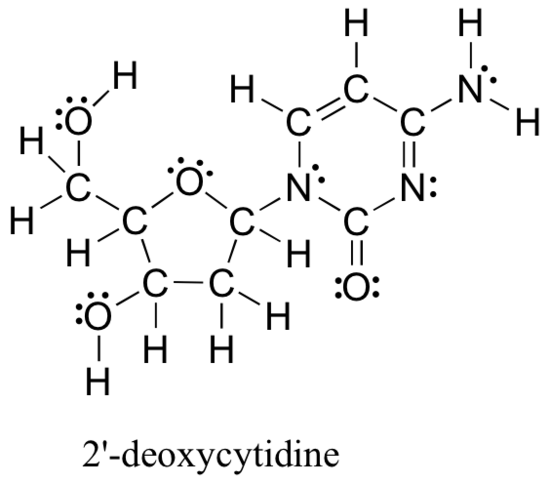
și totuși, ca chimiști organici, și mai ales ca chimiști organici care se ocupă de molecule biologice, veți fi de așteptat în curând să desenați structura moleculelor mari, cum ar fi aceasta, în mod regulat. În mod evident, trebuie să dezvoltați capacitatea de a desena rapid și eficient structuri mari și de a determina Taxe formale. Din fericire, această abilitate nu este teribil de greu de găsit – tot ce trebuie este câteva comenzi rapide și unele practici de recunoaștere a modelelor comune de legătură.
să începem cu carbonul, cel mai important element pentru chimiștii organici. Se spune că carbonul este tetravalent, ceea ce înseamnă că tinde să formeze patru legături. Dacă vă uitați la structurile simple ale metanului, metanolului, etanului, etenei și etinei din figurile din secțiunea anterioară, ar trebui să recunoașteți rapid că în fiecare moleculă, atomul de carbon are patru legături și o sarcină formală de zero.
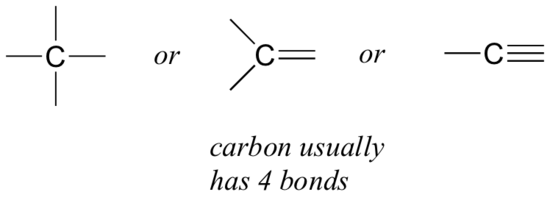
acesta este un model care se menține în majoritatea moleculelor organice pe care le vom vedea, dar există și excepții.
în dioxidul de carbon, atomul de carbon are legături duble cu oxigenul pe ambele părți (O=C=o). Mai târziu în acest capitol și de-a lungul acestei cărți vom vedea exemple de ioni organici numiți ‘carbocații’ și carbanioni’, în care un atom de carbon poartă o sarcină formală pozitivă sau negativă, respectiv. Dacă un carbon are doar trei legături și o coajă de valență neumplută (cu alte cuvinte, dacă nu îndeplinește regula octetului), va avea o sarcină formală pozitivă.
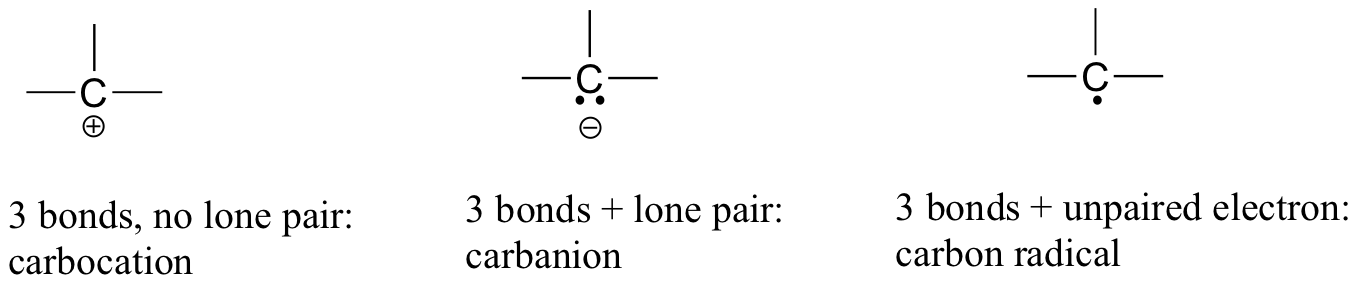
dacă, pe de altă parte, are trei legături plus o pereche singură de electroni, va avea o sarcină formală de -1. O altă posibilitate este un carbon cu trei legături și un singur electron nepereche (radical liber): în acest caz, carbonul are o sarcină formală de zero. (O ultimă posibilitate este o specie foarte reactivă numită ‘carbenă’, în care un carbon are două legături și o singură pereche de electroni, oferindu-i o sarcină formală de zero. Puteți întâlni carbene în cursuri de chimie mai avansate, dar acestea nu vor fi discutate mai departe în această carte).
ar trebui să utilizați cu siguranță metodele pe care le-ați învățat pentru a verifica dacă aceste taxe formale sunt corecte pentru exemplele date mai sus. Mai important, va trebui, înainte de a progresa mult mai departe în studiul chimiei organice, să recunoașteți pur și simplu aceste tipare (și tiparele descrise mai jos pentru alți atomi) și să puteți identifica carbonii care poartă sarcini formale pozitive și negative printr-o inspecție rapidă.
modelul hidrogenilor este ușor: atomii de hidrogen au o singură legătură și nu au o sarcină formală. Excepțiile de la această regulă sunt protonul, H+ și ionul hidrură, H -, care este un proton plus doi electroni. Pentru că ne concentrăm în această carte asupra chimiei organice aplicate lucrurilor vii, totuși, nu vom vedea protoni și hidruri goale ca atare, deoarece sunt prea reactivi pentru a fi prezenți în această formă în soluție apoasă. Cu toate acestea, ideea unui proton va fi foarte importantă atunci când discutăm despre chimia acido-bazică, iar ideea unui ion hidrură va deveni foarte importantă mult mai târziu în carte, când vom discuta despre reacțiile organice de oxidare și reducere. De regulă, însă, toți atomii de hidrogen din moleculele organice au o singură legătură și nu au o sarcină formală.
să ne întoarcem la atomii de oxigen. De obicei, veți vedea o legătură de oxigen în trei moduri, toate îndeplinind regula octetului.
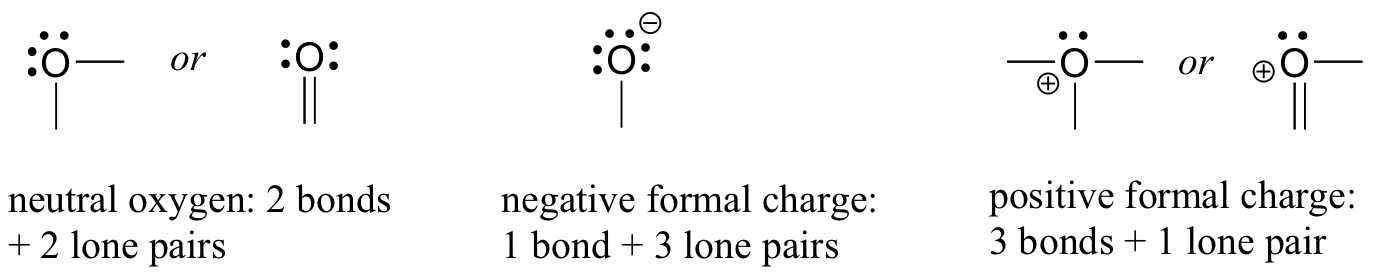
dacă are două legături și două perechi singure, ca în apă, va avea o sarcină formală de zero. Dacă are o legătură și trei perechi singure, ca în ionul hidroxid, va avea o sarcină formală de-1. Dacă are trei legături și o pereche singură, ca în ionul hidroniu, va avea o sarcină formală de +1.
când vom ajunge la discuția noastră despre chimia radicalilor liberi în capitolul 17, vom vedea alte posibilități, cum ar fi în cazul în care un atom de oxigen are o legătură, o singură pereche și un electron nepereche (radical liber), oferindu-i o sarcină formală de zero. Deocamdată, însă, concentrați-vă asupra celor trei exemple principale non-radicale, deoarece acestea vor explica practic tot ceea ce vedem până la capitolul 17.
azotul are două modele majore de legătură, ambele îndeplinind regula octetului:
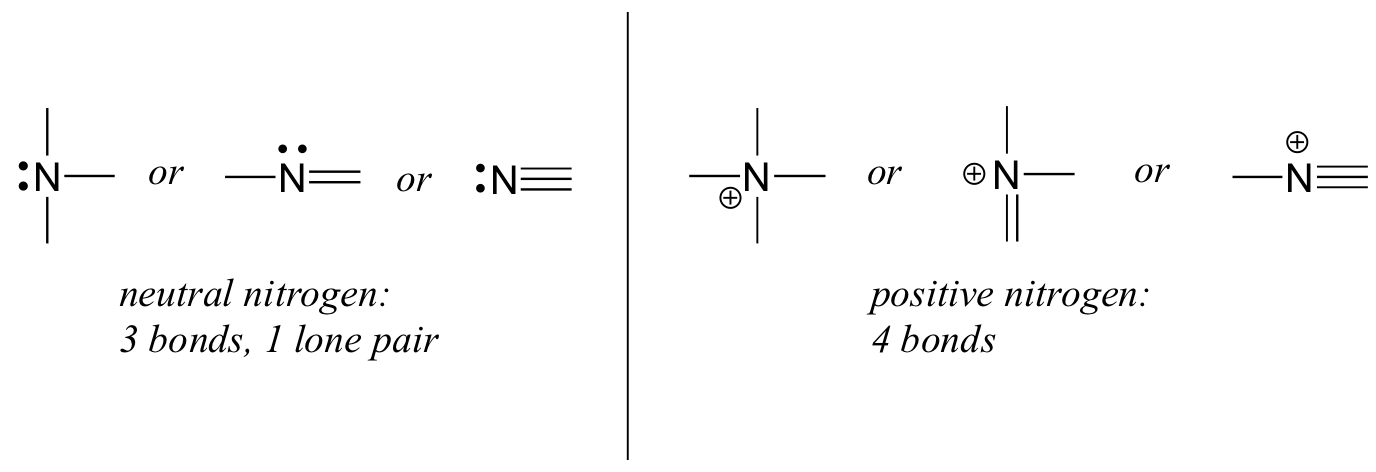
dacă un azot are trei legături și o pereche singură, are o sarcină formală de zero. Dacă are patru legături (și nici o pereche singură), are o taxă formală de +1. Într-un model de legătură destul de neobișnuit, azotul încărcat negativ are două legături și două perechi singulare.
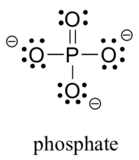
două elemente din al treilea rând se găsesc în mod obișnuit în moleculele organice biologice: sulf și fosfor. Deși ambele elemente au alte modele de legătură care sunt relevante în chimia de laborator, într-un context biologic sulful urmează aproape întotdeauna același model de legătură/sarcină formală ca oxigenul, în timp ce fosforul este prezent sub formă de Ion fosfat (PO43 -), unde are cinci legături (aproape întotdeauna la oxigen), fără perechi singulare și o sarcină formală de zero. Amintiți-vă că elementele din al treilea rând al tabelului periodic au orbitali d în învelișul lor de valență, precum și orbitali s și p și, prin urmare, nu sunt legați de regula octetului.
în cele din urmă, halogenii (fluor, clor, brom și iod) sunt foarte importanți în chimia organică de laborator și medicinală, dar mai puțin obișnuiți în moleculele organice naturale. Halogenii din compușii organici sunt de obicei văzuți cu o legătură, trei perechi singulare și o sarcină formală de zero. Uneori, mai ales în cazul bromului, vom întâlni specii reactive în care halogenul are două legături (de obicei într-un inel cu trei membri), două perechi solitare și o sarcină formală de +1.

aceste reguli, dacă sunt învățate și internalizate astfel încât nici măcar nu trebuie să vă gândiți la ele, vă vor permite să desenați structuri organice mari, completate cu taxe formale, destul de repede.
odată ce ați reușit să desenați structuri Lewis, nu este întotdeauna necesar să desenați perechi singure pe heteroatomi, deoarece puteți presupune că numărul adecvat de electroni este prezent în jurul fiecărui atom pentru a se potrivi cu sarcina formală indicată (sau lipsa acesteia). Ocazional, totuși, perechile singure sunt desenate dacă acest lucru ajută la clarificarea unei explicații.