înapoi la scrierea structurilor Lewis pentru Molecule
structura scheletului unei molecule covalente poate fi adesea determinată luând în considerare valențele atomilor constituenți. De obicei, atomul care formează cel mai mare număr de legături se găsește în centrul scheletului, unde se poate conecta la numărul maxim de alți atomi.
Exemplul 1: acidul hipocloros are formula moleculară HOCl. Desenați o formulă structurală
.
soluție există mai multe modalități posibile de a lega atomii împreună
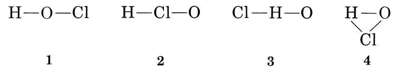
valența obișnuită a lui H este 1 și astfel structurile 3 și 4, care au două legături cu H, pot fi eliminate. Valența obișnuită a Cl este, de asemenea, 1, astfel încât structura 2 poate fi, de asemenea, exclusă. Structura 1 arată h formând o legătură, Cl formând una și o formând două, în acord cu valențele obișnuite și astfel este aleasă.
Numărul total de electroni de valență disponibili este 1 din H plus 6 din O plus 7 din Cl sau 14. Umplându-le în scheletul pe care îl avem
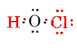
rețineți că O, care avea cea mai mare valență, se află în centrul scheletului.
Exemplul 2:
desenați o formulă structurală pentru hidroxilamină, NH3O.
soluția în acest caz N are cea mai mare valență (3), urmată de O (2) și H (1). Atât N, cât și O pot forma „punți” între alți atomi, dar H nu poate. Prin urmare, plasăm N și O în centrul scheletului pentru a da
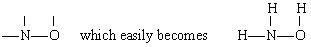
prin adăugarea celor trei atomi de H.
există un total de 5 + 3 + 6 = 14 electroni de valență din N, 3h și O. acestea pot fi plasate după cum urmează:
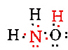
odată ce diagrama Lewis a fost determinată, formula moleculară este adesea rescrisă pentru a ne aminti care este formula structurală. De exemplu, formula moleculară pentru hidroxilamină este de obicei scrisă NH2OH în loc de NH3O pentru a ne reaminti că doi H sunt legați de N și unul de O. Se presupune că persoana care citește formula își va da seama că N și o au fiecare câte un electron de valență lăsat să împartă unul cu celălalt, conectând —NH2 cu —OH. În unele cazuri, mai mult de o structură de schelet va satisface valența fiecărui atom și regula octetului. De exemplu, puteți verifica dacă formula moleculară C2H6O corespunde ambelor dintre următoarele:
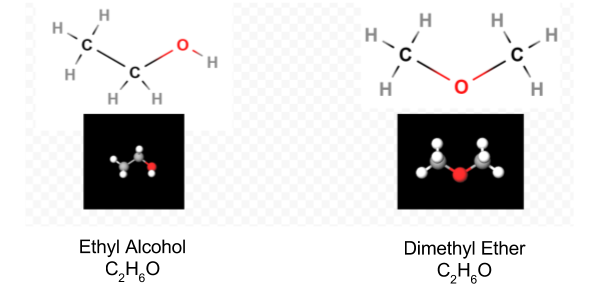
într-un astfel de caz, putem decide doar ce structură moleculară avem prin experiment. Proprietățile alcoolului etilic atunci când sunt diluate cu apă și consumate sunt bine cunoscute. Dimetil eterul este un gaz. Ca și eterul dietilic utilizat în sălile de operație, este foarte exploziv și vă poate adormi. Două molecule, cum ar fi dimetil eter și alcool etilic, care au aceeași formulă moleculară, dar formule structurale diferite se spune că sunt izomeri.
înapoi la scrierea structurilor Lewis pentru Molecule
mulțumiri:
moleculele C2h6o și structurile lor scheletice au fost create folosind MolView.