Introducere
canalele de potasiu cu tensiune formează o familie mare și diversă, care este conservată evolutiv. Există 40 de gene ale canalului de potasiu cu tensiune umană aparținând a 12 subfamilii. Aceste canale kV prezintă distribuții largi în sistemul nervos și în alte țesuturi. Pentru celulele excitabile, cum ar fi neuronii, cardiomiocitele și mușchii, canalele KV reglează forma de undă și modelul de ardere a potențialelor de acțiune. Canalele KV pot regla, de asemenea, volumul celular, proliferarea și migrarea unei game largi de tipuri de celule.
canalele de potasiu cu tensiune (KV) aparțin uneia dintre cele mai mari și foarte conservate evolutiv familii de canale ionice . Fiecare canal KV conține patru subunități de formare a porilor similare sau identice și poate conține, de asemenea, subunități auxiliare de formare a porilor care ar putea afecta funcția și/sau localizarea canalului . Fiecare subunitate de formare a porilor a canalelor KV conține șase segmente transmembranare (S1-S6), primele patru segmente transmembranare (S1-S4) constituind senzorul de tensiune și ultimele două segmente transmembranare flancând o buclă de pori (S5-P-S6) ca domeniu al porilor. În plus față de localizarea cromozomială a fiecărei gene de canal KV la om, șoarece și șobolan, proprietățile fiziologice și farmacologice ale canalului și distribuția țesuturilor și fiziopatologia acestuia au fost furnizate de baza de date a canalelor ionice de către Subcomitetul pentru canalele de potasiu cu tensiune ale Comitetului de nomenclatură al Uniunii Internaționale de Farmacologie (NC-IUPHAR). Acest articol prezintă o introducere în diversitatea și funcțiile canalelor de potasiu cu tensiune.
conservarea evolutivă a canalelor de potasiu
selectivitatea K+care a apărut în procariote este conservată într-un număr mare de canale de potasiu cu o diversitate remarcabilă . După cum se arată în Figura 1, Un arbore evolutiv al superfamiliei canalului cationic cu tensiune poate fi propus pe baza comparației genelor canalului din genomul uman cu cele din genomul altor metazoane, inclusiv șoarece, pui, pește puffer, tunicat, muscă de fructe, țânțar, nematod și anemonă marină . Acest arbore evolutiv prevede o singură origine a selectivității K + pentru rectificarea interioară a canalelor de potasiu (Kir), a canalelor de potasiu (KV) cu tensiune și a canalelor de potasiu cu doi pori (K2P). Este important de menționat, totuși, că o selectivitate distinctă K+este probabil asociată cu canalul organelle k+ conservat evolutiv care se află în endozomi și lizozomi .
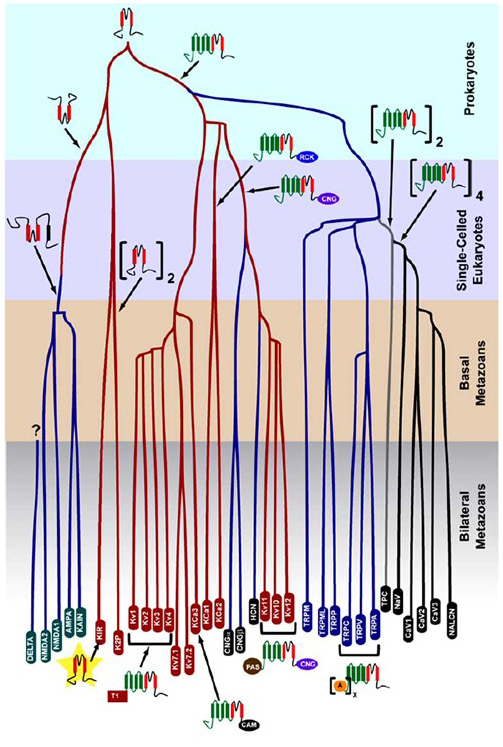
Figura 1. Un arbore evolutiv pentru geneza superfamiliei canalului cationic cu tensiune. Pe baza analizelor la nivel de genom ale canalelor ionice de la cnidari și metazoane bilaterale, acest arbore evolutiv descrie o origine comună pentru K+-selectivitatea canalelor de potasiu (cu nume de familie în ovale roșii), care sunt legate de canalele cationice nucleotidice ciclice tetramerice (CNG), canalele cationice hiperpolarizate (HCN) și canalele TRP, canalele TPC dimerice și canalele monomerice Na+, Ca2+ și nalcn. Lungimile ramurilor nu reflectă timpul. Numele de familie de gene din partea de jos marchează ramuri individuale. Receptorii de glutamat Ionotropic sunt incluși pe baza ipotezei că au provenit dintr-o inversare a domeniului de formare a porilor canalului de potasiu cu două segmente transmembranare (roșu). Domeniul senzorului de tensiune are patru segmente transmembranare (verde). A: ankryin repetă; CAM: calmodulin-domeniu de legare; CNG: domeniul de legare a nucleotidelor ciclice; PAS: domeniu Per-ARNT-Sim; RCK: regulator de conductanță al domeniului K+; T1: domeniu de tetramerizare.
diversitatea canalelor de potasiu cu tensiune
genomul uman conține ~80 de gene ale canalului de potasiu, dintre care 40 de gene codifică subunitățile care formează porii canalului de potasiu cu tensiune care se încadrează în 12 subfamilii (Fig. 2). Subdivizate fiziologic în canale de potasiu de tip A care afișează inactivare rapidă și canale de potasiu redresoare întârziate fără inactivare rapidă, aceste canale KV sunt diverse din punct de vedere molecular și funcțional. Inactivarea rapidă, care poate afecta durata potențialului de acțiune în timpul tragerii repetitive, este evidentă în canalele KV1 care conțin KV1.4 sau Kvcot1, canale KV3 și canale KV4 . Curentul de potasiu redresor întârziat caracterizat inițial de Hodgkin și Huxley pentru rolul său în potențialul de acțiune corespunde probabil canalelor squid KV1 care se pot baza pe editarea ARN pentru a obține diversitatea funcțională flexibilă, deoarece mulți axoni mici ai neuronilor lobului fibrei uriașe fuzionează pentru a forma axonul gigant al calmarului cu o rată de conducere a potențialului de acțiune mai mare .
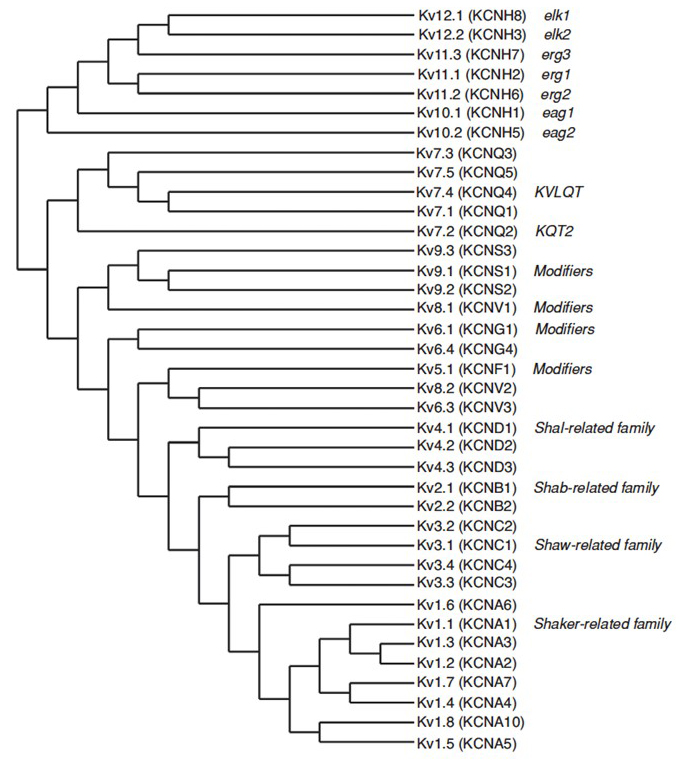
Figura 2. Arbore filogenetic pentru familiile KV1-12. Acest arbore filogenetic este generat pe baza analizelor domeniului hidrofob care conține cele șase segmente transmembranare (S1-S6). Sunt afișate atât numele IUPHAR, cât și numele HGNC (între paranteze), împreună cu alte nume utilizate în mod obișnuit pentru aceste canale de potasiu cu tensiune.
diversitatea remarcabilă a canalelor KV poate fi realizată datorită amestecului și potrivirii subunităților canalului KV. În cadrul fiecăreia dintre familiile KV1, KV2, KV3, KV4 și KV7, se pot forma canale homomerice și heteromerice cu o serie de proprietăți funcționale . Membrii familiei KV2 se pot asambla, de asemenea, cu membrii familiei KV5, KV6 , KV8 sau KV9 cu modele de Expresie mai restrânse în sistemul nervos și mușchii netezi, așa cum este ilustrat schematic în Fig. 3.

Figura 3. Diversitatea canalului KV prin mixarea și potrivirea subunităților canalului care formează porii. (A) canalele kV tetramerice cu proprietăți și distribuție diferite cuprind canale homomerice KV1, KV2, KV3, KV4 și KV7, canale heteromerice formate din membri diferiți în cadrul fiecăreia dintre aceste familii de canale KV și canale heteromerice formate prin asamblarea membrilor familiei KV2 cu membrii familiei KV5, KV6, KV8 sau KV9 . KV5, KV6, KV8 și KV9 familii dau naștere la canale homomerice care sunt silențioase electric probabil datorită reținerii lor în reticulul endoplasmatic, prin urmare sunt denumite KVS. (B) adunarea membrilor familiei KV2 și KVS implică domeniile lor citoplasmatice N – și C-terminale. (C, D) asamblarea membrilor familiei KV2 și KVS dă naștere unor canale heteromerice cu dependență de tensiune diferită (C) și mecanisme de închidere (D) în comparație cu canalele homomerice formate de membrii familiei KV2 .
diferențele funcționale în dependența de tensiune și cinetica canalelor KV stau la baza contribuțiilor lor diferențiale la modularea potențialului de acțiune (Fig. 4). În timp ce canalele KV1, KV4 și KV7 necesită niveluri scăzute de depolarizare a membranei pentru activarea lor, canalele KV2 și KV3 sunt activate printr-o depolarizare mai mare. Primele canale kV activate de joasă tensiune pot afecta pragul de generare a potențialului de acțiune și numărul de potențiale de acțiune generate în timpul depolarizării sau potențialelor sinaptice excitatorii. În schimb, canalele kV activate de înaltă tensiune pot modula durata potențialului de acțiune și modelul de ardere . Cinetica canalelor KV influențează, de asemenea, modalitățile prin care acestea contribuie la generarea potențialului de acțiune. În timp ce canalele KV1 activate de joasă tensiune cu activare rapidă pot afecta pragul potențialului de acțiune și forma de undă, canalele KV3 activate de înaltă tensiune și canalele KV2 pot fi activate secvențial în timpul unui potențial de acțiune datorită diferenței dintre cinetica lor de activare, iar canalele KV2 pot avea efecte mai lungi datorită cineticii lor de inactivare lentă. Mai mult, canalele KV4 cu inactivare rapidă ar putea contribui la diferența în forma de undă a potențialului de acțiune în timpul tragerii repetitive, datorită suprimării activității canalului KV4 prin depolarizare .
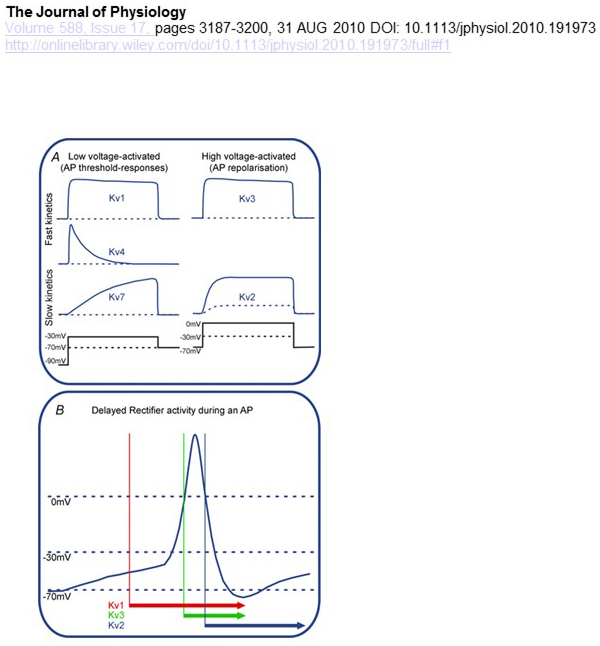
Figura 4. Diferențele funcționale ale canalelor KV și contribuțiile acestora la potențialul de acțiune. (A) diferite canale KV au dependență de tensiune diferită pentru activare și cinetică diferită . (B) canalele KV1 activate de joasă tensiune cu cinetică rapidă se deschid pe măsură ce celula este depolarizată spre pragul de generare a potențialului de acțiune. În timp ce canalele KV2 și KV3 sunt activate de înaltă tensiune, canalele KV3 se deschid mai devreme decât canalele KV2 în timpul unui potențial de acțiune. Canalele KV2 pot dura, de asemenea, mai mult timp pentru a se închide în urma unui potențial de acțiune .
aplicații terapeutice potențiale ale modulatorilor canalelor de potasiu
capacitatea modulatorilor canalelor de potasiu de a modifica modelele potențiale de ardere a acțiunii a ridicat întrebarea dacă acestea ar putea avea valoare terapeutică . Așa cum este indicat în Fig. 5, diverse tulburări neurologice și psihologice pot implica modificări ale modelelor potențiale de ardere a acțiunii, care ar putea fi modulate de activatori și blocanți ai canalului KV . Canalele de potasiu cu tensiune pot juca, de asemenea, un rol în proliferarea și migrarea celulelor; Prin urmare, modulatorii canalului KV au fost luați în considerare pentru tratamente potențiale de creștere a cancerului și metastaze . În Fig. 6, structura canalului KV1.2 este utilizată schematic pentru a ilustra faptul că modulatorii canalului KV pot inhiba activitatea canalului fie prin ocluzia căii de permeabilitate a canalului, ca în cazul toxinelor care blochează porii exteriori și blocanții porilor interiori, fie prin interacțiunea lor cu senzorul de tensiune pentru a stabiliza starea închisă a canalului, ca în cazul toxinelor modificatoare de închidere. Alternativ, unele molecule mici acționează prin legarea de suprimare a fasciculului de mașini, de suprimare a fasciculului modificatori, sau prin interacțiunea cu interfața între α – și β-subunități de a modifica canalul de activitate .
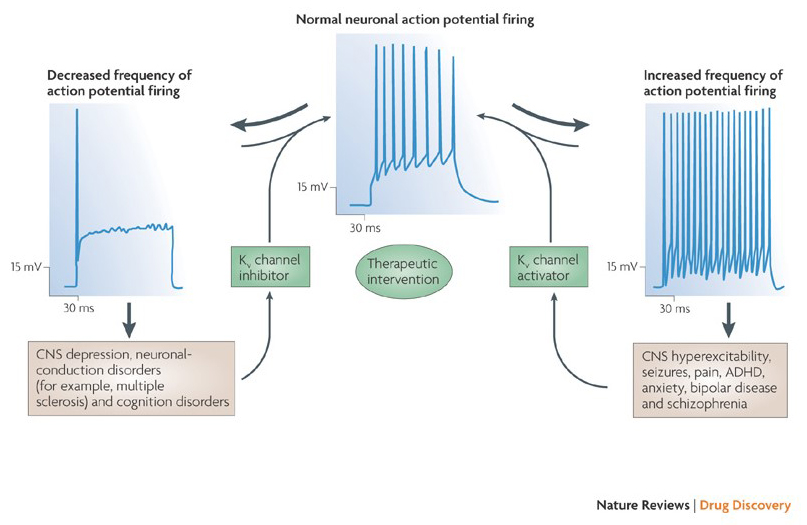
Figura 5. Aplicații potențiale ale modulatoarelor de canale KV. Deoarece modelele anormale de ardere a potențialului de acțiune au fost asociate cu boli precum epilepsia și scleroza multiplă, activatorii și inhibitorii canalului KV au fost luați în considerare pentru tratamentele terapeutice potențiale ale bolilor care implică modificarea excitabilității neuronale .
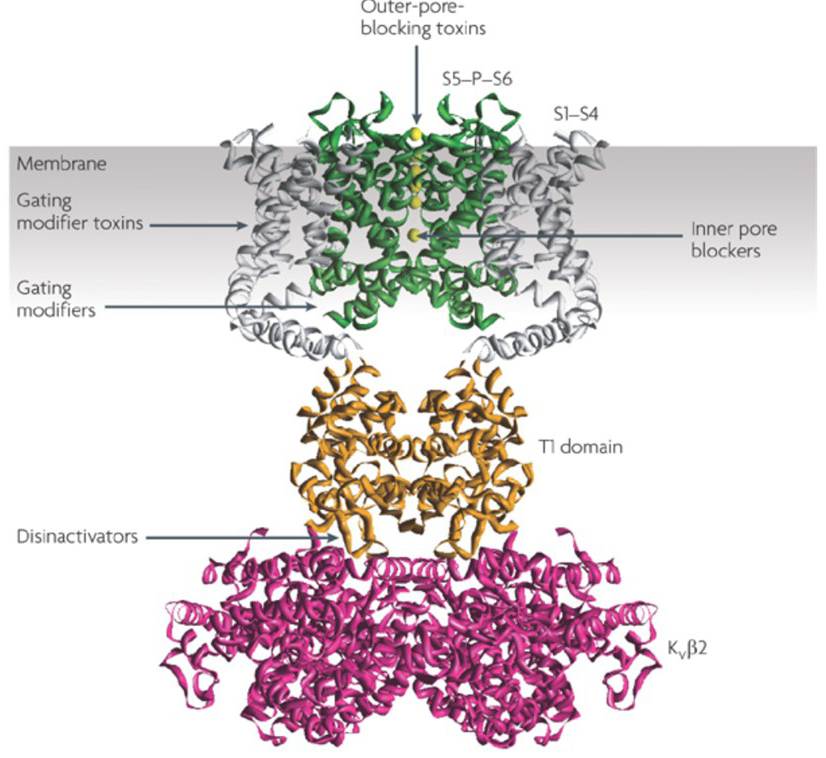
Figura 6. Exemple de moduri de acțiune ale modulatoarelor canalului KV. Există mai multe moduri diferite pentru toxinele peptidice și moleculele mici de a modula activitatea canalului KV. Structura KV1 .2 este prezentată cu domeniile porilor (S5-P-S6) în verde, domeniile senzorilor de tensiune (S1-S4) în gri, domeniile de tetramerizare T1 în portocaliu și subunitățile auxiliare Kvinc2 în magenta. Toxinele care blochează porii exteriori din scorpioni, anemone marine, șerpi și melci conici se pot lega de vestibulul exterior și pot bloca pătrunderea ionilor. Toxinele modificatoare de închidere de la păianjeni, cum ar fi hanatoxina, pot interacționa cu senzorul de tensiune pentru a crește stabilitatea stării închise, provocând deplasarea spre dreapta a curbei de dependență de tensiune pentru activarea canalului. Există, de asemenea, molecule mici canal modulatori care se leagă la interior porilor (interior porilor blocante), pe de suprimare a fasciculului balamale (gating modificatori), sau interfața între α – și β-subunități (disinactivators) .
structura canalului de potasiu cu tensiune
selectivitatea remarcabilă a canalelor de potasiu, care permite ionilor K+ să treacă prin porii canalului cu ordine de mărime mai ușoare decât ionii Na+ mai mici și cu o rată aproape limitată de difuzie , este explicată de capacitatea carbonililor coloanei vertebrale a filtrului de selectivitate de a coordona ionii K+ care sunt în mare parte dezbrăcați de cojile lor de hidratare , astfel încât mai mult de un ion K+ se va deplasa prin acest segment cel mai îngust al porilor în tandem (fig. 7) – Un por lung pentru un singur fișier k+ permeație Ionică așa cum este predicat .
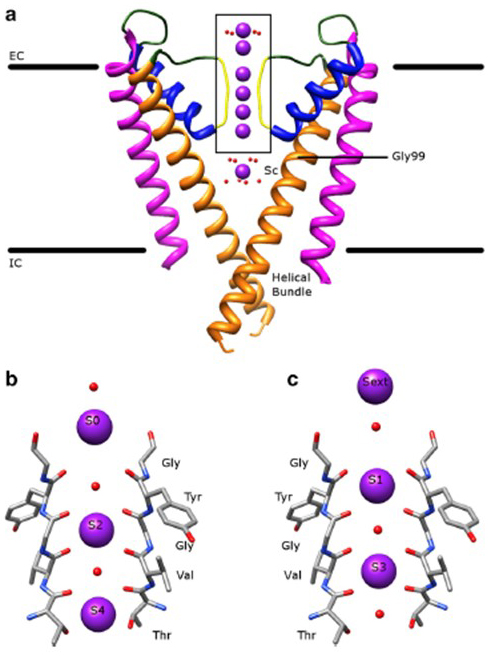
Figura 7. Domeniul porilor canalelor de potasiu. (a) structura KcsA în stare conductivă (PDB: 1K4C) , cu helicele exterioare în magenta, helicele interioare în portocaliu, helicele porilor în albastru și filtrul de selectivitate în galben. Ionii K + sunt în violet, în timp ce moleculele de apă din jur sunt în roșu. Ce: extracelular; IC: intracelular. (b, c) filtrul de selectivitate din regiunea cutie a structurii KcsA este prezentat cu ioni K+ ocupând fie pozițiile S2 și S4 (b), fie pozițiile s1 și S3 (c), pentru a ilustra permeația ionilor K+ într-un singur fișier .
dependența de tensiune a activării canalului KV derivă din domeniile lor de senzori de tensiune . Așa cum se arată în Fig. 8, canalele KV și canalele conexe, cum ar fi canalele de sodiu cu tensiune și canalele TRPV1 din aceeași superfamilie, au aranjamente similare ale domeniilor porilor și domeniilor senzorilor de tensiune. Domeniul senzorului de tensiune al unei subunități interacționează cu domeniul porilor unei subunități vecine într-o configurație de swap de domeniu, iar în cadrul unui senzor de tensiune reziduurile de arginină încărcate pozitiv pe S4 pot interacționa cu reziduurile acide încărcate negativ în helicele vecine (Fig. 9).
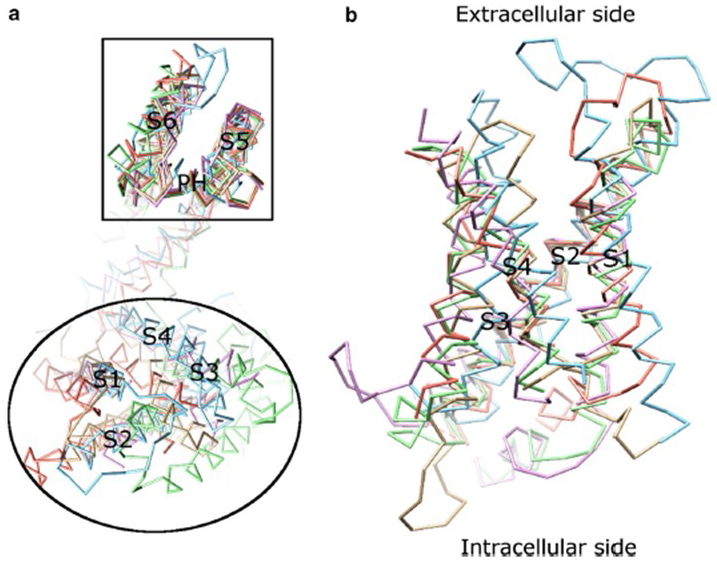
figura 8. Domeniul senzorului de tensiune al canalelor de potasiu cu tensiune. (a) alinierea domeniului porilor (S5-P-S6) a diferitelor canale ionice relevă faptul că domeniile lor de senzori de tensiune (S1-S4) pot lua o varietate de orientări (privite din partea extracelulară). (b) suprapunerea domeniului senzorului de tensiune KV1.2 (PDB: 3lut, magenta deschisă) cu domeniile senzorului de tensiune MlotiK1 (PDB: 3beh, maro deschis) , NaVAb (PDB: 3rvy, verde deschis) , NaVRh (PDB: 4dxw, portocaliu deschis) și TRPV1 (PDB: 3j5p, Albastru deschis) (privit din membrană) .
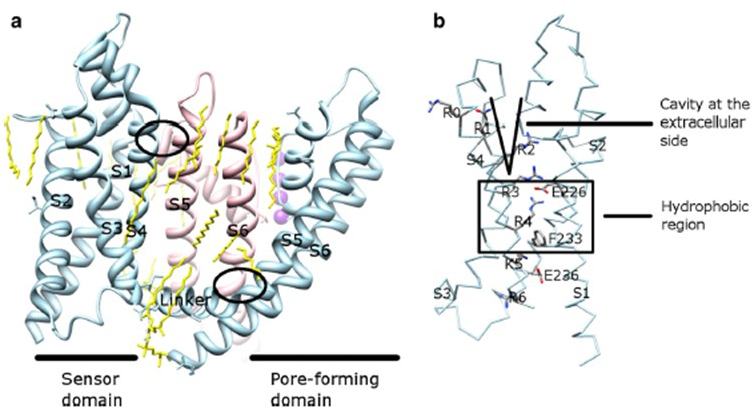
Figura 9. Contacte între domeniul porilor și domeniul senzorului de tensiune al canalelor KV. (a) chimera KV1.2-KV2.1 (PDB: 2r9r) cu domeniul senzorului de tensiune al unei subunități (Albastru deschis) care intră în contact cu domeniul porilor unei subunități vecine (roz). Contactele de pe partea intracelulară implică interacțiunea linkerului S4-S5 cu S6, iar contactele de pe partea extracelulară implică interacțiunea dintre S1 și spirala porilor . Lipidele (galbene) care înconjoară canalul și între domeniul porilor și domeniul senzorului de tensiune sunt detectabile în structura cristalină. (b) reziduuri bazice de S4 și reziduuri acide aflate în proximitatea lor în domeniul senzorilor de tensiune .
Channelopatiile legate de canalele de potasiu cu tensiune
canalele de potasiu cu tensiune sunt exprimate în linii mari într-o varietate de țesuturi. În neuroni, acestea sunt direcționate către diferite compartimente subcelulare (Fig. 10), iar canalele diferitelor compoziții de subunități pot fi prezente în diferite subpopulații ale neuronilor . Mutațiile genelor canalului KV pot provoca boli neurologice, cum ar fi ataxia episodică și epilepsiile, bolile de inimă și surditatea . Conservarea evolutivă a funcției canalului KV este evidentă, de exemplu, din tulburările de mișcare similare cauzate de mutația ORTOLOGILOR KV1 la om, șoarece și muscă de fructe .
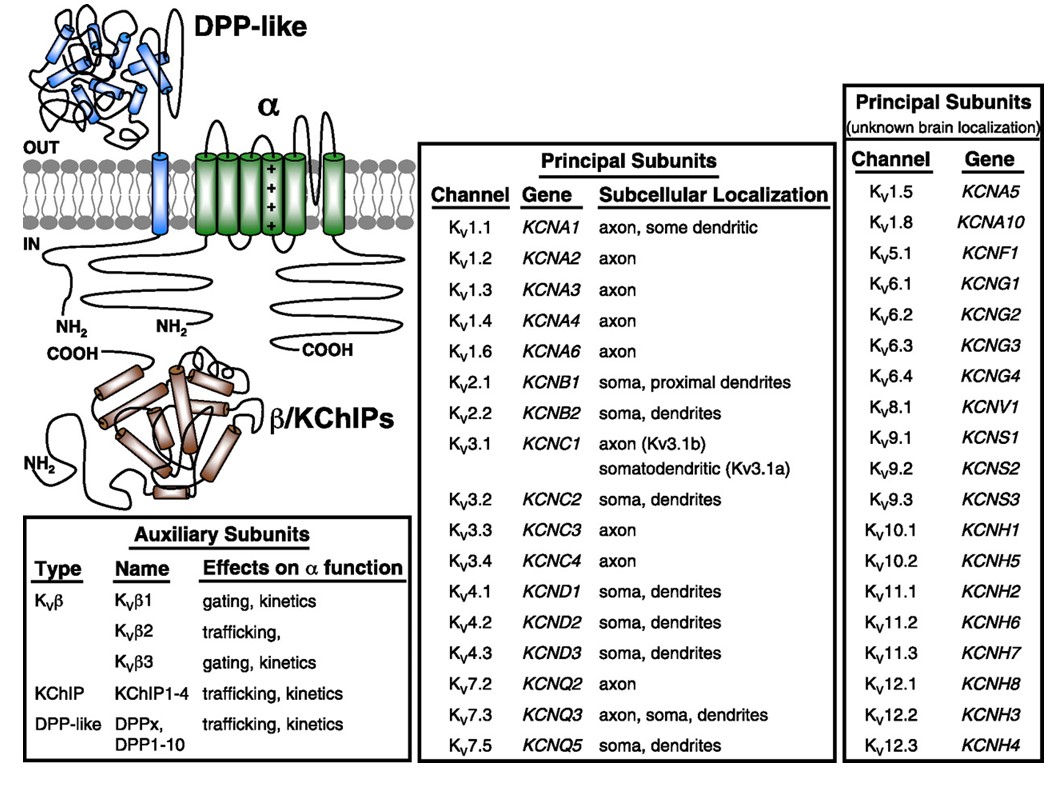
Figura 10. Distribuția subcelulară a canalelor de potasiu cu tensiune. Schema din stânga sus prezintă un canal KV4 cu două subunități auxiliare diferite. Localizarea subcelulară a diferitelor canale KV în neuronii centrali ai mamiferelor este indicată în cutia de mijloc .
referințe și note
1.Hille, B., canale ionice ale membranelor excitabile, 3, Ed. 2001: Sinauer Associates Inc.
2.Gonzalez, C. și colab., K ( + ) canale: funcție-prezentare structurală. Compr Physiol, 2012. 2(3): p. 2087-149.
3.Vacher, H., D. P. Mohapatra și J. S. Trimmer, localizarea și direcționarea canalelor ionice dependente de tensiune în neuronii centrali ai mamiferelor. Physiol Rev, 2008. 88 (4): p. 1407-47.
4.Jegla, T. J. și colab., Evoluția setului de canale ionice umane. Pieptene Chem High Throughput Ecran, 2009. 12(1): p. 2-23.
5.Cang, C. și colab., TMEM175 este un canal Organelle K (+) care reglează funcția lizozomală. Celulă, 2015. 162 (5): p. 1101-12.
6.Hodgkin, A. L. și A. F. Huxley, curenți transportați de ioni de sodiu și potasiu prin membrana axonului gigant al Loligo. J Physiol, 1952. 116 (4): p. 449-72.
7.Rosenthal, J. J., T. I. Liu și W. F. Gilly, o familie de redresoare întârziate KV1 cDNAs care prezintă o expresie specifică tipului de celulă în complexul ganglion stelat de calmar / lob de fibre uriașe. J Neurosci, 1997. 17 (13): p. 5070-9.
8.Young, J. Z., a fuzionat neuroni și contacte sinaptice în fibrele nervoase gigantice ale cefalopodelor. Phil Trans R Soc Lond B, 1939. 229: p. 465-503.
9.Rosenthal, J. J. și F. Bezanilla, editarea extinsă a ARNm-urilor pentru calmarul întârziat redresor k+ canal reglează subunitatea tetramerizare. Neuron, 2002. 34 (5): p. 743-57.
10.Jan, L. Y. și Y. N. Jan, canalele de potasiu cu tensiune și diversitatea semnalizării electrice. J Physiol, 2012. 590 (11): p. 2591-9.
11.Johnston, J., I. D. Forsythe și C. Kopp-Scheinpflug, mergând nativ: canale de potasiu cu tensiune care controlează excitabilitatea neuronală. J Physiol, 2010. 588 (Pt 17): p. 3187-200.
12.Bocksteins, E., KV5, KV6, KV8 și KV9 subunități: fără spectatori simpli tăcuți. J Gen Physiol, 2016. 147(2): p. 105-25.
13.Wulff, H., N. A. Castle și L. A. Pardo, canale de potasiu cu tensiune ca ținte terapeutice. Nat Rev Drug Discov, 2009. 8 (12): p. 982-1001.
14.Bates, E., Canale ionice în dezvoltare și cancer. Anu Rev Cell Dev Biol, 2015. 31: p. 231-47.
15.Huang, X. și L. Y. Jan, țintind canalele de potasiu în cancer. J Cell Biol, 2014. 206 (2): p. 151-62.
16.Huang, X. și colab., Canalul de potasiu EAG2 cu funcție conservată evolutiv ca țintă a tumorii cerebrale. Nat Neurosci, 2015. 18 (9): p. 1236-46.
17.Kunzelmann, K., canale ionice și cancer. J Membru Biol, 2005. 205(3): p. 159-73.
18.Li, M. și Z. G. Xiong, canalele ionice ca ținte pentru terapia cancerului. Int J Physiol Pathophysiol Pharmacol, 2011. 3(2): p. 156-66.
19.Pardo, L. A., Canale de potasiu cu tensiune în proliferarea celulelor. Fiziologie( Bethesda), 2004. 19: p. 285-92.
20.Urrego, D. și colab., Canalele de potasiu în ciclul celular și proliferarea celulelor. Philos Trans R Soc Lond B Biol Sci, 2014. 369 (1638): p. 20130094.
21.Zhou, Y. și colab., Chimia coordonării și hidratării ionilor dezvăluită de un complex k + canal-Fab la rezoluția 2.0 A. Natură, 2001. 414 (6859): p. 43-8.
22.MacKinnon, R., canale de potasiu. Februarie Lett, 2003. 555 (1): p. 62-5.
23.Kuang, Q., P. Purhonen și H. Hebert, structura canalelor de potasiu. Cell Mol Life Sci, 2015. 72 (19): p. 3677-93.
24.Isacoff, E. Y., L. Y. Jan și D. L. Minor, Jr., conducte ale scânteii vieții: o perspectivă asupra cercetării canalelor ionice de la nașterea neuronului. Neuron, 2013. 80 (3): p. 658-74.
25.Swartz, K. J., detectez tensiunea pe membranele lipidice. Natură, 2008. 456 (7224): p. 891-7.
26.Nusser, Z., distribuția subcelulară diferențială a canalelor ionice și diversitatea funcției neuronale. Curr Opin Neurobiol, 2012. 22 (3): p. 366-71.
27.Lujan, R., organizarea canalelor de potasiu pe suprafața neuronală. J Chem Neuroanat, 2010. 40(1): p. 1-20.
28.Abriel, H. și E. V. Zaklyazminskaya, canale Cardiaceopatii: mecanisme genetice și moleculare. Gene, 2013. 517(1): p. 1-11.
29.Kullmann, D. M. și M. G. Hanna, tulburări neurologice cauzate de mutații moștenite ale canalelor ionice. Lancet Neurol, 2002. 1(3): p. 157-66.
30.Lehmann-Horn, F. și K. Jurkat-Rott, canale ionice cu tensiune și boli ereditare. Physiol Rev, 1999. 79 (4): p. 1317-72.
31.Villa, C. și R. Combi, canale de potasiu și fenotipuri epileptice umane: o imagine de ansamblu actualizată. Neuroști Cu Celule FRONTALE, 2016. 10: p. 81.
32.Long, S. B., E. B. Campbell și R. Mackinnon, structura cristalină a unei familii de agitatori dependenți de tensiune a mamiferelor k+ canal. Știință, 2005. 309 (5736): p. 897-903.
33.Chen, X. și colab., Structura canalului de potasiu al agitatorului de lungime completă KV1.2 prin rafinarea cristalografică cu raze X pe bază de mod normal. Proc Natl Acad Sci U S A, 2010. 107 (25): p. 11352-7.
34.Clayton, G. M. și colab., Structura regiunilor transmembranare ale unui canal ciclic bacterian reglat de nucleotide. Proc Natl Acad Sci U S A, 2008. 105 (5): p. 1511-5.
35.Payandeh, J. și colab., Structura cristalină a unui canal de sodiu cu tensiune. Natură, 2011. 475 (7356): p. 353-8.
36.Zhang, X. și colab., Structura cristalină a unui ortolog al canalului de sodiu cu tensiune nachbac. Natură, 2012. 486 (7401): p. 130-4.
37.Liao, M. și colab., Structura canalului ionic TRPV1 determinată prin crio-microscopie electronică. Natură, 2013. 504 (7478): p. 107-12.
38.Long, S. B. și colab., Structura atomică a unui canal k+ dependent de tensiune într-un mediu asemănător membranei lipidice. Natură, 2007. 450 (7168): p. 376-82.