obiective de învățare
până la sfârșitul acestei secțiuni, veți putea:
- scrieți simboluri Lewis pentru atomi și ioni neutri
- desenați structuri Lewis care descriu legătura în molecule simple
am discutat diferitele tipuri de legături care se formează între atomi și/sau ioni. În toate cazurile, aceste legături implică partajarea sau transferul electronilor învelișului de valență între atomi. În această secțiune, vom explora metoda tipică pentru reprezentarea electronilor învelișului de valență și a legăturilor chimice, și anume simbolurile Lewis și structurile Lewis.
simboluri Lewis
folosim simboluri Lewis pentru a descrie configurațiile electronilor de valență ale atomilor și ionilor monatomici. Un simbol Lewis constă dintr – un simbol elementar înconjurat de un punct pentru fiecare dintre electronii săi de valență:
Figura 1 prezintă simbolurile Lewis pentru elementele celei de-a treia perioade a tabelului periodic.

Figura 1. Simboluri Lewis care ilustrează numărul de electroni de valență pentru fiecare element din a treia perioadă a tabelului periodic.
simbolurile Lewis pot fi folosite și pentru a ilustra formarea cationilor din atomi, așa cum se arată aici pentru sodiu și calciu:

de asemenea, ele pot fi folosite pentru a arăta formarea anionilor din atomi, așa cum se arată mai jos pentru clor și sulf:

Figura 2 demonstrează utilizarea simbolurilor Lewis pentru a arăta transferul de electroni în timpul formării compușilor ionici.

Figura 2. Cationii se formează atunci când atomii pierd electroni, reprezentați de mai puține puncte Lewis, în timp ce anionii sunt formați de atomi care câștigă electroni. Numărul total de electroni nu se schimbă.
structuri Lewis
de asemenea, folosim simboluri Lewis pentru a indica formarea legăturilor covalente, care sunt prezentate în structurile Lewis, desene care descriu legătura dintre molecule și ionii poliatomici. De exemplu, atunci când doi atomi de clor formează o moleculă de clor, aceștia împărtășesc o pereche de electroni:

structura Lewis indică faptul că fiecare atom Cl are trei perechi de electroni care nu sunt utilizați în legătură (numite perechi singuratice) și o pereche comună de electroni (scrisă între atomi). O liniuță (sau linie) este uneori utilizată pentru a indica o pereche partajată de electroni:

o singură pereche comună de electroni se numește o singură legătură. Fiecare atom Cl interacționează cu opt electroni de valență: cei șase în perechile singure și cei doi în legătura unică.
regula octetului
celelalte molecule de halogen (F2, Br2, I2 și At2) formează legături ca cele din molecula de clor: o singură legătură între atomi și trei perechi singulare de electroni pe atom. Acest lucru permite fiecărui atom de halogen să aibă o configurație electronică cu gaz nobil. Tendința atomilor din grupul principal de a forma suficiente legături pentru a obține opt electroni de valență este cunoscută sub numele de regula octetului.
numărul de legături pe care un atom le poate forma poate fi adesea prezis din numărul de electroni necesari pentru a ajunge la un octet (opt electroni de valență); acest lucru este valabil mai ales pentru nemetalele din a doua perioadă a tabelului periodic (C, N, o și F). De exemplu, fiecare atom al unui element din grupul 14 are patru electroni în învelișul său exterior și, prin urmare, necesită încă patru electroni pentru a ajunge la un octet. Acești patru electroni pot fi câștigați prin formarea a patru legături covalente, așa cum este ilustrat aici pentru carbon în CCl4 (tetraclorură de carbon) și siliciu în SiH4 (silan). Deoarece hidrogenul are nevoie doar de doi electroni pentru a-și umple învelișul de valență, este o excepție de la regula octetului. Elementele de tranziție și elementele de tranziție interioare nu respectă, de asemenea, regula octetului:

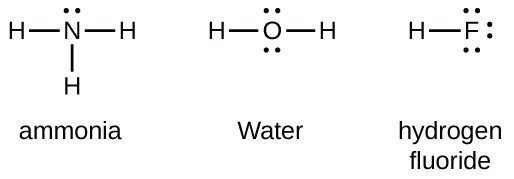
elementele grupului 15, cum ar fi azotul, au cinci electroni de valență în simbolul Atomic Lewis: o pereche singură și trei electroni nepereche. Pentru a obține un octet, acești atomi formează trei legături covalente, ca în NH3 (amoniac). Oxigenul și alți atomi din grupa 16 obțin un octet formând două legături covalente:
legături duble și Triple
după cum am menționat anterior, atunci când o pereche de atomi împarte o pereche de electroni, numim aceasta o singură legătură. Cu toate acestea, o pereche de atomi ar putea avea nevoie să împartă mai mult de o pereche de electroni pentru a obține octetul necesar. O legătură dublă se formează atunci când două perechi de electroni sunt împărțite între o pereche de atomi, ca între atomii de carbon și oxigen din CH2O (formaldehidă) și între cei doi atomi de carbon din C2H4 (etilenă):
se formează o legătură triplă atunci când trei perechi de electroni sunt împărțite de o pereche de atomi, ca în gazul de azot (N2):
scrierea structurilor Lewis cu regula octetului
pentru molecule foarte simple și ioni moleculari, putem scrie structurile Lewis prin simpla asociere a electronilor nepereche pe atomii constituenți. Vedeți aceste exemple:

pentru molecule mai complicate și ioni moleculari, este util să urmați procedura pas cu pas prezentată aici:
- determinați numărul total de electroni de valență (înveliș exterior).
- desenați o structură de schelet a moleculei, aranjând atomii în jurul unui atom central. (În general, elementul cel mai puțin electronegativ ar trebui plasat în centru.) Conectați fiecare atom la atomul central cu o singură legătură (o pereche de electroni).
- distribuie electronii rămași ca perechi singulare pe atomii terminali (cu excepția hidrogenului), completând un octet în jurul fiecărui atom.
- plasați toți electronii rămași pe atomul central.
- rearanjați electronii atomilor exteriori pentru a face mai multe legături cu atomul central pentru a obține octeți ori de câte ori este posibil.
să determinăm structura Lewis a PBr3 folosind pașii de mai sus:
- Pasul 1: determinați numărul total de electroni de valență (înveliș exterior).
\mare \ începe{array}{l} \ \ \ fantomă {\regulă{0.8 em}{0ex}} {\text{PBr}} _ {3} \ \ \ fantomă {\regulă{0.8 em}{0EX}} \ text{P: 5 electroni de valență/atom}\ori \text{1 atom}=5\\ \subliniere{+\text{Br: 7 electron de valență/atom}\ori \text{3 atomi}=21}\\ \\ \fantomă{\regulă{15.95em}{0EX}} = \ text{26 electroni de valență} \ end{array}
- Pasul 2: Desenați o structură de schelet a moleculei, aranjând atomii în jurul unui atom central. (În general, elementul cel mai puțin electronegativ ar trebui plasat în centru.) Conectați fiecare atom la atomul central cu o singură legătură (o pereche de electroni).

- Pasul 3: Distribuiți electronii rămași ca perechi singulare pe atomii terminali (cu excepția hidrogenului), completând un octet în jurul fiecărui atom.
-
 Pasul 4: Plasați toți electronii rămași pe atomul central.
Pasul 4: Plasați toți electronii rămași pe atomul central.

notă: Pasul 5: nu este necesar, deoarece toți atomii au un octet.
să determinăm structura Lewis a CH2O.
- Pasul 1: Determinați numărul total de electroni de valență (înveliș exterior).
\mare \începe{array}{l}\\ \fantomă{\regulă{0.8 em}{0EX}}{\text{H}_{2}}\text{CO}\\ \fantomă{\regulă{0.8 em}{0EX}}\text{H: 1 electron de valență/atom}\ori \text{2 atom}=2\\\text{C: 4 electroni de valență/atom}\ori \text{1 atom}=4\\ \subliniere{+\text{o: 6 electroni de valență/atom}\timpi \text{1 atomi}=6}\\ \\ \fantomă{\regulă{15.95 em}{0EX}}=\text{12 electroni de valență}\sfârșit{matrice}
- Pasul 2: Desenați o structură de schelet a moleculei, aranjând atomii în jurul unui atom central. (În general, elementul cel mai puțin electronegativ ar trebui plasat în centru.) Conectați fiecare atom la atomul central cu o singură legătură (o pereche de electroni).

- Pasul 3: Distribuiți electronii rămași ca perechi singulare pe atomii terminali (cu excepția hidrogenului), completând un octet în jurul fiecărui atom.

- Pasul 4: nu este necesar, deoarece toți electronii au fost plasați. Cu toate acestea, carbonul nu are un octet,
- Pasul 5: Rearanjați electronii atomilor exteriori pentru a face mai multe legături cu atomul central pentru a obține octeți ori de câte ori este posibil.

Exemplul 1: Scrierea structurilor Lewis
Misiunea Cassini-Huygens a NASA a detectat un nor mare de cianură de hidrogen toxică (HCN) pe Titan, una dintre lunile lui Saturn. Care sunt structurile Lewis ale acestor molecule?
verificați învățarea
dioxidul de Carbon, CO2, este un produs al arderii combustibililor fosili. CO2 a fost implicat în schimbările climatice globale. Care este structura Lewis a CO2?
conceptele cheie și rezumatul
structurile electronice de valență pot fi vizualizate prin desenarea simbolurilor Lewis (pentru atomi și ioni monatomici) și a structurilor Lewis (pentru molecule și ioni poliatomici). Perechi singuratice, electroni nepereche și legături simple, duble sau triple sunt utilizate pentru a indica unde electronii de valență sunt localizați în jurul fiecărui atom într-o structură Lewis. Majoritatea structurilor—în special cele care conțin elemente din al doilea rând-respectă regula octetului, în care fiecare atom (cu excepția lui H) este înconjurat de opt electroni. Excepții de la regula octetului apar pentru moleculele de electroni impari (radicali liberi), molecule cu deficit de electroni și molecule hipervalente.
exerciții
- scrieți simbolurile Lewis pentru fiecare dintre următorii ioni:
- As3 –
- I–
- Be2 +
- O2–
- Ga3 +
- Li +
- N3–
- mulți ioni monatomici se găsesc în apa de mare, inclusiv ionii formați din următoarea listă de elemente. Scrieți simbolurile Lewis pentru ionii monatomici formați din următoarele elemente:
- Cl
- Na
- Mg
- Ca
- K
- Br
- Sr
- F
- scrieți simbolurile Lewis ale ionilor în fiecare dintre următorii compuși ionici și simbolurile Lewis ale atomului din care sunt formați:
- MgS
- Al2O3
- GaCl3
- K2O
- Li3N
- KF
- în structurile Lewis enumerate mai jos, M și X reprezintă diverse elemente în a treia perioadă a tabelului periodic. Scrieți formula fiecărui compus folosind simbolurile chimice ale fiecărui element:
- scrieți structura Lewis pentru molecula diatomică P2, o formă instabilă de fosfor Găsită în vaporii de fosfor la temperaturi ridicate.
- scrieți structuri Lewis pentru următoarele:
- H2
- HBr
- PCl3
- scrieți structuri Lewis pentru următoarele:
- O2
- H2CO
- AsF3
- SiCl4
Glosar
legătură dublă: legătură covalentă în care două perechi de electroni sunt împărțite între doi atomi
radical liber: moleculă care conține un număr impar de electroni
moleculă hipervalentă: moleculă care conține cel puțin un element de grup principal care are mai mult de opt electroni în învelișul său de valență
structura Lewis: diagramă care prezintă perechi singulare și perechi de electroni care leagă 9316>
simbolul Lewis: simbol pentru un element sau ion monatomic care folosește un punct pentru a reprezenta fiecare electron de valență din element sau ion
pereche singuratică: doi (o pereche de) electroni de valență care nu sunt folosiți pentru a forma o legătură covalentă
regula octetului: ghid care afirmă că atomii grupului principal vor forma structuri în care opt electroni de valență interacționează cu fiecare nucleu, numărând electronii de legătură ca interacționând cu ambii atomi conectați prin legătura
legătură unică: legătură în o singură pereche de electroni este împărțită între doi atomi
legătură triplă: legătură în care trei perechi de electroni sunt împărțite între doi atomi


 HCN: nu rămân electroni
HCN: nu rămân electroni




















