ciclul glucoză-alanină sau ciclul Cahill, propus pentru prima dată de Mallette, Exton și Park și Felig și colab. între 1969 și 1970, constă dintr-o serie de pași prin care țesuturile extrahepatice, de exemplu mușchiul scheletic, exportă piruvatul și grupările amino ca alanină în ficat și primesc glucoză din ficat prin fluxul sanguin.
principalele etape ale ciclului glucoză-alanină sunt rezumate mai jos.
- când în țesuturile extrahepatice se utilizează aminoacizi pentru energie, piruvatul, derivat din glicoliză, este utilizat ca acceptor de grup amino, formând alanină, un aminoacid neesențial.
- alanina difuzează în sânge și ajunge la ficat.
- în ficat, gruparea amino a alaninei este transferată în-cetoglutarat de-alqux pentru a forma piruvat și, respectiv, glutamat.
- grupul amino al glutamatului intră în cea mai mare parte în ciclul ureei și, în parte, acționează ca donator de azot în multe căi biosintetice.
piruvatul intră în gluconeogeneză și este utilizat pentru sinteza glucozei. - glucoza nou formată se difuzează în sânge și ajunge la țesuturile periferice unde, datorită glicolizei, este transformată în piruvat care poate accepta grupări amino din aminoacizii liberi, închizând astfel ciclul.
prin urmare, ciclul glucoză-alanină oferă o legătură între metabolismul carbohidraților și aminoacizilor, așa cum este descris schematic mai jos.
Glucoză → Piruvat → Alanina → Piruvat → Glucoză
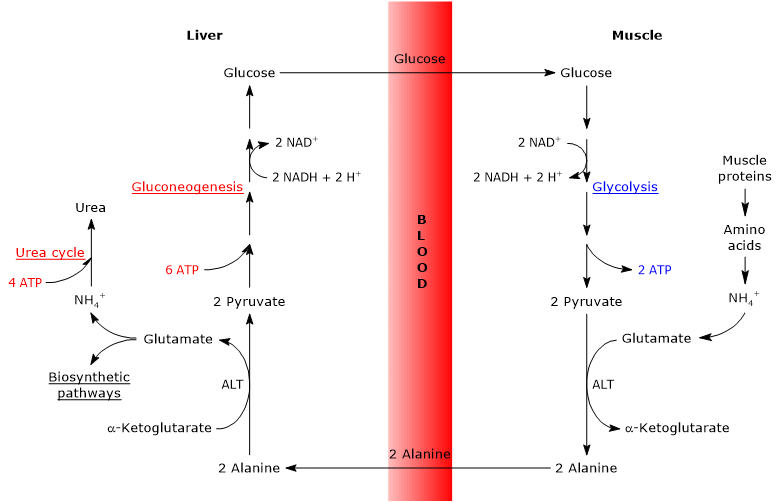
glucoza-alanina ciclu are loc nu numai între mușchii scheletici, primul țesut, în care s-a observat, și ficat, dar implică alte celulele și țesuturile extrahepatice inclusiv celule ale sistemului imunitar, cum ar fi nivelul organelor limfoide.
cuprins
- etapele ciclului glucoză-alanină
- ciclul Cahill în mușchii scheletici
- ciclul Cahill în ficat
- transaminaze
- funcțiile ciclului glucoză-alanină
- costul energetic al ciclului glucoză-alanină
- asemănări și diferențe între ciclul Cahill și ciclul Cori
etapele ciclului glucoză-alanină
analiza etapelor ciclului glucoză-alanină se face ținând cont de ciclul dintre mușchiul scheletic și ficat.
atât proteinele intracelulare, cât și cele extracelulare sunt hidrolizate continuu la aminoacizii constituenți și resintetizate, iar rata la care apar aceste procese este echilibrată precis, prevenind astfel pierderea masei fără grăsimi.
cu toate acestea, în condiții catabolice, cum ar fi exercițiile intense și prelungite sau postul, rata de descompunere a proteinelor musculare depășește sinteza. Aceasta duce la eliberarea aminoacizilor, dintre care unii sunt folosiți pentru energie și alții pentru gluconeogeneză. Și oxidarea scheletelor de carbon ale aminoacizilor, în special aminoacizii cu lanț ramificat sau BCAA (leucină, izoleucină și valină), poate fi o sursă semnificativă de energie pentru mușchi. De exemplu, după aproximativ 90 de minute de efort fizic intens, oxidarea aminoacizilor în mușchi asigură 10-15% din energia necesară contracției.
utilizarea scheletelor de carbon ale aminoacizilor pentru energie implică îndepărtarea grupării amino și apoi excreția azotului amino într-o formă netoxică.
eliminarea grupării-amino-amino are loc prin transaminare, care poate fi rezumată după cum urmează:
acid-ceto-ceto-ceto-ceto-acid + aminoacid nou aminoacid + nou aminoacid-ceto-acid
astfel de reacții, catalizate de enzime numite aminotransferaze sau transaminaze (EC 2.6.1) sunt liber reversibile.
aminoacizii cu catenă ramificată, de exemplu, transferă gruparea amino în acid-cetoglutarat sau 2-oxoglutaric, pentru a forma glutamat și acidul-ceto derivat din aminoacidul original, într-o reacție catalizată de aminotransferază cu catenă ramificată sau bcat (EC 2.6 .1.42).
ciclul Cahill în mușchii scheletici
în mușchii scheletici, glutamatul nou format poate reacționa cu amoniacul pentru a forma glutamină, pentru multe țesuturi și organe, cum ar fi creierul, principalul vehicul pentru transportul interorganic al azotului. Reacția este catalizată de enzima citosolică glutamină sintetază (EC 6.3.1.2) și consumă un ATP.
glutamat + NH4+ + ATP glutamină + ADP + Pi
în acest caz, glutamatul părăsește ciclul Cahill.
alternativ, și spre deosebire de ceea ce se întâmplă în majoritatea celorlalte țesuturi, glutamatul nou format poate transfera gruparea amino în piruvat, derivat din glicoliză, pentru a forma alanină și cetoglutarat de-alqux. Această transaminare este catalizată de alanin aminotransferază sau ALT (EC 2.6.1.2), o enzimă găsită în majoritatea țesuturilor animale și vegetale.
glutamat + Piruvat alanină + alanină + cetoglutarat
alanina produsă și derivată direct din descompunerea proteinelor, iar proteinele musculare sunt bogate în alanină, pot părăsi celula și pot fi transportate de fluxul sanguin către ficat; în acest fel, gruparea amino ajunge la ficat. Iar rata la care alanina formată prin transaminarea piruvatului este transferată în circulație este proporțională cu producția de piruvat intracelular.
notă: alanina și glutamina sunt principalele surse de azot și carbon în metabolismul aminoacizilor interorgan.
ciclul Cahill din ficat
Odată ajuns în ficat, o alanin aminotransferază hepatică catalizează o transaminare în care alanina, principalul aminoacid gluconeogenic, acționează ca donator de grup amino și cetoglutaratul de la centimetric ca acceptor de acid la ceto-ceto. Produsele reacției sunt piruvatul, adică scheletul de carbon al alaninei și glutamatul.
alanină + Citrus-cetoglutarat glutamat + Piruvat
glutamat, în reacția catalizată de glutamat dehidrogenază (EC 1.4.1.2), o enzimă prezentă în matricea mitocondrială, formează ionul de amoniu, care intră în ciclul ureei, și cetoglutaratul de centi, care poate intra în ciclul Krebs. Această reacție este o reacție anaplerotică care leagă metabolismul aminoacizilor cu ciclul Krebs.
glutamat + H2O + nad+ ectoglutarat + NH4+ + NADH + H+
cu toate acestea, glutamatul poate reacționa, de asemenea, cu oxaloacetat pentru a forma aspartat și ectoglutarat, într-o reacție catalizată de aspartat aminotransferază (EC 2.6.1.1). Aspartatul este implicat în formarea ureei, precum și în sinteza purinelor și pirimidinelor.
glutamat + oxaloacetat aspartat + Ectoglutarat
de asemenea, piruvatul produs poate avea destine metabolice diferite: poate fi oxidat pentru producerea ATP și apoi poate părăsi ciclul glucoză-alanină sau poate intra pe calea gluconeogenezei și astfel poate continua în ciclu.
glucoza produsă este eliberată din ficat în sânge și este livrată în diferite țesuturi care o necesită, ca mușchi scheletic, în care este utilizată pentru sinteza piruvatului. La rândul său, piruvatul nou format poate reacționa cu glutamatul, închizând astfel ciclul.
transaminaze
după cum sa menționat anterior, îndepărtarea grupării amino din aminoacizi are loc prin transaminare (vezi mai sus pentru reacția generală). Aceste reacții sunt catalizate de enzime numite aminotransferaze sau transaminaze.
sunt enzime citosolice, prezente în toate celulele și deosebit de abundente în ficat, rinichi, intestin și mușchi; necesită fosfat de piridoxal sau PLP, forma activă a vitaminei B6 sau piridoxină, ca coenzimă, care este strâns legată de situsul activ.
în reacțiile de transaminare, gruparea amino a aminoacizilor liberi, cu excepția treoninei și lizinei, este canalizată către un număr mic de acizi-ceto-ceto-ceto, în special piruvat, oxaloacetat și cetoglutarat-cetoglutarat.
celulele conțin diferite tipuri de aminotransferaze: multe dintre ele sunt specifice pentru cetoglutaratul de octox ca acceptor de acid ceto-ceto, dar diferă ca specificitate pentru aminoacid, de la care sunt denumite. Exemple sunt alanin aminotransferaza menționată mai sus, numită și alanin transaminază și transferază piruvică glutamică sau GPT și aspartat aminotransferază sau AST, numită și transaminază glutamic-oxaloacetică sau GOT.
trebuie subliniat faptul că nu există nici o dezaminare netă în aceste reacții, nici o pierdere de grupări amino, deoarece acceptorul de acid-ceto-ceto este aminat și aminoacidul deaminat.
funcțiile ciclului glucoză-alanină
acest ciclu are diverse funcții.
- transportă azotul într-o formă netoxică de la țesuturile periferice la ficat.
- transportă piruvatul, un substrat gluconeogen, la ficat.
- elimină piruvatul din țesuturile periferice. Aceasta duce la o producție mai mare de ATP din glucoză în aceste țesuturi. De fapt, NADH produs în timpul glicolizei poate intra în mitocondrii și poate fi oxidat prin fosforilare oxidativă.
- permite menținerea unei concentrații relativ ridicate de alanină în hepatocite, suficientă pentru a inhiba degradarea proteinelor.
- poate juca un rol în apărarea gazdei împotriva bolilor infecțioase.
în cele din urmă, este important să subliniem că nu există o sinteză netă de glucoză în ciclul glucoză-alanină.
costul energetic al ciclului glucoză-alanină
ca și ciclul Cori, ciclul glucoză-alanină are un cost energetic egal cu 3-5 ATP.
partea ciclului care are loc în țesuturile periferice implică producerea de 5-7 ATP pe moleculă de glucoză:
- 2 ATP sunt produse prin glicoliză;
- 3-5 ATP derivă din NADH/FADH2 (vezi mai jos).
în schimb, în ficat, gluconeogeneza și ciclul ureei costă 10 ATP:
- 6 ATP sunt consumate în timpul gluconeogenezei pe moleculă de glucoză sintetizată;
- 4 ATP sunt consumate în ciclul ureei pe moleculă de uree sintetizată.
ciclul glucoză-alanină, ca și ciclul Cori, schimbă o parte din sarcina metabolică de la țesuturile extrahepatice la ficat. Cu toate acestea, costul energetic plătit de ficat este justificat de avantajele pe care ciclul le aduce întregului corp, deoarece permite, în anumite condiții, o defalcare eficientă a proteinelor în țesuturile extrahepatice (în special mușchiul scheletic), care la rândul său permite obținerea substraturilor gluconeogene, precum și utilizarea aminoacizilor pentru energie în țesuturile extrahepatice.
asemănări și diferențe între ciclul Cahill și ciclul Cori
există unele analogii între cele două cicluri, care sunt enumerate mai jos.
- ciclul Cahill se suprapune parțial ciclului Cori atunci când piruvatul este transformat în glucoză și monozaharida este transportată în țesuturi extrahepatice, în care este transformată din nou în piruvat prin calea glicolitică.
- intrarea în calea gluconeogenezei este similară pentru cele două cicluri: atât alanina, cât și lactatul sunt transformate în piruvat.
- la fel ca ciclul Cori, ciclul glucoză-alanină apare între diferite tipuri de celule, spre deosebire de căile metabolice, cum ar fi glicoliza, ciclul Krebs sau gluconeogeneza care apar în interiorul celulelor individuale
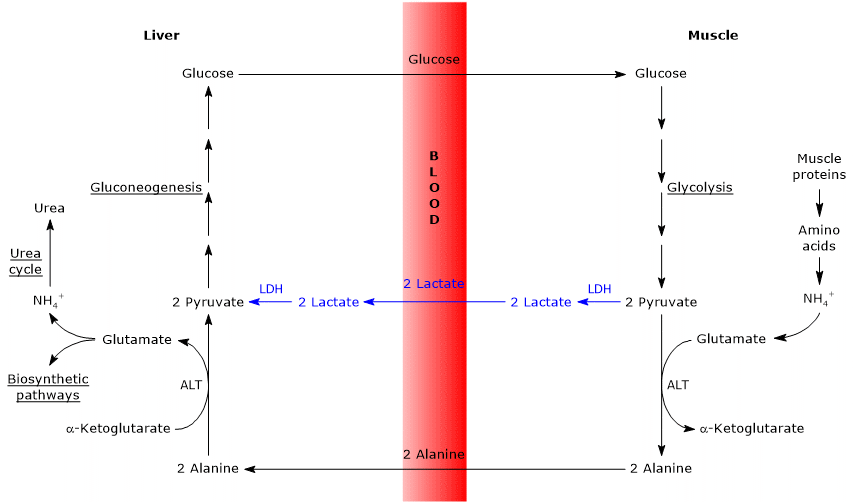
mai jos, unele diferențe între cele două cicluri.
- principala diferență se referă la cele trei intermediare de carbon care din țesuturile periferice ajung la ficat: lactat în ciclul Cori și alanină în ciclul glucoză-alanină.
- o altă diferență se referă la soarta NADH produsă de glicoliză în țesuturile periferice.
în ciclul Cori, coenzima acționează ca agent reducător pentru a reduce piruvatul la lactat, în reacția catalizată de lactat dehidrogenază (EC 1.1.1.27).
în ciclul glucoză-alanină, această reducere nu are loc și electronii NADH pot fi transportați în mitocondrii prin navetele malat-aspartat și glicerol 3-fosfat, generând NADH, prima navetă și FADH2, cealaltă navetă. Iar randamentul ATP de la NADH și FADH2 este de 2,5 și respectiv 1,5. - în cele din urmă, din punctul anterior, este clar că, spre deosebire de ciclul Cori, ciclul Cahill necesită prezența oxigenului și a mitocondriilor în țesuturile periferice.
Berg J. M., Tymoczko J. L. și Stryer L. Biochimie. Ediția a 5-a. W. H. Freeman și compania, 2002
Felig P., Pozefsk T., Marlis E., Cahill G. F. Alanina: rol cheie în gluconeogeneză. Știință 1970; 167 (3920):1003-4. doi: 10.1126 / știință.167.3920.1003
Gropper S. S., Smith J. L., Groff J. L. Nutriție avansată și metabolismul uman. Cengage Learning, 2009
Lecker S. H., Goldberg A. L. și Mitch W. E. degradarea proteinelor de către calea ubiquitin–proteazom în stări normale și de boală. J Am Soc Nephrol 2006; 17 (7):1807-19. doi: 10.1681/ASN.2006010083
Mallette L. E., Exton J. H. și Park C. R. controlul gluconeogenezei din aminoacizii din ficatul de șobolan perfuzat. J Biol Chem 1969; 244(20):5713-23.
Nelson D. L., Cox M. M. Lehninger. Principiile biochimiei. Ediția a 6-a. W. H. Freeman și compania, 2012
Raju S. M., Madala B. Biochimie medicală ilustrată. Jaypee Brothers Publishers, 2005
Wu G. aminoacizi: biochimie și nutriție. CRC Press, 2013