nu este evident. Electronii de valență sunt cei care sunt importanți în legătura chimică. Pentru metalele de tranziție, cuvântul” important ” va varia în funcție de context.
este mai ușor și mai practic să descriem care orbitali sunt orbitali de valență atunci când vine vorba de metale de tranziție (deși devine dificil cu lantanide și actinide).
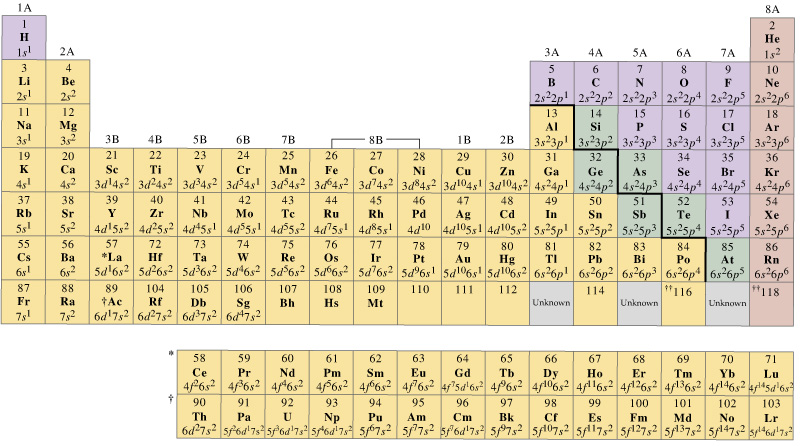
în general, metalele de tranziție din primul rând au un set de orbitali de valență care includ #4s# și #3d#, dar numărul de electroni de valență va varia.
de exemplu…

- Scandiul are sens să aibă până la trei electroni de valență, deoarece există o stare de oxidare #”Sc”^(+3)# (de exemplu, #”ScCl”_3#), dar nu #”Sc”^(+4)# sau mai mare. O stare de oxidare #+3 # ar fi necesitat transferul a trei electroni de valență dacă ar forma un cation pur.
- cromul ar putea avea până la șase electroni de valență, care ar include electronii #3D#, deoarece poate realiza o stare de oxidare# + 6 # (adică în # ” Cr ” _2 ” O „_7^(2 -)#, sau în # „CrO”_4^(2-)#).
- cuprul tinde să aibă o stare de oxidare #+1# (de exemplu, #”CuCl”#), deci are sens că folosește cel mai adesea electronul său #4S# ca electron(e) de valență. Dar o stare de oxidare # + 2# este, de asemenea, cunoscută (de exemplu, #”CuCl”_2#) și, prin urmare, este capabilă să ia de la #BB(3D)# electroni, precum și pentru electronul(electronii) de valență.
pe de altă parte, am putea spune cu ușurință că orbitalii de valență ai metalelor de tranziție din primul rând sunt #4S# și #3D# orbitali.
Deci, în general, aș spune că numărul de electroni de valență pentru metalele de tranziție (și lantanide și actinide) variază într-un mod imprevizibil, dar orbitalii de valență ar putea fi uneori preziși cu suficientă intuiție chimică.
DISCLAIMER: este, totuși, în general dificil pentru lantanide și actinide să prezică care orbitali sunt valență.
de exemplu, actinidele au #5F# și #6D# orbitali foarte apropiați în energie de #7s# orbital, așa că putem ghici și include #7s#, #6D# și #5f# în spațiul de valență (chiar dacă #6D# orbitalii sunt goi) atunci când efectuăm calcule de energie atomică.