dovezile din spatele intervențiilor naturale pentru boala ficatului gras nealcoolic: botanice, substanțe nutritive și probiotice pentru tratarea acestei afecțiuni comune
având în vedere creșterea bolii ficatului gras nealcoolic (NAFLD) atât la adulți, cât și la Pediatrie și lipsa unui tratament farmaceutic indicat,, strategiile naturale pentru tratamentul acestei afecțiuni sunt bine pregătite ca „următorul lucru cel mai bun”.”Mai multe suplimente nutritive și botanice au fost studiate clinic și arată promisiune pentru tratamentul NAFLD și omologul său inflamator, steatohepatita nealcoolică (NASH). Având în vedere cât de multe dintre aceste terapii abordează factorii care contribuie la dezvoltarea NAFLD, nu este nevoie de mult raționament pentru a înțelege modul în care acestea pot aborda în mod eficient unele dintre cauzele profunde ale bolii, mai degrabă decât abordarea unui simptom.
cinci intervenții suplimentare cu dovezi clinice sau epidemiologice pentru utilizarea lor în stabilirea NAFLD sunt fosfatidil colina, care furnizează fosfolipide și colină, vitamina E, atât ca alfa tocoferoli, cât și un amestec de delta și gamma tocotrienoli, extract de semințe de ciulin de lapte, berberină și probiotice.
- modificări ale ficatului gras: corelate cu un deficit de fosfatidil colină?
- vitamina E
- ciulinul de lapte
- berberina
- probiotice
- concluzie
- Dr. Carrie Decker, nd a absolvit cu onoruri Colegiul Național de Medicină Naturală (acum Universitatea Națională de Medicină Naturală) din Portland, Oregon. Dr. Decker vede pacienții de la distanță, cu accent pe bolile gastro-intestinale, dezechilibrele de dispoziție, tulburările de alimentație, bolile autoimune și oboseala cronică. Înainte de a deveni medic naturopat, Dr.Decker a fost inginer și a obținut diplome postuniversitare în inginerie biomedicală și mecanică de la Universitatea din Wisconsin-Madison și respectiv Universitatea din Illinois la Urbana-Champaign. Dr. Decker continuă să se bucure de cercetare academică și scris și folosește aceste abilități pentru a sprijini educația Medicină Integrativă ca scriitor și contribuitor la diverse resurse. Dr. Decker sprijină grupul de cercetare alergie ca membru al echipei lor de educație și de dezvoltare a produsului.
- surse:
- Spengler EK, Loomba R. recomandări pentru diagnostic, Trimitere pentru biopsie hepatică și tratamentul bolii hepatice grase nealcoolice și steatohepatitei nealcoolice. Procedurile Clinicii Mayo. 2015;90(9):1233–1246.
- Berardis s, Sokal E. boala hepatică grasă nealcoolică pediatrică: o problemă tot mai mare de sănătate publică. Eur J Pediatr. 2014 februarie; 173 (2): 131-9.
- Jadeja R, și colab. Medicamente pe bază de plante pentru tratamentul steatohepatitei nealcoolice: scenariul actual și perspectivele viitoare. Evid Pe Bază De Complement Alternat Med. 2014:648308.
- Pomorski T, și colab. Distribuția și transportul lipidelor pe membranele celulare. Semin Cell Dev Biol. 2001 Aprilie; 12(2): 139-48.
- Yamaji-Hasegawa A, și colab. Distribuția asimetrică a fosfolipidelor în biomembrane. Biol Pharm Bull. 2006 August; 29 (8): 1547-53.
- Hi Oktokmio Oktokullari AA, și colab. Secreția lipidelor biliare. Turk J Gastroenterol. 2007 iunie; 18 (2): 65-70.
- Fischer LM, și colab. Sexul și starea menopauzei influențează cerințele dietetice umane pentru Colina nutritivă. Sunt J Clin Nutr. 2007 mai; 85 (5):1275-85.
- Wallace TC, și colab. Aporturile obișnuite de colină sunt asociate cu consumul de ouă și proteine în Statele Unite. Nutrienți. 2017 August 5; 9 (8).
- Zeisel SH. Elementele de răspuns genetic, polimorfismele genetice și epigenetica influențează cerința alimentară umană pentru colină. Viața IUBMB. 2007 iunie;59 (6):380-7.
- Zeisel SH. Elementele de răspuns genetic, polimorfismele genetice și epigenetica influențează cerința alimentară umană pentru colină. Viața IUBMB. 2007 iunie;59 (6):380-7.
- Guerrerio AL, și colab. Aportul de colină într-o cohortă mare de pacienți cu boală hepatică grasă nealcoolică. Sunt J Clin Nutr. 2012 aprilie; 95 (4):892-900.
- Ma X, și colab. Polienilfosfatidilcolina atenuează fibroza hepatică nealcoolică și accelerează regresia acesteia. J Hepatol. 1996 Mai; 24 (5):604-13.
- lieber CS, și colab. Fosfatidilcolina protejează împotriva fibrozei și cirozei la babuin. Gastroenterologie. 1994 ianuarie;106 (1):152-9.
- Chanussot F, și colab. Prevenirea prin fosfatidilcoline polinesaturate dietetice (n-6) a colestazei intrahepatice induse de ciclosporina A la animale. Life Sci. 2003 iunie 13; 73 (4): 381-92.
- Karaman A, și colab. Efectul protector al fosfatidilcolinei polinesaturate asupra afectării hepatice induse de obstrucția biliară la șobolani. J Pediatr Surg. 2003 Septembrie; 38 (9):1341-7.
- Karaman A, și colab. Efectul protector al fosfatidilcolinei polinesaturate asupra afectării hepatice induse de obstrucția biliară la șobolani. J Pediatr Surg. 2003 Septembrie; 38 (9):1341-7.
- Stremmel W, și colab. Protecția mucoasei prin fosfatidilcolină. Dig Dis. 2012; 30 Suppl 3:85-91.
- Parlesak A, și colab. Sărurile biliare primare conjugate reduc permeabilitatea endotoxinei prin celulele epiteliale intestinale și se sinergizează cu fosfatidilcolina în suprimarea producției inflamatorii de citokine. Crit Care Med. 2007 octombrie; 35 (10):2367-74.
- Mitzscherling K, și colab. Fosfatidilcolina inversează creșterea indusă de etanol a permeabilității endotoxinei transepiteliale și elimină activarea leucocitelor transepiteliale. Alcool Clin Exp Res. 2009 Mar; 33(3): 557-62.
- Buzzetti E, și colab. Patogeneza multiplă a bolii hepatice grase nealcoolice (NAFLD). Metabolismul. 2016 August; 65(8):1038-48.
- El Hadi H, și colab. Vitamina E ca tratament pentru boala hepatică grasă nealcoolică: realitate sau mit? Antioxidanți (Basel). 2018 ianuarie 16; 7 (1).
- Bugianesi E, și colab. Un studiu randomizat controlat al metforminei versus vitamina E sau dieta prescriptivă în boala hepatică grasă nealcoolică. Am J Gastroenterol. 2005 Mai; 100 (5):1082-90.
- Sanyal AJ și colab. Pioglitazonă, vitamina E sau placebo pentru steatohepatită nealcoolică. N Engl J Med. 2010 6 mai; 362 (18):1675-85.
- Lavine JE. Tratamentul cu vitamina E a steatohepatitei nealcoolice la copii: un studiu pilot. J Pediatr. 2000 iunie; 136 (6):734-8.
- Peh HY, și colab. Terapia cu vitamina E dincolo de cancer: tocoferol versus tocotrienol. Pharmacol Ther. 2016 iunie; 162: 152-69.
- Qureshi AA, și colab. Modularea dependentă de doză a parametrilor lipidici, citokinelor și ARN de către delta-tocotrienol la subiecții hipercolesterolemici restricționați la dieta Aha Step-1. Brit J din Med & med Res. 2015; 6 (4):351-66.
- Qureshi AA, și colab. Impactul delta-tocotrienolului asupra biomarkerilor inflamatori și a stresului oxidativ la subiecții hipercolesterolemici. Clin Exp Cardiologie. 2015;6(4):1000367.
- Zaiden N, și colab. Tocotrienolii Gamma delta reduc sinteza trigliceridelor hepatice și secreția VLDL. J Ateroscler Thromb. 2010 Octombrie 27; 17 (10): 1019-32.
- Magosso E, și colab. Tocotrienolii pentru normalizarea răspunsului ecogen hepatic în ficatul gras nealcoolic: un studiu clinic randomizat controlat cu placebo. Nutr J. 2013 Decembrie 27; 12 (1): 166.
- Pervez MA, și colab. Efectele suplimentării Delta-tocotrienol asupra enzimelor hepatice, inflamației, stresului oxidativ și steatozei hepatice la pacienții cu boală hepatică grasă nealcoolică. Turk J Gastroenterol. 2018 Martie;29(2):170-176.
- Abenavoli L, și colab. Ciulinul de lapte în bolile hepatice: Trecut, Prezent, Viitor. Phytother Res. 2010 Oct; 24 (10):1423-32.
- Valenzuela A, și colab. Selectivitatea silimarinei asupra creșterii conținutului de GSH în diferite țesuturi ale șobolanului. Planta Med. 1989 octombrie; 55 (5):420-2.
- Rui YC. Progrese în studiile farmacologice ale silimarinei. Domnul Oswaldo Cruz. 1991; 86 Suppl 2: 79-85.
- Gu M, și colab. Silimarina ameliorează disfuncția metabolică asociată cu obezitatea indusă de dietă prin activarea receptorului Farnesyl X. Farmacol Frontal. 2016 Septembrie 28; 7: 345.
- Ali AH, și colab. Progrese recente în dezvoltarea agoniștilor receptorului x farnesoid. Ann Transl Med. 2015 Ianuarie; 3 (1): 5.
- Traussnigg S, și colab. Eficacitatea și siguranța agonistului px-104 al receptorului farnesoid x nesteroidian la pacienții cu boală hepatică grasă nealcoolică (NAFLD). Zeitschrift F Gastroenterologie. 2017 Mai; 55 (05):A71.
- Zhong S, și colab. Efectul terapeutic al silimarinei în tratamentul bolii grase nealcoolice: o meta-analiză (PRISMA) a studiilor de control randomizate. Medicină (Baltimore). 2017 Decembrie; 96 (49): e9061.
- Hajiaghamohammadi AA, și colab. Efectele tratamentului cu metformină, pioglitazonă și silimarină asupra bolii hepatice grase nealcoolice: un studiu pilot randomizat controlat. Hepat Mon. 2012 August;12 (8): e6099.
- Birdsall TC, și colab. Berberina: potențialul terapeutic al unui alcaloid găsit în mai multe plante medicinale. Altern Med Rev. 1997; 2:94-103.
- Imanshahidi M, și colab. Efectele farmacologice și terapeutice ale Berberis vulgaris și constituentul său activ, berberina. Phytother Res. 2008 Aug; 22 (8): 999-1012.
- Zhu X, și colab. Mecanismele potențiale ale berberinei în tratamentul bolii hepatice grase nealcoolice. Molecule. 2016 octombrie 14; 21 (10).
- Lan J, și colab. Meta-analiza efectului și siguranței berberinei în tratamentul diabetului zaharat de tip 2, hiperlipemiei și hipertensiunii. J Etnofarmacol. 2015 23 februarie; 161: 69-81.
- Sun R, și colab. Berberina administrată oral modulează metabolismul lipidic Hepatic prin modificarea metabolismului acidului biliar microbian și a căii de semnalizare intestinală FXR. Mol Pharmacol. 2017 februarie; 91 (2): 110-122.
- Guo T, și colab. Berberina ameliorează steatoza hepatică și suprimă inflamația ficatului și a țesutului adipos la șoareci cu obezitate indusă de dietă. Sci Rep. 2016 Strica 3; 6:22612.
- Schattenberg JM, și colab. JNK1 dar nu JNK2 promovează dezvoltarea steatohepatitei la șoareci. Hepatologie. 2006 ianuarie; 43 (1):163-72.
- Han J, și colab. Modularea microbiotei intestinale ca mecanism antidiabetic al berberinei. Med Sci Monit. 2011; 17: RA164-7.
- Gu L, și colab. Berberina ameliorează deteriorarea joncțiunii epiteliale intestinale și reglează în jos căile de kinază a lanțului ușor de miozină într-un model de endotoxinemie la șoarece. J Infecta Dis. 2011 iunie 1; 203 (11): 1602-12.
- Li N, și colab. Berberina atenuează întreruperea joncțiunii strânse indusă de citokine pro-inflamatorie într-un model in vitro al celulelor epiteliale intestinale. Eur J Pharm Sci. 2010 aprilie 16;40 (1): 1-8.
- Ma X, și colab. Patogeneza diabetului zaharat prin stres oxidativ și inflamație: inhibarea acestuia de către berberină. Farmacol Frontal. 2018 Iulie 27; 9: 782.
- Yan HM, și colab. Eficacitatea berberinei la pacienții cu boală hepatică grasă nealcoolică. PLoS Unu. 2015 August 7;10(8):e0134172.
- Ma YY, și colab. Efectele probioticelor asupra bolii hepatice grase nealcoolice: o meta-analiză. Lumea J Gastroenterol. 2013 octombrie 28; 19 (40): 6911-8.
- Vajro P, și colab. Efectele tulpinii Lactobacillus rhamnosus GG în bolile hepatice legate de obezitate pediatrică. J Pediatr Gastroenterol Nutr. 2011 iunie;52 (6):740-3.
- Alisi A, și colab. Studiu clinic randomizat: efectele benefice ale VSL # 3 la copiii obezi cu steatohepatită nealcoolică. Aliment Pharmacol Ther. 2014 iunie; 39 (11):1276-85.
- P Oqurcrez-Rubio KG și colab. Efectul administrării berberinei asupra sindromului metabolic, sensibilității la insulină și secreției de insulină. Metab Syndr Legate De Disord. 2013 Octombrie; 11 (5):366-9.
- Iacono A, și colab. Probioticele ca strategie terapeutică emergentă pentru tratarea NAFLD: concentrați-vă pe mecanismele moleculare și biochimice. J Nutr Biochem. 2011 august; 22 (8): 699-711.
- Honda Y, și colab. Eficacitatea glutationului pentru tratamentul bolii hepatice grase nealcoolice: un studiu pilot deschis, cu un singur braț, multicentric. BMC Gastroenterol. 2017 August 8; 17 (1):96.
- Dentico P, și colab. . Recenti Prog Med. 1995 Iulie-August; 86 (7-8):290-3.
- Khoshbaten M, și colab. N-Acetil-Cisteina îmbunătățește funcția hepatică la pacienții cu boală hepatică grasă nealcoolică. Hepatita Mon. 2010;10(1):12-16.
- Muto C, și colab. Gamma-tocotrienolul reduce nivelul de triacilglicerol la hepatocitele primare de șobolan prin reglarea metabolismului acizilor grași. J Clin Biochem Nutr. 2013;52(1):32-37.
- Parker HM, și colab. Suplimentarea cu Omega-3 și boala hepatică grasă nealcoolică: o revizuire sistematică și meta-analiză. J Hepatol. 2012;56(4):944-51.
modificări ale ficatului gras: corelate cu un deficit de fosfatidil colină?
fosfatidil colina (PC) este esențială pentru sănătatea tuturor celulelor din organism și este una dintre principalele fosfolipide din care sunt alcătuite membranele celulare., PC cuprinde peste 90% din conținutul total de fosfolipide biliare și facilitează emulsificarea, absorbția și transportul grăsimilor. Studiile au arătat că aportul adecvat recomandat (AI) de colină (vezi Tabelul 1) poate să nu fie suficient pentru prevenirea simptomelor de deficiență, cum ar fi modificările ficatului gras sau leziunile musculare. În plus, un studiu recent a constatat că doar 8% dintre adulții din SUA îndeplinesc AI recomandată de colină, cu vegetarieni, femei în postmenopauză și bărbați cu cel mai mare risc de inadecvare., Polimorfisme genetice, de asemenea, poate crește nevoia de colină, care, de asemenea, este o sursă de grupări metil în organism.
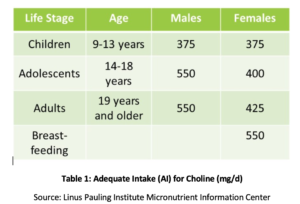
la femeile aflate în postmenopauză cu NAFLD, s-a dovedit că scăderea aportului de colină este asociată semnificativ cu un risc crescut de fibroză. La animale, s-a demonstrat că PC protejează împotriva fibrozei asociate cu inflamația hepatică., S-a demonstrat că aportul crescut de PC îmbunătățește secreția de lipide biliare, prevenind astfel colestaza și leziunile hepatice ulterioare prin numeroase mecanisme, inclusiv suprimarea factorului nuclear kappa b (NF-kB), un declanșator molecular bine înțeles al inflamației., Într-un model animal de obstrucție biliară, s-a demonstrat că PC-ul suplimentar reduce leziunile hepatice, proliferarea ductală și fibroza.
PC-ul este, de asemenea, esențial pentru sănătatea intestinului și este o componentă primară a stratului protector de mucus intestinal. În culturile celulare, s-a demonstrat că tratamentul cu PC reduce migrarea endotoxinei prin celulele epiteliale intestinale, suprimând în continuare răspunsul citokinelor inflamatorii asociate. PC reduce, de asemenea, translocarea endotoxinei în stabilirea creșterilor induse de alcool ale permeabilității intestinale. Acest efect benefic a fost propus ca unul dintre mecanismele prin care PC poate fi considerat terapeutic în boala hepatică alcoolică.
vitamina E
ca un stres oxidativ lovit și diminuat de apărare antioxidante a fost propus ca un factor de conducere dezvoltarea de NAFLD, nu ar trebui să fie surprinzător faptul că antioxidanții au fost investigate ca un potențial tratament pentru starea.
 vitamina E a fost studiată în mai multe studii clinice pentru tratamentul NAFLD, atât ca terapie independentă, cât și ca terapie adjuvantă. Într-o revizuire a acestor studii, doza de vitamina E a variat de la 400 la 1200 UI/zi, iar durata studiului a fost de la 24 de săptămâni la mai mult de doi ani. Constatările au fost, în general, pozitive, arătând că atunci când vitamina E a fost inclusă, s-au observat îmbunătățiri ale nivelurilor histologice, steatozei și/sau transaminazelor., În pediatrie cu NAFLD, vitamina E a fost studiată și ca terapie. Într-un studiu pilot deschis care a inclus 11 copii cu NAFLD, s-a constatat că suplimentarea între 400 și 1200 UI de vitamina E timp de patru până la zece luni normalizează nivelurile de transaminază și fosfatază alcalină în timpul tratamentului, cu toate acestea au revenit la anormal odată ce tratamentul a fost oprit. Ecogenitatea hepatică nu s-a modificat pe parcursul tratamentului.
vitamina E a fost studiată în mai multe studii clinice pentru tratamentul NAFLD, atât ca terapie independentă, cât și ca terapie adjuvantă. Într-o revizuire a acestor studii, doza de vitamina E a variat de la 400 la 1200 UI/zi, iar durata studiului a fost de la 24 de săptămâni la mai mult de doi ani. Constatările au fost, în general, pozitive, arătând că atunci când vitamina E a fost inclusă, s-au observat îmbunătățiri ale nivelurilor histologice, steatozei și/sau transaminazelor., În pediatrie cu NAFLD, vitamina E a fost studiată și ca terapie. Într-un studiu pilot deschis care a inclus 11 copii cu NAFLD, s-a constatat că suplimentarea între 400 și 1200 UI de vitamina E timp de patru până la zece luni normalizează nivelurile de transaminază și fosfatază alcalină în timpul tratamentului, cu toate acestea au revenit la anormal odată ce tratamentul a fost oprit. Ecogenitatea hepatică nu s-a modificat pe parcursul tratamentului.
tocotrienolii sunt familia mai puțin studiată a formelor naturale de vitamina E, tocoferolii, mai des găsiți în natură, dominând cercetarea științifică. Cu toate acestea, tocotrienolii sunt antioxidanți puternici, citați în unele cercetări ca având de 40 până la 60 de ori potențialul antioxidant al tocoferolilor. Tocotrienolii s-au dovedit a îmbunătăți colesterolul total și fracțiunile sale, reducând colesterolul total și LDL cu 15 până la 20%, și trigliceridele până la aproape 30%. Tocotrienolii s-au dovedit, de asemenea, că au efecte antiinflamatorii și antioxidante in vivo, scăzând nivelurile de proteină C reactivă (hs-CRP) cu sensibilitate ridicată și reducând oxidarea LDL.
tocotrienolii au fost, de asemenea, studiați ca tratament pentru NAFLD. La pacienții cu NAFLD diagnosticat cu ultrasunete, s-a demonstrat că 200 mg de tocotrienoli amestecați (proveniți din ulei de palmier, cu o fracție gamma ridicată și încă 61 mg de alfa tocoferoli) luați de două ori pe zi timp de un an normalizează semnificativ răspunsul ecogen hepatic și rata de remisiune comparativ cu placebo. Într-un al doilea studiu, care a inclus pacienți cu NAFLD diagnosticat cu ultrasunete și creșterea transaminazelor, 300 mg de tocotrienoli (un amestec delta:gamma 90:10) administrat de două ori pe zi timp de 12 săptămâni au scăzut semnificativ nivelurile de aspartat aminotransferază (AST), alanin aminotransferază (ALT), hs-CRP și malondialdehidă (un marker al stresului oxidativ), precum și scorul indicelui ficatului gras comparativ cu placebo.
ciulinul de lapte
ciulinul de lapte (Silybum marianum) este probabil cel mai cunoscut Botanic de protecție a ficatului. Silimarina, un amestec de constituenți activi ai ciulinului de lapte, și silibinina, cel mai activ compus găsit în el, s-au arătat în studiile pe animale pentru a reduce leziunile hepatice cauzate de acetaminofen, alcool, supraîncărcare cu fier și radiații, printre alte substanțe toxice hepatice cunoscute. S-a demonstrat că silimarina crește nivelul de glutation, un puternic antioxidant, atât în ficat, cât și în intestine. De asemenea, reduce peroxidarea lipidelor, care dăunează membranelor celulare, modificându-le funcția și, eventual, provocând moartea celulară.
s-a demonstrat că silibinina și silimarina activează un receptor nuclear al acidului biliar cunoscut sub numele de receptor x farnesoid (FXR) în ficat, reglând în jos căile inflamatorii și corectând rezistența la insulină și dislipidemia indusă de alimentația bogată în grăsimi (HFD). FXR este un regulator cheie al acidului biliar, glucozei și echilibrului lipidic din organism. Medicamentele care interacționează cu FXR într-un mod similar cu acești compuși derivați de ciulin de lapte sunt, de asemenea, investigate pentru tratamentul NAFLD și provocările metabolice conexe.
studiile clinice au arătat, de asemenea, că ciulinul de lapte îmbunătățește diferiți parametri asociați cu NAFLD. O meta-analiză din 2017 a constatat că tratamentul cu ciulin de lapte reduce semnificativ ALT și AST cu -5,08 UI/l și, respectiv, -5,44 UI/l la pacienții cu NAFLD. Dozele au variat de la 140 mg o dată pe zi la 200 mg de trei ori pe zi, pe o durată de 8 până la 24 de săptămâni. La cea mai mică doză de 140 mg pe zi, după 8 săptămâni, s-au observat îmbunătățiri semnificative ale glicemiei în condiții de repaus alimentar (FBG), profilului lipidic și nivelurilor serice de insulină, în plus față de reducerile AST și ALT de la 56 la 37.77 UI/L, respectiv 78, 73 până la 53, 05 UI / l.
berberina
berberina, alcaloidul galben-portocaliu găsit în plante, cum ar fi rădăcina și coaja de struguri din Oregon, goldenseal și dracilă, este o altă substanță derivată din punct de vedere botanic, care are numeroase mecanisme prin care poate ajuta la protejarea împotriva NAFLD și la susținerea rezoluției sale.,,
efectele antidiabetice și de echilibrare a lipidelor ale berberinei au fost demonstrate în mai multe studii clinice, iar poate fi un mijloc prin care berberina afectează pozitiv funcția hepatică. Berberina a fost demonstrat de a modifica expresia genelor legate de metabolism și metabolismul acizilor biliari prin căi care implică FXR, de asemenea. În studiile la animale, s-a demonstrat că berberina are efectul de a preveni obezitatea asociată cu HFD și acumularea trigliceridelor hepatice la șoarecii de tip sălbatic (normal), dar nu și la cei care au avut eliminarea genetică a expresiei intestinale FXR. Berberina s-a dovedit, de asemenea, că suprimă inflamația asociată obezității și steatoza hepatică la șoareci prin scăderea fosforilării complexului inflamator cunoscut sub numele de JNK1, o protein kinază implicată în dezvoltarea steatohepatitei. JNK1 este puternic activat de factorii de stres de mediu și de citokinele pro-inflamatorii.
poate fi un mijloc prin care berberina afectează pozitiv funcția hepatică. Berberina a fost demonstrat de a modifica expresia genelor legate de metabolism și metabolismul acizilor biliari prin căi care implică FXR, de asemenea. În studiile la animale, s-a demonstrat că berberina are efectul de a preveni obezitatea asociată cu HFD și acumularea trigliceridelor hepatice la șoarecii de tip sălbatic (normal), dar nu și la cei care au avut eliminarea genetică a expresiei intestinale FXR. Berberina s-a dovedit, de asemenea, că suprimă inflamația asociată obezității și steatoza hepatică la șoareci prin scăderea fosforilării complexului inflamator cunoscut sub numele de JNK1, o protein kinază implicată în dezvoltarea steatohepatitei. JNK1 este puternic activat de factorii de stres de mediu și de citokinele pro-inflamatorii.
berberina acționează și în intestin. Afectează nu numai echilibrul microbian intestinal, ci influențează direct permeabilitatea intestinală, îmbunătățind integritatea joncțiunii strânse la animalele supuse endotoxemiei sau culturilor celulare tratate cu citokine pro-inflamatorii., Au fost demonstrate și efecte antiinflamatorii directe.
beneficiile berberinei în NAFLD au fost, de asemenea, demonstrate clinic într-un studiu clinic randomizat, controlat paralel, deschis. La pacienții cu NAFLD, s-a demonstrat că berberina restabilește arhitectura hepatică normală, lipidele și metabolismul zahărului din sânge, cu îmbunătățiri semnificative observate asupra populației care a implementat doar modificări ale stilului de viață.
probiotice
având în vedere relația dintre numeroasele tulburări ale sistemului digestiv și creșterea enzimelor hepatice, nu este surprinzător faptul că probioticele au fost studiate și ca tratament pentru NAFLD. O meta-analiză recentă rezumă bine constatările colective.
o sută treizeci și patru de pacienți diagnosticați cu NAFL/NASH prin biopsie hepatică au fost incluși în această analiză și fiecare intervenție utilizată în cele patru studii randomizate, controlate eligibile pentru această meta-analiză a fost unică (Lactobacillus bulgaricus și Streptococcus thermophilus timp de trei luni; Lactobacillus GG timp de opt săptămâni; Bifidobacterium longum și fructooligozaharide (FOS) timp de 24 de săptămâni; și o combinație brevetată de Lactobacillus plantarum, L. delbrueckii, L. acidophilus, L. rhamnosus și Bifidobacterium bifidum timp de șase luni). Doza de probiotice a variat de la 500 de milioane la 12 miliarde de unități care formează colonii (CFU) zilnic. S-a demonstrat că tratamentele probiotice scad semnificativ nivelurile ALT și AST cu -23,71 UI/l și, respectiv, -19,77 UI/l. S-au observat, de asemenea, îmbunătățiri semnificative ale colesterolului total, ale factorului de necroză tumorală (TNF) – nivelurile de la centimetrii și ale rezistenței la insulină.
două studii clinice suplimentare au investigat probioticele ca tratament pentru NAFLD pediatric. Într-un studiu pilot dublu-orb, controlat cu placebo, doisprezece copii, având o vârstă medie de 10 ani.7 ani, cu modificări hepatice grase diagnosticate cu ultrasunete și creșterea persistentă a transaminazelor, li s-au administrat 12 miliarde CFU de L. rhamnosus GG sau placebo zilnic timp de 8 săptămâni. Tratamentul cu probiotic a redus semnificativ nivelurile de ALT comparativ cu placebo, cu toate acestea echogenicitatea hepatică și nivelurile AST nu s-au modificat. În plus, anticorpii anti-peptidoglican-polizaharidici, un indicator al bacteriilor sau translocării membranei bacteriene prin bariera intestinală, au scăzut semnificativ la copiii care au primit probioticul comparativ cu placebo. Al doilea studiu a investigat tratamentul copiilor cu NAFLD dovedit prin biopsie cu VSL #3, un amestec cu potență ridicată de 8 tulpini probiotice (inclusiv Streptococcus thermophilus, 3 bifidobacterii spp., și 4 Lactobacillus spp.), comparativ cu placebo. La copiii care au primit probioticul, scorurile ficatului gras au fost semnificativ îmbunătățite, probabilitatea de a nu avea ficat gras ușor, moderat sau sever la sfârșitul studiului fiind de 21%, 70%, 9% și 0% comparativ cu 0%, 7%, 76% și 17% în grupul placebo.
concluzie
există o gamă largă de opțiuni sigure și eficiente disponibile care susțin restabilirea sănătății la cei cu NAFLD. Deși fiecare individ poate avea mecanisme de bază diferite care contribuie la disfuncția hepatică și modificările inflamatorii, fiecare dintre acești agenți naturali de susținere—și mulți alții (vezi Tabelul 2)—pot susține funcția hepatică normală la persoanele cu aceste provocări.
Tabelul 2: intervenții nutriționale și botanice pentru NAFLD. Substanțele nutritive precum acestea ar trebui utilizate sub îndrumarea unui medic calificat și autorizat.
| Nutrient | dozare | mecanism |
| fosfatidilcolina( PC), o sursă de colină dietetică | 1, 5 g de două ori pe zi în timpul meselor (PC) sau 200 mg de două ori pe zi (colină) | Colina este un deficit alimentar comun. PC-ul este necesar pentru producerea bilei și a barierei protectoare a mucoasei gastrointestinale. |
| semințe de armurariu | 140 până la 200 mg o dată până la trei ori pe zi | hepatoprotector. Sprijină nivelurile hepatice de glutation, stabilizează pompa de export a sării biliare (BSEP) și activează căile FXR. |
| berberina HCl | 500 mg de două până la trei ori pe zi | îmbunătățește glicemia și profilurile lipidice, reducând, de asemenea, conținutul de grăsimi hepatice. |
| probiotice, inclusiv tulpini precum B. longum, B. bifidum, S. thermophilus, L. rhamnosus, L. acidophilus și L. plantarum | 12 miliarde unități formatoare de colonii (UFC) zilnic | îmbunătățirea funcției barierei epiteliale intestinale și reducerea inflamației intestinale și sistemice. |
| Acetil-glutation | 300 mg zilnic | îmbunătățește capacitatea de detoxifiere a hepatocitelor. |
| N-acetilcisteina (NAC) | 500-600 mg de două ori pe zi, cel mai bine administrat pe stomacul gol | NAC blochează propagarea peroxidării lipidelor și susține nivelurile hepatice de glutation. |
| vitamina E (tocoferoli)
sau tocotrienoli |
400 la 1200 UI zilnic cu alimente
200 până la 300 mg de două ori pe zi cu alimente |
antioxidant protector.
tocotrienolii atenuează acumularea de trigliceride prin reglarea enzimelor de sintază a acizilor grași și carnitină palmitoiltransferază, ducând la reducerea inflamației hepatice și a stresului reticulului endoplasmatic. |
| acizii grași esențiali Omega-3 | 2 – 4 g zilnic, cu mese | acizii grași polinesaturați Omega-3 sunt cunoscuți pentru a regla în jos proteina care leagă elementul de reglementare a sterolului-1C și pentru a regla în sus receptorul alfa activat de proliferatorul peroxizomului, favorizând astfel oxidarea acizilor grași și reducând steatoza. |