Schemi di legame comuni nelle strutture organiche
I metodi esaminati sopra per disegnare strutture di Lewis e determinare cariche formali sugli atomi sono un punto di partenza essenziale per un chimico organico alle prime armi e funzionano abbastanza bene quando si tratta di strutture piccole e semplici. Ma come puoi immaginare, questi metodi diventano irragionevolmente noiosi e dispendiosi in termini di tempo quando inizi a trattare con strutture più grandi. Sarebbe irrealistico, ad esempio, chiederti di disegnare la struttura di Lewis sottostante (di uno dei quattro blocchi costitutivi nucleosidici che compongono il DNA) e determinare tutte le cariche formali sommando, su base atomo per atomo, gli elettroni di valenza.
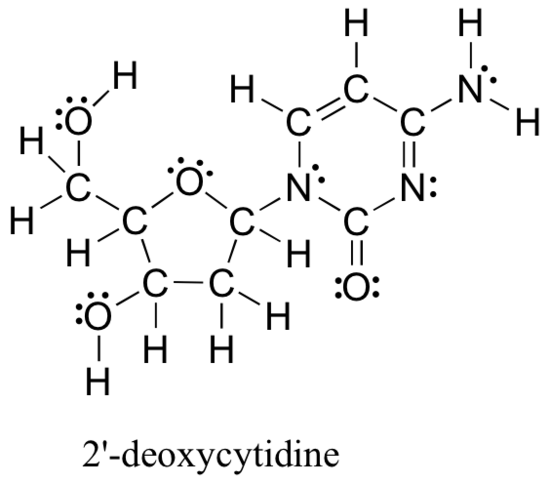
Eppure, come chimici organici, e specialmente come chimici organici che si occupano di molecole biologiche, ci si aspetta presto di disegnare la struttura di grandi molecole come questa su base regolare. Chiaramente, è necessario sviluppare la capacità di disegnare in modo rapido ed efficiente grandi strutture e determinare oneri formali. Fortunatamente, questa capacità non è terribilmente difficile da trovare – tutto quello che serve è un paio di scorciatoie e qualche pratica a riconoscere i modelli di legame comuni.
Iniziamo con il carbonio, l’elemento più importante per i chimici organici. Si dice che il carbonio sia tetravalente, il che significa che tende a formare quattro legami. Se si osservano le semplici strutture di metano, metanolo, etano, etene ed etino nelle figure della sezione precedente, si dovrebbe riconoscere rapidamente che in ogni molecola l’atomo di carbonio ha quattro legami e una carica formale pari a zero.
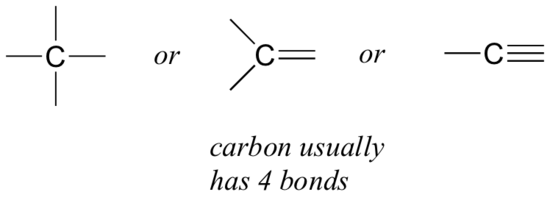
Questo è un modello che vale per la maggior parte delle molecole organiche che vedremo, ma ci sono anche delle eccezioni.
Nell’anidride carbonica, l’atomo di carbonio ha doppi legami con l’ossigeno su entrambi i lati (O=C = O). Più avanti in questo capitolo e in tutto questo libro vedremo esempi di ioni organici chiamati ‘carbocations’ e carbanions’, in cui un atomo di carbonio porta una carica formale positiva o negativa, rispettivamente. Se un carbonio ha solo tre legami e un guscio di valenza non riempito (in altre parole, se non soddisfa la regola dell’ottetto), avrà una carica formale positiva.
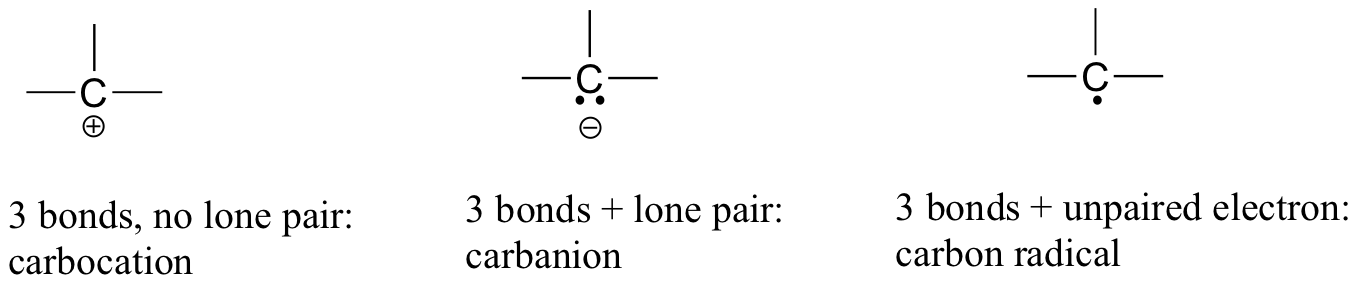
Se, d’altra parte, ha tre legami più una coppia solitaria di elettroni, avrà una carica formale di -1. Un’altra possibilità è un carbonio con tre legami e un singolo elettrone spaiato (radicale libero): in questo caso, il carbonio ha una carica formale di zero. (Un’ultima possibilità è una specie altamente reattiva chiamata “carbene”, in cui un carbonio ha due legami e una sola coppia di elettroni, dandogli una carica formale di zero. Potresti incontrare carbeni in corsi di chimica più avanzati, ma non saranno discussi ulteriormente in questo libro).
Dovresti certamente usare i metodi che hai imparato per verificare che queste accuse formali siano corrette per gli esempi sopra riportati. Ancora più importante, è necessario, prima di progredire molto più nel vostro studio della chimica organica, di riconoscere semplicemente questi modelli (e gli schemi descritti di seguito per altri atomi) ed essere in grado di identificare i carboni che sopportano cariche formali positive e negative da una rapida ispezione.
Il modello per gli idrogeni è semplice: gli atomi di idrogeno hanno un solo legame e nessuna carica formale. Le eccezioni a questa regola sono il protone, H+, e lo hyd idruro, H -, che è un protone più due elettroni. Poiché ci stiamo concentrando in questo libro sulla chimica organica applicata agli esseri viventi, tuttavia, non vedremo protoni e idruri “nudi” in quanto tali, perché sono troppo reattivi per essere presenti in quella forma in soluzione acquosa. Tuttavia, l’idea di un protone sarà molto importante quando discuteremo di chimica acido-base, e l’idea di uno ion idruro diventerà molto importante molto più tardi nel libro quando discuteremo di reazioni di ossidazione e riduzione organiche. Di norma, tuttavia, tutti gli atomi di idrogeno nelle molecole organiche hanno un legame e nessuna carica formale.
Passiamo ora agli atomi di ossigeno. In genere, si vedrà un legame di ossigeno in tre modi, ognuno dei quali soddisfano la regola dell’ottetto.
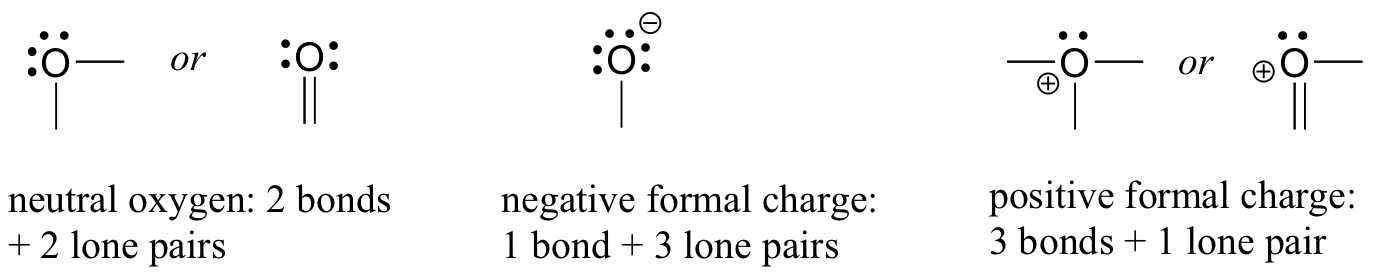
Se ha due legami e due coppie solitarie, come in acqua, avrà una carica formale di zero. Se ha un legame e tre coppie solitarie, come nello hydroxide idrossido, avrà una carica formale di-1. Se ha tre legami e una coppia solitaria, come nello hyd idronio, avrà una carica formale di +1.
Quando arriviamo alla nostra discussione sulla chimica dei radicali liberi nel capitolo 17, vedremo altre possibilità, come ad esempio dove un atomo di ossigeno ha un legame, una coppia solitaria e un elettrone spaiato (radicale libero), dandogli una carica formale di zero. Per ora, tuttavia, concentrarsi sui tre principali esempi non radicali, in quanto questi rappresenteranno praticamente tutto ciò che vediamo fino al capitolo 17.
L’azoto ha due principali modelli di legame, entrambi i quali soddisfano la regola dell’ottetto:
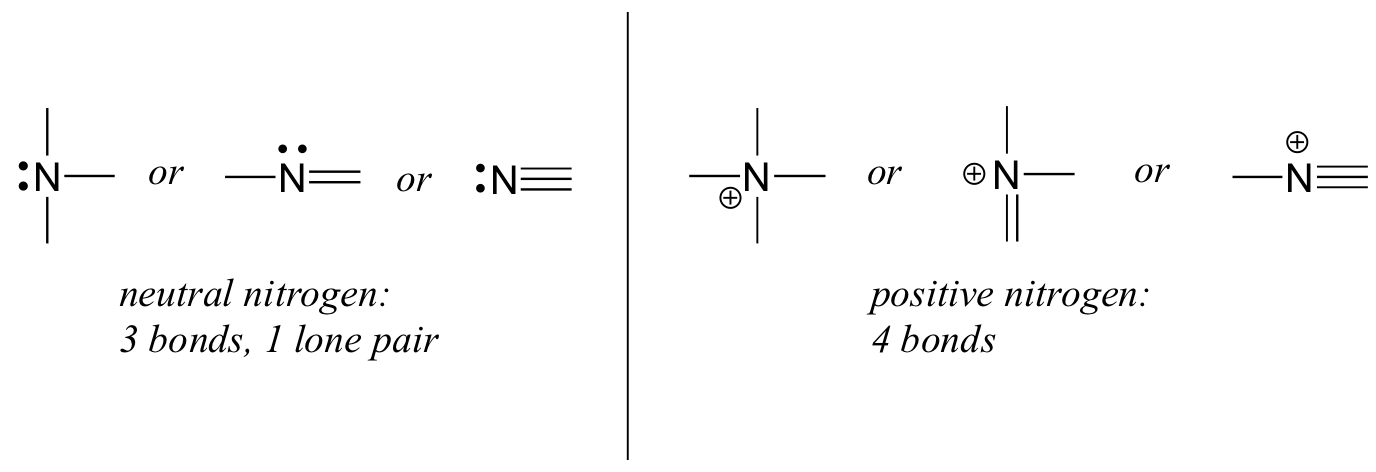
Se un azoto ha tre legami e una coppia solitaria, ha una carica formale pari a zero. Se ha quattro legami (e nessuna coppia solitaria), ha una carica formale di +1. In un modello di legame abbastanza raro, l’azoto caricato negativamente ha due legami e due coppie solitarie.
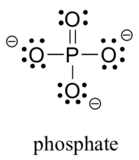
Due elementi di terza fila si trovano comunemente nelle molecole organiche biologiche: zolfo e fosforo. Sebbene entrambi questi elementi abbiano altri modelli di legame rilevanti nella chimica di laboratorio, in un contesto biologico lo zolfo segue quasi sempre lo stesso modello di legame / carica formale dell’ossigeno, mentre il fosforo è presente sotto forma di phosphate fosfato (PO43-), dove ha cinque legami (quasi sempre all’ossigeno), nessuna coppia solitaria e una carica formale di zero. Ricorda che gli elementi nella terza fila della tavola periodica hanno orbitali d nel loro guscio di valenza così come orbitali s e p, e quindi non sono vincolati dalla regola dell’ottetto.
Infine, gli alogeni (fluoro, cloro, bromo e iodio) sono molto importanti nella chimica organica di laboratorio e medicinale, ma meno comuni nelle molecole organiche presenti in natura. Gli alogeni nei composti organici di solito sono visti con un legame, tre coppie solitarie e una carica formale di zero. A volte, specialmente nel caso del bromo, incontreremo specie reattive in cui l’alogeno ha due legami (di solito in un anello a tre membri), due coppie solitarie e una carica formale di +1.

Queste regole, se apprese e interiorizzate in modo che non sia nemmeno necessario pensarci, ti permetteranno di disegnare grandi strutture organiche, complete di cariche formali, abbastanza rapidamente.
Una volta ottenuto il blocco di disegnare strutture di Lewis, non è sempre necessario disegnare coppie solitarie su eteroatomi, poiché si può supporre che il numero corretto di elettroni sia presente attorno a ciascun atomo per corrispondere alla carica formale indicata (o alla sua mancanza). Occasionalmente, però, vengono disegnate coppie solitarie se così facendo aiuta a rendere più chiara una spiegazione.