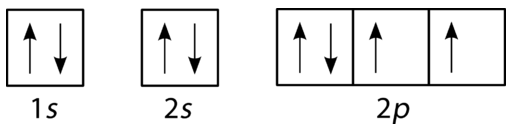
Diagrammi di riempimento orbitale
Un diagramma di riempimento orbitale è il modo più visivo per rappresentare la disposizione di tutti gli elettroni in un particolare atomo. In un diagramma di riempimento orbitale, i singoli orbitali sono mostrati come cerchi (o quadrati) e gli orbitali all’interno di un sottolivello sono disegnati uno accanto all’altro orizzontalmente. Ogni sottolivello è etichettato dal suo livello di energia principale e sottolivello. Gli elettroni sono indicati dalle frecce all’interno dei cerchi. Una freccia rivolta verso l’alto indica una direzione di rotazione, mentre una freccia rivolta verso il basso indica l’altra direzione. I diagrammi di riempimento orbitale per idrogeno, elio e litio sono mostrati nella figura seguente.
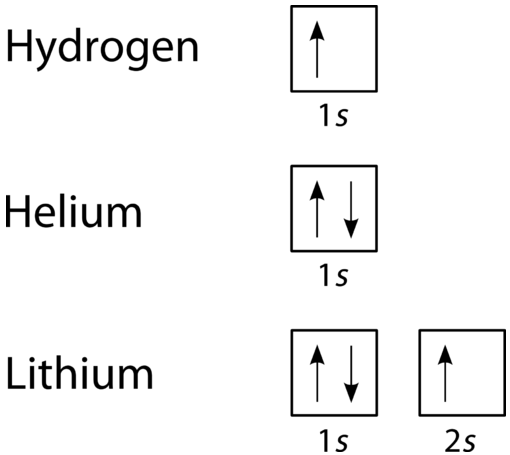
Secondo il processo Aufbau, i sottolivelli e gli orbitali sono riempiti di elettroni in ordine crescente di energia. Poiché il sottolivello\ (s\) è costituito da un solo orbitale, il secondo elettrone si accoppia semplicemente con il primo elettrone come nell’elio. L’elemento successivo è il litio e richiede l’uso del successivo sottolivello disponibile, il \(2s\).
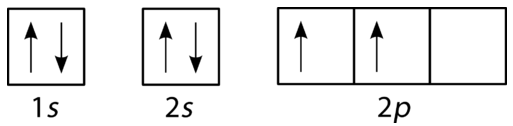
Lo schema di riempimento per il carbonio è mostrato nella figura seguente. Ci sono due elettroni \(2p\) per il carbonio e ognuno occupa il proprio orbitale\ (2p\).
L’ossigeno ha quattro \(2p\) elettroni. Dopo che ogni orbitale \(2p\) ha un elettrone in esso, il quarto elettrone può essere posizionato nel primo orbitale\ (2p\) con uno spin opposto a quello dell’altro elettrone in quell’orbitale.