Back to Writing Lewis Structures for Molecules
La struttura scheletrica di una molecola covalente può spesso essere determinata considerando le valenze degli atomi costituenti. Di solito l’atomo che forma il maggior numero di legami si trova al centro dello scheletro, dove può connettersi al numero massimo di altri atomi.
Esempio 1: L’acido ipocloroso ha la formula molecolare HOCl. Disegna una formula di struttura
.
Soluzione Ci sono diversi modi possibili per collegare gli atomi insieme
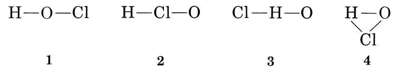
La valenza usuale di H è 1, e quindi le strutture 3 e 4, che hanno due legami con H, possono essere eliminate. La solita valenza di Cl è anche 1, e quindi la struttura 2 può anche essere esclusa. La struttura 1 mostra H che forma un legame, Cl che ne forma uno e O che ne forma due, in accordo con le solite valenze, e così viene scelto.
Il numero totale di elettroni di valenza disponibili è 1 da H più 6 da O più 7 da Cl, o 14. Riempiendo questi nello scheletro che abbiamo
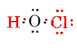
Si noti che O, che aveva la valenza più grande, si trova al centro dello scheletro.
Esempio 2:
Disegna una formula strutturale per l’idrossilammina, NH3O.
Soluzione In questo caso N ha la valenza più grande (3), seguita da O (2) e H (1). Sia N che O possono formare “ponti” tra altri atomi, ma H non può. Pertanto mettiamo N e O al centro dello scheletro per dare
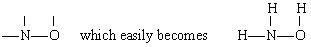
per aggiunta dei tre atomi H.
Ci sono un totale di 5 + 3 + 6 = 14 elettroni di valenza da N, 3H e O. Questi possono essere posizionati come segue:
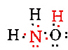
Una volta determinato il diagramma di Lewis, la formula molecolare viene spesso riscritta per ricordarci quale sia la formula strutturale. Ad esempio, la formula molecolare per l’idrossilammina è solitamente scritta NH2OH invece di NH3O per ricordarci che due H sono legate a N e una a O. Si presume che la persona che legge la formula si renderà conto che N e O hanno ciascuno un elettrone di valenza da condividere tra loro, collegando —NH2 con —OH. In alcuni casi più di una struttura scheletrica soddisferà anche la valenza di ciascun atomo e la regola dell’ottetto. Ad esempio, è possibile verificare che la formula molecolare C2H6O corrisponda ad entrambe le seguenti:
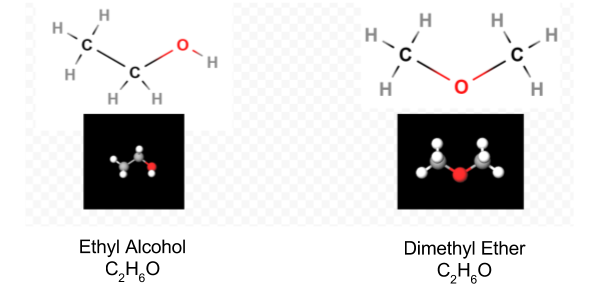
In tal caso possiamo solo decidere quale struttura molecolare abbiamo per esperimento. Le proprietà dell’alcol etilico quando diluito con acqua e consumato sono ben note. L’etere dimetilico è un gas. Come l’etere dietilico utilizzato nelle sale operatorie, è altamente esplosivo e può farti dormire. Due molecole, come l’etere dimetilico e l’alcol etilico, che hanno la stessa formula molecolare ma diverse formule strutturali sono detti isomeri.
Torna a scrivere Strutture di Lewis per molecole
Ringraziamenti:
Le molecole di C2H6O e le loro strutture scheletriche sono state create usando MolView.