- Introduzione
- Conservazione evolutiva dei canali del potassio
- Diversità dei canali del potassio voltaggio-gated
- Potenziali applicazioni terapeutiche dei modulatori dei canali del potassio
- potassio Voltaggio-dipendenti struttura di canale
- Le canalopatie legate ai canali del potassio voltaggio-dipendenti
- Riferimenti e note
Introduzione
I canali del potassio Voltage-gated formano una famiglia ampia e diversificata che viene conservata evolutivamente. Ci sono 40 geni del canale del potassio voltaggio-gated umani appartenenti a 12 sottofamiglie. Questi canali KV mostrano ampie distribuzioni nel sistema nervoso e in altri tessuti. Per le cellule eccitabili come neuroni, cardiomiociti e muscoli, i canali KV regolano la forma d’onda e il modello di cottura dei potenziali d’azione. I canali KV possono anche regolare il volume cellulare, la proliferazione e la migrazione di una vasta gamma di tipi di cellule.
I canali di potassio voltaggio-gated (KV) appartengono a una delle famiglie di canali ionici più grandi e altamente evolutivamente conservate . Ogni canale KV contiene quattro subunità α-formanti pori simili o identici e può anche contenere subunità β ausiliarie che potrebbero influenzare la funzione e/o la localizzazione del canale . Ogni subunità che forma i pori dei canali KV contiene sei segmenti transmembrana (S1-S6), con i primi quattro segmenti transmembrana (S1-S4) che costituiscono il sensore di tensione e gli ultimi due segmenti transmembrana che fiancheggiano un anello dei pori (S5-P-S6) come dominio dei pori. Oltre alla posizione cromosomica di ciascun gene del canale KV nell’uomo, nel topo e nel ratto, le proprietà fisiologiche e farmacologiche del canale e la sua distribuzione tissutale e fisiopatologia sono state fornite dal database dei canali ionici dal Sottocomitato sui canali del potassio voltaggio-dipendenti del Comitato per la nomenclatura dell’Unione Internazionale di farmacologia (NC-IUPHAR). Questo articolo presenta un’introduzione alla diversità e alle funzioni dei canali del potassio voltaggio-gated.
Conservazione evolutiva dei canali del potassio
La selettività K+che è sorta nei procarioti è conservata in un gran numero di canali del potassio con notevole diversità . Come mostrato in Figura 1, un albero evolutivo della superfamiglia del canale cationico voltaggio-gated può essere proposto sulla base del confronto dei geni del canale nel genoma umano con quelli nei genomi di altri metazoans tra cui topo, pollo, pesce palla, tunicato, mosca della frutta, zanzara, nematode e anemone di mare . Questo albero evolutivo prevede una singola origine della selettività K+per rettificare internamente i canali del potassio (Kir), i canali del potassio voltaggio-gated (KV) e i canali del potassio a due pori (K2P). È importante notare, tuttavia, che una distinta selettività K+è probabilmente associata al canale K+ dell’organello evolutivamente conservato che risiede negli endosomi e nei lisosomi .
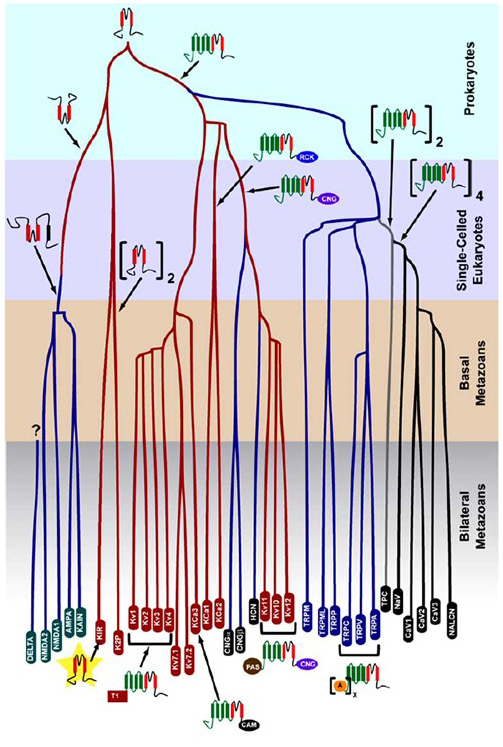
Figura 1. Un albero evolutivo per la genesi della superfamiglia del canale cationico voltaggio-gated. Basato su analisi genome-wide dei canali ionici da cnidari e bilaterali metazoi , questo albero evolutivo, che raffigura una origine comune per il K+-selettività dei canali del potassio (con i nomi di famiglia in rosso ovali), che sono legati per tetramerica cyclic nucleotide-gated di cationi (CNG) canali hyperpolarization-gated di cationi (HCN) canali e canali TRP, dimerica TPC canali, e il monomerico Na+, Ca2+, e NALCN canali. Le lunghezze dei rami non riflettono il tempo. I nomi della famiglia genica in basso segnano i singoli rami. I recettori ionotropici del glutammato sono inclusi sulla base dell’ipotesi che abbiano avuto origine da un’inversione del dominio di formazione dei pori del canale del potassio con due segmenti transmembrana (rosso). Il dominio del sensore di tensione ha quattro segmenti transmembrana (verde). A: ripetizioni di ankryin; CAM: dominio di legame calmodulina; CNG: dominio di legame nucleotidico ciclico; PAS: dominio Per-ARNT-Sim; RCK: regolatore di conduttanza del dominio K+; T1: dominio di tetramerizzazione.
Diversità dei canali del potassio voltaggio-gated
Il genoma umano contiene ~80 geni del canale del potassio di cui 40 geni codificano le subunità poro-formanti voltaggio-gated del canale del potassio che rientrano in 12 sottofamiglie (Fig. 2). Fisiologicamente suddivisi in canali del potassio di tipo A che mostrano inattivazione rapida e canali del potassio del raddrizzatore ritardato senza inattivazione rapida, questi canali KV sono molecolarmente e funzionalmente diversi. L’inattivazione rapida, che può influire sulla durata del potenziale d’azione durante la cottura ripetitiva, è evidente nei canali KV1 contenenti KV1.4 o KVß1, KV3 canali, e KV4 canali . La corrente di potassio raddrizzatore ritardato originariamente caratterizzato da Hodgkin e Huxley per il suo ruolo nel potenziale d’azione corrisponde probabilmente ai canali KV1 squid che possono contare su RNA editing per ottenere la diversità funzionale flessibile come molti piccoli assoni del lobo fibra gigante neuroni si fondono per formare l’assone gigante squid con maggiore velocità di conduzione potenziale d’azione .
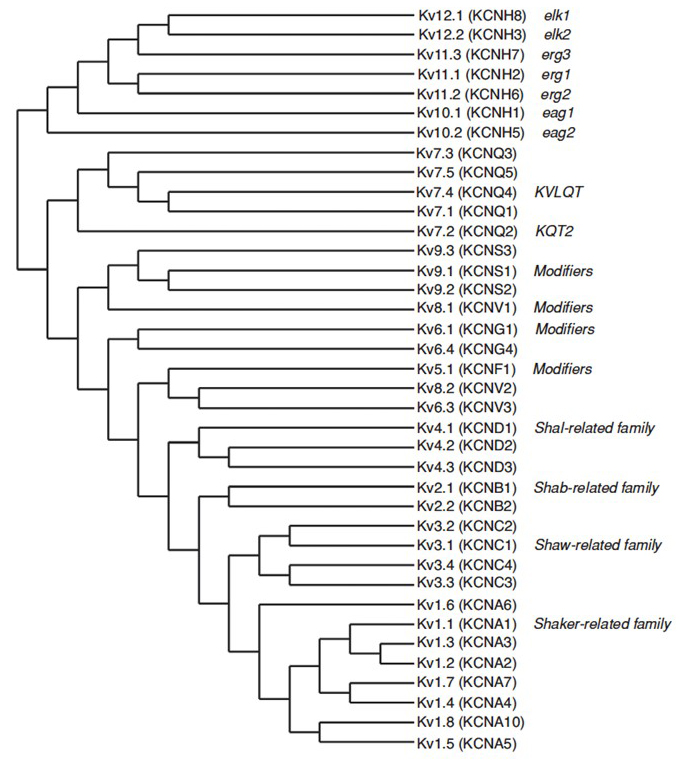
Figura 2. Albero filogenetico per le famiglie KV1-12. Questo albero filogenetico è generato sulla base di analisi del dominio idrofobo contenente i sei segmenti transmembrana (S1-S6) . Sono mostrati sia i nomi IUPHAR che HGNC (tra parentesi), insieme ad altri nomi comunemente usati per questi canali del potassio voltaggio-dipendenti.
La notevole diversità dei canali KV può essere ottenuta grazie al mix and match delle subunità dei canali KV. All’interno di ciascuna delle famiglie KV1, KV2, KV3, KV4 e KV7, possono formarsi canali omomerici ed eteromerici con una gamma di proprietà funzionali . I membri della famiglia KV2 possono anche assemblare con i membri della famiglia KV5, KV6, KV8 o KV9 con modelli di espressione più limitati nel sistema nervoso e nella muscolatura liscia , come illustrato schematicamente in Fig. 3.

Figura 3. Diversità dei canali KV tramite mix and match di subunità dei canali che formano i pori. (A) I canali KV tetramerici con proprietà e distribuzione diverse comprendono i canali omomerici KV1, KV2, KV3, KV4 e KV7, i canali eteromerici formati da membri diversi all’interno di ciascuna di queste famiglie di canali KV e i canali eteromerici formati dall’assemblaggio di membri della famiglia KV2 con membri della famiglia KV5, KV6, KV8 o KV9 . Le famiglie KV5, KV6, KV8 e KV9 danno origine a canali omomerici che sono elettricamente silenziosi probabilmente a causa della loro ritenzione nel reticolo endoplasmatico , quindi sono indicati come KVS. (B) L’assemblaggio dei membri della famiglia KV2 e KVS coinvolge i loro domini citoplasmatici N – e C-terminali. (C, D) L’assemblaggio dei membri della famiglia KV2 e KVS dà origine a canali eteromerici con diversa dipendenza dalla tensione (C) e meccanismi di gating (D) rispetto ai canali omomerici formati dai membri della famiglia KV2 .
Le differenze funzionali nella dipendenza dalla tensione e nella cinetica dei canali KV sono alla base dei loro contributi differenziali alla modulazione del potenziale d’azione (Fig. 4). Mentre i canali KV1, KV4 e KV7 richiedono bassi livelli di depolarizzazione della membrana per la loro attivazione, i canali KV2 e KV3 sono attivati da una maggiore depolarizzazione. I primi canali KV attivati a bassa tensione possono influenzare la soglia per la generazione del potenziale d’azione e il numero di potenziali d’azione generati durante la depolarizzazione o i potenziali sinaptici eccitatori. Al contrario, i canali KV attivati ad alta tensione possono modulare la durata del potenziale d’azione e il modello di cottura . La cinetica dei canali KV influenza anche i modi in cui contribuiscono alla generazione del potenziale d’azione. Mentre i canali KV1 attivati a bassa tensione con attivazione rapida possono influenzare la soglia del potenziale d’azione e la forma d’onda, i canali KV3 attivati ad alta tensione e i canali KV2 possono essere attivati sequenzialmente durante un potenziale d’azione a causa della differenza nella loro cinetica di attivazione, e i canali KV2 possono avere effetti più duraturi a Inoltre, i canali KV4 con inattivazione rapida potrebbero contribuire alla differenza nella forma d’onda del potenziale d’azione durante la cottura ripetitiva, a causa della soppressione dell’attività del canale KV4 mediante depolarizzazione .
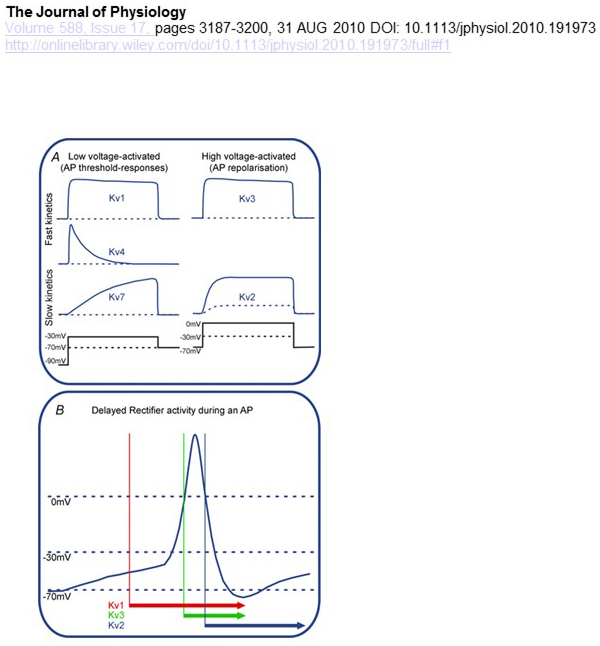
Figura 4. Differenze funzionali dei canali KV e loro contributo al potenziale d’azione. (A) I canali differenti di KV hanno dipendenza differente di tensione per l’attivazione e cinetica differente . (B) I canali KV1 attivati a bassa tensione con cinetica veloce si aprono quando la cella viene depolarizzata verso la soglia per la generazione del potenziale d’azione. Mentre sia i canali KV2 che KV3 sono attivati ad alta tensione, i canali KV3 si aprono prima dei canali KV2 durante un potenziale d’azione. I canali KV2 possono anche richiedere più tempo per chiudersi a seguito di un potenziale d’azione .
Potenziali applicazioni terapeutiche dei modulatori dei canali del potassio
La capacità dei modulatori dei canali del potassio di alterare i modelli di potenziale d’azione ha sollevato la questione se possano essere di valore terapeutico . Come indicato in Fig. 5, vari disturbi neurologici e psicologici possono comportare alterazioni nei modelli di cottura potenziale d’azione, che potrebbero essere modulati da attivatori di canali KV e bloccanti . I canali voltaggio-gated del potassio possono anche svolgere un ruolo nella proliferazione e nella migrazione delle cellule; I modulatori del canale di KV quindi sono stati considerati per i trattamenti potenziali della crescita e della metastasi del cancro . In Fig. 6, la struttura del canale KV1. 2 viene utilizzata schematicamente per illustrare che i modulatori del canale KV possono inibire l’attività del canale occludendo il percorso di permeazione del canale, come nel caso di tossine che bloccano i pori esterni e bloccanti dei pori interni, o tramite la loro interazione con il sensore di tensione per stabilizzare lo stato chiuso del canale, come nel caso In alternativa, alcune piccole molecole agiscono legandosi al meccanismo di gating come modificatori di gating, o interagendo con l’interfaccia tra le subunità α e β per alterare l’attività del canale .
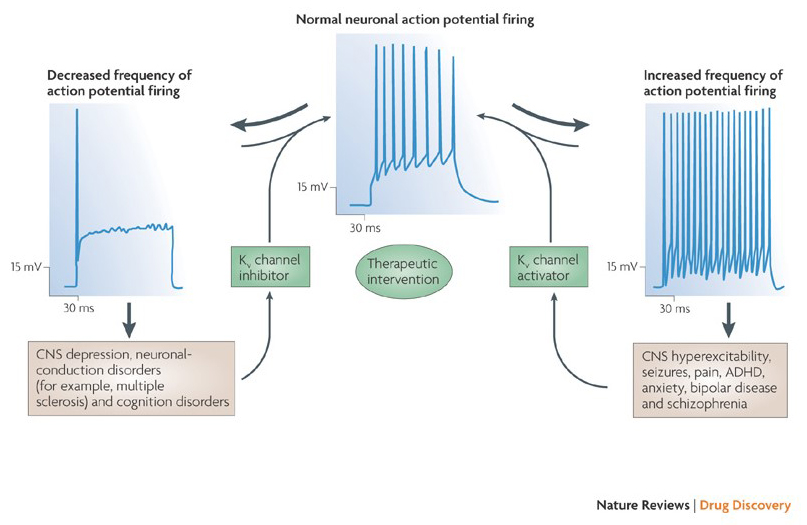
Figura 5. Potenziali applicazioni dei modulatori di canali KV. Poiché i modelli anormali di cottura di potenziale di azione sono stati associati con le malattie quali l’epilessia e la sclerosi multipla, gli attivatori e gli inibitori del canale di KV sono stati considerati per i trattamenti terapeutici potenziali delle malattie che comprendono l’alterazione di eccitabilità neuronale .
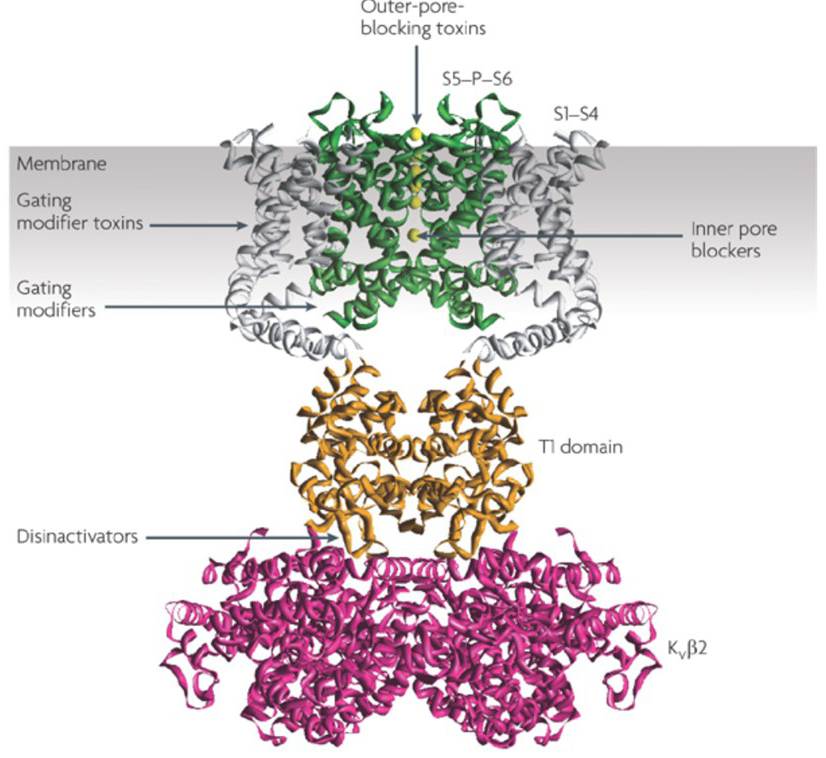
Figura 6. Esempi di modalità di azione dei modulatori di canali KV. Esistono diversi modi in cui le tossine peptidiche e le piccole molecole modulano l’attività del canale KV. La struttura KV1 .2 è mostrata con i domini dei pori (S5-P-S6) in verde, i domini dei sensori di tensione (S1-S4) in grigio, i domini di tetramerizzazione T1 in arancione e le subunità ausiliarie KVß2 in magenta. Esterno-poro-blocco tossine da scorpioni, anemoni di mare, serpenti, e cono lumache possono legarsi al vestibolo esterno e bloccare la permeazione ionica. Gating modificatore tossine da ragni come hanatoxin possono interagire con il sensore di tensione per aumentare la stabilità dello stato chiuso, causando spostamento verso destra della curva di dipendenza di tensione per l’attivazione del canale. Ci sono anche modulatori di canali di piccole molecole che si legano al poro interno (bloccanti dei pori interni), alle cerniere di gating (modificatori di gating) o all’interfaccia tra le subunità α e β (disinattivatori) .
potassio Voltaggio-dipendenti struttura di canale
Il notevole selettività dei canali del potassio, che permette di ioni K+ per passare attraverso il canale del poro con ordini di grandezza maggiore facilità rispetto a quella più piccola di ioni Na+ e vicino a diffusione limitata , è rappresentato dalla capacità della spina dorsale carbonili del filtro di selettività per coordinare ioni K+ che sono in gran parte spogliato della loro idratazione conchiglie , in modo che più di un K+ ione si sposta attraverso questo stretto segmento del poro in tandem (Fig. 7 – – un lungo poro per singolo file K + permeazione ionica come predicato .
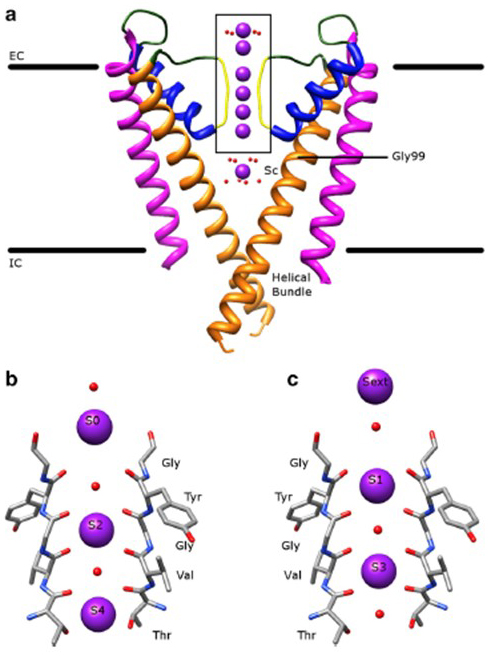
Figura 7. Il dominio dei pori dei canali del potassio. (a) Struttura di KcsA nello stato conduttivo (PDB: 1K4C), con le eliche esterne in magenta, le eliche interne in arancione, le eliche dei pori in blu e il filtro di selettività in giallo. Gli ioni K + sono in viola mentre le molecole d’acqua circostanti sono in rosso. EC: extracellulare; IC: intracellulare. (b, c) Il filtro di selettività nella regione in scatola della struttura KcsA è mostrato con ioni K+ che occupano le posizioni S2 e S4 (b) o le posizioni S1 e S3 (c), per illustrare la permeazione di ioni K+ in un singolo file .
La dipendenza di tensione dell’attivazione del canale KV deriva dai loro domini di sensori di tensione . Come mostrato in Fig. 8, Canali di KV e canali relativi quali i canali del sodio tensione-gated ed i canali TRPV1 nella stessa superfamiglia hanno simili disposizioni dei loro domini del poro ed i domini del sensore di tensione. Il dominio del sensore di tensione di una subunità interagisce con il dominio dei pori di una subunità vicina in una configurazione di scambio di dominio, e all’interno di un sensore di tensione i residui di arginina caricati positivamente su S4 possono interagire con residui acidi caricati negativamente nelle eliche vicine (Fig. 9).
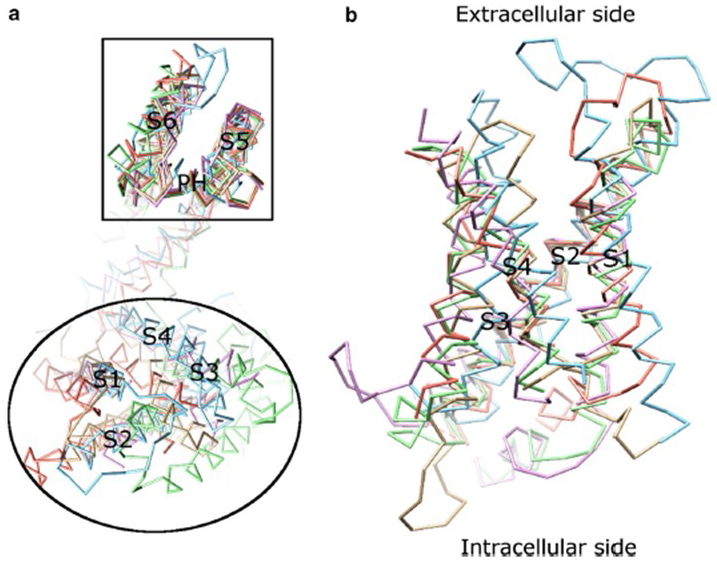
Figura 8. Il dominio del sensore di tensione dei canali del potassio voltaggio-gated. (a) L’allineamento del dominio dei pori (S5-P-S6) di diversi canali ionici rivela che i loro domini dei sensori di tensione (S1-S4) possono assumere una varietà di orientamenti (visti dal lato extracellulare). (b) Sovrapposizione del dominio del sensore di tensione di KV1.2 (PDB: 3LUT, magenta chiaro) con i domini del sensore di tensione di MlotiK1 (PDB: 3BEH, marrone chiaro) , NaVAb (PDB: 3RVY, verde chiaro) , NaVRh (PDB: 4DXW, arancione chiaro) e TRPV1 (PDB: 3J5P, azzurro) (visto dalla membrana) .
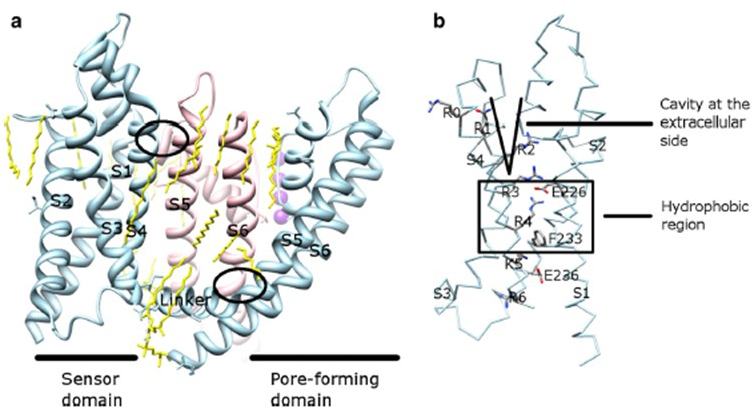
Figura 9. Contatti tra il dominio dei pori e il dominio del sensore di tensione dei canali KV. (a) La chimera KV1.2-KV2.1 (PDB: 2R9R) con il dominio del sensore di tensione di una subunità (blu chiaro) che contatta il dominio dei pori di una subunità vicina (rosa). I contatti sul lato intracellulare coinvolgono l’interazione del linker S4-S5 con S6 e i contatti sul lato extracellulare coinvolgono l’interazione tra S1 e l’elica dei pori . I lipidi (gialli) che circondano il canale e tra il dominio dei pori e il dominio del sensore di tensione sono rilevabili nella struttura cristallina. b) Residui basici di S4 e residui acidi nelle loro vicinanze nel dominio del sensore di tensione .
Le canalopatie legate ai canali del potassio voltaggio-dipendenti
I canali del potassio voltaggio-dipendenti sono ampiamente espressi in una varietà di tessuti. Nei neuroni, sono mirati a vari compartimenti subcellulari (Fig. 10), e canali di diverse composizioni di subunità possono essere presenti in diverse sottopopolazioni di neuroni . Le mutazioni dei geni del canale KV possono causare malattie neurologiche come atassia episodica ed epilessie, malattie cardiache e sordità . La conservazione evolutiva della funzione del canale KV è evidente, ad esempio, dai disturbi del movimento simili causati dalla mutazione degli ortologi KV1 nell’uomo, nel topo e nella mosca della frutta .
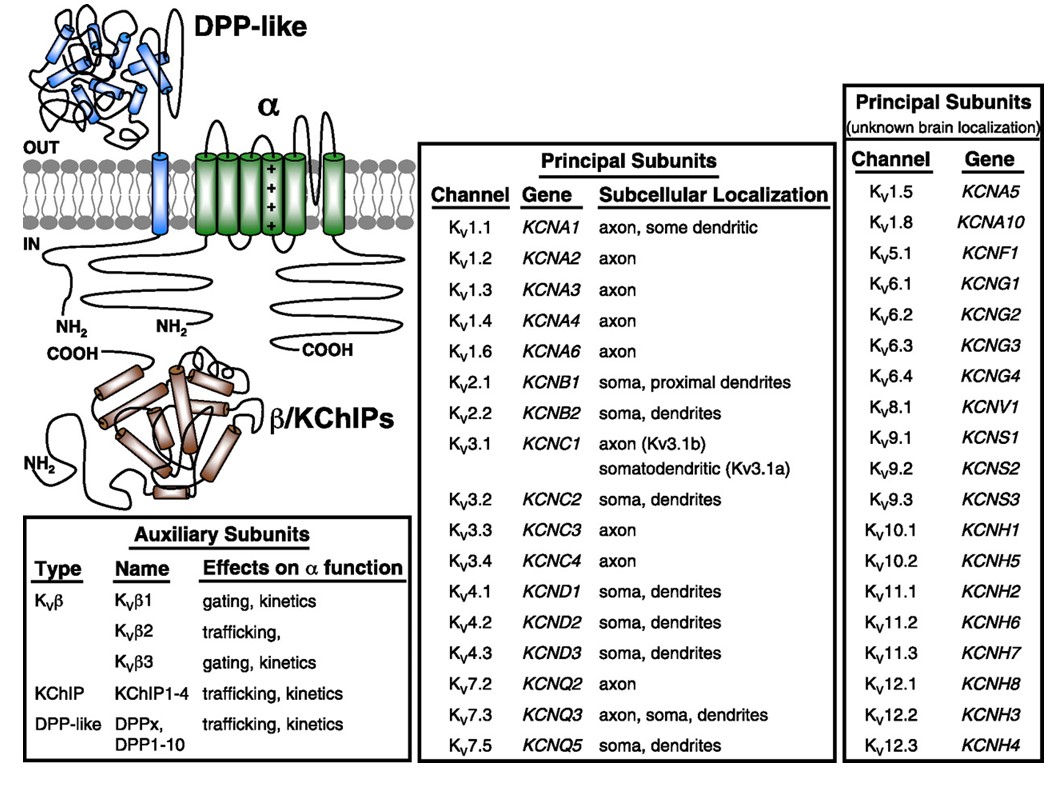
Figura 10. Distribuzione subcellulare dei canali del potassio voltaggio-dipendenti. Lo schema in alto a sinistra raffigura un canale KV4 con due diverse subunità ausiliarie. La localizzazione subcellulare di vari canali KV nei neuroni centrali dei mammiferi è indicata nella casella centrale .
Riferimenti e note
1.Hille, B., Canali ionici di membrane eccitabili, 3rd, Ed. 2001: Sinauer Associates Inc.
2.Gonzalez, C., et al., K ( + ) canali: funzione-panoramica strutturale. Compr Physiol, 2012. 2(3): p. 2087-149.
3.Vacher, H., D. P. Mohapatra, e J. S. Trimmer, Localizzazione e targeting dei canali ionici voltaggio-dipendenti nei neuroni centrali dei mammiferi. Physiol Rev, 2008. 88(4): p. 1407-47.
4.Il suo nome è J, Evoluzione del canale ionico umano. Comb Chem High Throughput Screen, 2009. 12(1): pag. 2-23.
5.Cang, C., et al., TMEM175 è un canale di Organello K (+) che regola la funzione lisosomiale. Cellulare, 2015. 162(5): p. 1101-12.
6.Hodgkin, A. L. e A. F. Huxley, Correnti trasportate da ioni sodio e potassio attraverso la membrana dell’assone gigante di Loligo. J Physiol, 1952. 116(4): p. 449-72.
7.Rosenthal, J. J., T. I. Liu, e W. F. Gilly, Una famiglia di CDNA KV1 raddrizzatore ritardato che mostra espressione specifica del tipo di cella nel complesso squid stellate ganglion / giant fiber lobe. J Neurosci, 1997. 17(13): p. 5070-9.
8.Young, J. Z., neuroni fusi e contatti sinaptici nelle fibre nervose giganti dei cefalopodi. Phil Trans R Soc Lond B, 1939. 229: p. 465-503.
9.Rosenthal, JJ e F. Bezanilla, Ampio editing di mRNA per il calamaro raddrizzatore ritardato K + canale regola tetramerizzazione subunità. Neuron, 2002. 34(5): p. 743-57.
10.Jan, L. Y. e Y. N. Jan, canali di potassio voltaggio-gated e la diversità di segnalazione elettrica. J Physiol, 2012. 590(11): p. 2591-9.
11.Johnston, J., ID Forsythe e C. Kopp-Scheinpflug, Going native: canali del potassio voltaggio-dipendenti che controllano l’eccitabilità neuronale. J Physiol, 2010. 588 (Pt 17): pag. 3187-200.
12.Bocksteins, E., KV5, KV6, KV8 e KV9 subunità: nessun semplice spettatore silenzioso. J Gen Physiol, 2016. 147(2): p. 105-25.
13.Wulff, H., N. A. Castle, e L. A. Pardo, canali del potassio voltaggio-gated come bersagli terapeutici. Nat Rev Drug Discov, 2009. 8(12): p. 982-1001.
14.Bates, E., Canali ionici in sviluppo e cancro. Annu Rev Cell Dev Biol, 2015. 31: pag. 231-47.
15.Huang, X. e L. Y. Jan, prendendo di mira i canali del potassio nel cancro. J Cell Biol, 2014. 206(2): p. 151-62.
16.Huang, X., et al., Canale di potassio EAG2 con evolutivamente conservato la funzione come bersaglio di tumore cerebrale. Nat Neurosci, 2015. 18(9): p. 1236-46.
17.Kunzelmann, K., canali ionici e cancro. J Membr Biol, 2005. 205(3): p. 159-73.
18.Li, M. e ZG Xiong, canali ionici come bersagli per la terapia del cancro. Int J Physiol Pathophysiol Pharmacol, 2011. 3(2): p. 156-66.
19.Pardo, Los Angeles., Canali di potassio voltaggio-dipendenti nella proliferazione cellulare. Physiology (Bethesda), 2004. 19: p. 285-92.
20.Urrego, D., et al., Canali di potassio nel ciclo cellulare e proliferazione cellulare. Philos Trans R Soc Lond B Biol Sci, 2014. 369 (1638): p. 20130094.
21.Zhou, Y., et al., Chimica della coordinazione ionica e idratazione rivelata da un complesso K + channel-Fab a risoluzione 2.0 A. Natura, 2001. 414 (6859): p. 43-8.
22.MacKinnon, R., canali del potassio. FEBS Lett, 2003. 555(1): p. 62-5.
23.Kuang, Q., P. Purhonen e H. Hebert, Struttura dei canali del potassio. Cell Mol Life Sci, 2015. 72(19): p. 3677-93.
24.Isacoff, EY, LY Jan e DL Minor, Jr., Condotti della scintilla della vita: una prospettiva sulla ricerca dei canali ionici dalla nascita del neurone. Neuron, 2013. 80(3): p. 658-74.
25.Swartz, KJ, Rilevamento della tensione attraverso le membrane lipidiche. Natura, 2008. 456 (7224): p. 891-7.
26.Nusser, Z., Distribuzione subcellulare differenziale dei canali ionici e la diversità della funzione neuronale. Curr Opin Neurobiol, 2012. 22(3): p. 366-71.
27.Lujan, R., Organizzazione dei canali del potassio sulla superficie neuronale. J Chem Neuroanat, 2010. 40(1): pag. 1-20.
28.Abriel, S. E. V. Zaklyazminskaya, Canalopatie cardiache: meccanismi genetici e molecolari. Gene, 2013. 517(1): pag. 1-11.
29.Kullmann, D. M. e M. G. Hanna, Disturbi neurologici causati da mutazioni ereditarie dei canali ionici. Lancet Neurol, 2002. 1(3): p. 157-66.
30.Lehmann-Horn, F. e K. Jurkat-Rott, canali ionici voltaggio-dipendenti e malattia ereditaria. Physiol Rev, 1999. 79(4): p. 1317-72.
31.Villa, C. e R. Combi, canali del potassio e fenotipi epilettici umani: una panoramica aggiornata. Front Cell Neurosci, 2016. 10: pag. 81.
32.Long, S. B., E. B. Campbell, e R. Mackinnon, struttura cristallina di un mammifero tensione-dipendente Shaker famiglia K + canale. Scienza, 2005. 309(5736): p. 897-903.
33.Chen, X., et al., Struttura del canale KV1.2 del potassio dell’agitatore di lunghezza completa da raffinamento cristallografico basato a raggi X di modo normale. Proc Natl Acad Sci U S A, 2010. 107(25): p. 11352-7.
34.Clayton, G. M., et al., Struttura delle regioni transmembrana di un canale regolato da nucleotidi ciclici batterici. Proc Natl Acad Sci U S A, 2008. 105(5): p. 1511-5.
35.Il suo nome deriva dal latino., La struttura cristallina di un canale di sodio voltaggio-gated. Natura, 2011. 475(7356): p. 353-8.
36.Zhang, X., et al., Struttura cristallina di un ortologo del canale del sodio voltaggio-gated NaChBac. Natura, 2012. 486 (7401): p. 130-4.
37.Liao, M., et al., Struttura del canale ionico TRPV1 determinata dalla criomicroscopia elettronica. Natura, 2013. 504 (7478): p. 107-12.
38.Long, S. B., et al., Struttura atomica di un canale K+ voltaggio-dipendente in un ambiente simile alla membrana lipidica. Natura, 2007. 450(7168): p. 376-82.