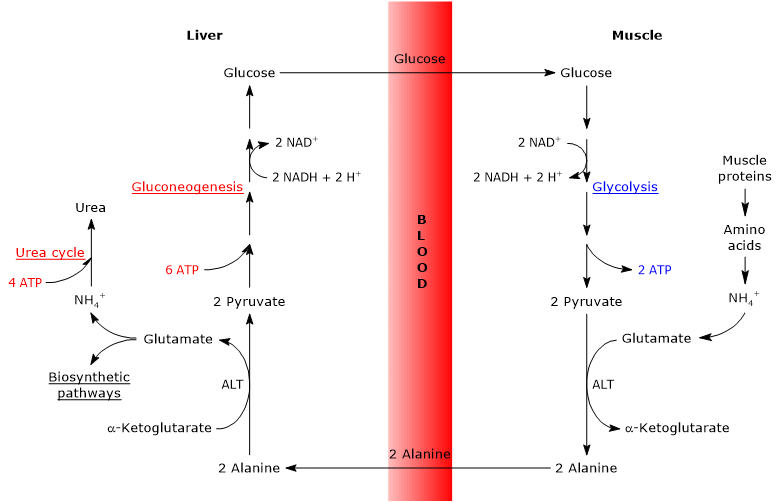
Il ciclo glucosio-alanina, o ciclo di Cahill, proposto per la prima volta da Mallette, Exton e Park e Felig et al. tra il 1969 e il 1970, consiste in una serie di passaggi attraverso i quali i tessuti extraepatici, ad esempio il muscolo scheletrico, esportano piruvato e gruppi amminici come alanina nel fegato e ricevono glucosio dal fegato attraverso il flusso sanguigno.
Le fasi principali del ciclo glucosio-alanina sono riassunte di seguito.
- Quando nei tessuti extraepatici gli amminoacidi vengono utilizzati per l’energia, il piruvato, derivato dalla glicolisi, viene utilizzato come accettore di gruppo amminico, formando alanina, un amminoacido non essenziale.
- L’alanina si diffonde nel flusso sanguigno e raggiunge il fegato.
- Nel fegato, il gruppo amminico di alanina viene trasferito ad α-chetoglutarato per formare rispettivamente piruvato e glutammato.
- Il gruppo amminico del glutammato entra principalmente nel ciclo dell’urea e in parte agisce come donatore di azoto in molte vie biosintetiche.
Il piruvato entra nella gluconeogenesi e viene utilizzato per la sintesi del glucosio. - Il glucosio appena formato si diffonde nel flusso sanguigno e raggiunge i tessuti periferici dove, a causa della glicolisi, viene convertito in piruvato che può accettare gruppi amminici dagli amminoacidi liberi, chiudendo così il ciclo.
Pertanto, il ciclo glucosio-alanina fornisce un collegamento tra il metabolismo dei carboidrati e degli amminoacidi, come descritto schematicamente di seguito.
Glucosio → Piruvato → Alanina → Piruvato → Glucosio
glucosio-alanina ciclo che si verifica non solo tra il muscolo scheletrico, il primo tessuto in cui è stato osservato, e il fegato, ma coinvolge altre cellule e tessuti extraepatici, comprese le cellule del sistema immunitario, quali organi linfoidi.
CONTENUTO
- La procedura di glucosio-alanina ciclo
- Il Cahill ciclo nel muscolo scheletrico
- Il Cahill ciclo nel fegato
- Transaminasi
- Funzioni di glucosio-alanina ciclo
- costo di Energia di glucosio-alanina ciclo
- Somiglianze e le differenze tra Cahill ciclo e ciclo di Cori
La procedura di glucosio-alanina ciclo
L’analisi dei passaggi della glucosio-alanina ciclo è fatta considerando il ciclo tra il muscolo scheletrico e il fegato.
Sia le proteine intracellulari che extracellulari vengono continuamente idrolizzate negli amminoacidi costituenti e risintetizzate, e la velocità con cui si verificano questi processi è bilanciata con precisione, prevenendo così la perdita di massa priva di grassi.
Tuttavia, in condizioni cataboliche, come esercizio fisico intenso e prolungato o digiuno, il tasso di disgregazione proteica muscolare supera la sintesi. Ciò porta alla liberazione di aminoacidi, alcuni dei quali sono utilizzati per l’energia e altri per la gluconeogenesi. E l’ossidazione degli scheletri di carbonio degli amminoacidi, in particolare aminoacidi a catena ramificata o BCAA (leucina, isoleucina e valina), può essere una fonte significativa di energia per il muscolo. Ad esempio, dopo circa 90 minuti di intenso esercizio fisico, l’ossidazione degli aminoacidi nel muscolo fornisce il 10-15% dell’energia necessaria per la contrazione.
L’utilizzo degli scheletri di carbonio degli amminoacidi per l’energia comporta la rimozione del gruppo amminico e quindi l’escrezione di azoto amminico in una forma non tossica.
La rimozione del gruppo α-amminico avviene per transaminazione, che può essere riassunta come segue:
α-chetoacido + amminoacido New Nuovo amminoacido + Nuovo α-chetoacido
Tali reazioni, catalizzate da enzimi chiamati aminotransferasi o transaminasi (EC 2.6.1) sono liberamente reversibili.
Gli amminoacidi a catena ramificata, ad esempio, trasferiscono il gruppo amminico all’acido α-chetoglutarato o all’acido 2-ossoglutarico, per formare il glutammato e l’acido α-cheto derivato dall’amminoacido originale, in una reazione catalizzata dall’aminotransferasi a catena ramificata o BCAT (EC 2.6 .1.42).
Il ciclo di Cahill nel muscolo scheletrico
Nel muscolo scheletrico, il glutammato di nuova formazione può reagire con ammoniaca per formare glutammina, per molti tessuti e organi, come il cervello, il principale veicolo per il trasporto interorgano di azoto. La reazione è catalizzata dall’enzima citosolico glutammina sintetasi (EC 6.3.1.2) e consuma un ATP.
Glutammato + NH4+ + ATP → Glutammina + ADP + Pi
In questo caso, il glutammato lascia il ciclo di Cahill.
In alternativa, e in contrasto con ciò che accade nella maggior parte degli altri tessuti, il glutammato appena formato può trasferire il gruppo amminico al piruvato, derivato dalla glicolisi, per formare alanina e α-chetoglutarato. Questa transaminazione è catalizzata dall’alanina aminotransferasi o ALT (EC 2.6.1.2), un enzima presente nella maggior parte dei tessuti animali e vegetali.
Glutammato + piruvato ⇄ Alanina + α-Chetoglutarato
L’alanina prodotta e derivata direttamente dalla disgregazione proteica, e le proteine muscolari ricche di alanina, possono lasciare la cellula ed essere trasportate dal flusso sanguigno al fegato; in questo modo il gruppo amminico raggiunge il fegato. E la velocità con cui l’alanina formata dalla transaminazione del piruvato viene trasferita nella circolazione è proporzionale alla produzione di piruvato intracellulare.
Nota: alanina e glutammina sono le principali fonti di azoto e carbonio nel metabolismo degli aminoacidi interorgani.
Il ciclo di Cahill nel fegato
Una volta nel fegato, un’alanina aminotransferasi epatica catalizza una transaminazione in cui l’alanina, il principale amminoacido gluconeogenico, agisce come donatore di gruppo amminico e α-chetoglutarato come accettore di acido α-cheto. I prodotti della reazione sono il piruvato, cioè lo scheletro di carbonio dell’alanina e il glutammato.
Alanina + α-chetoglutarato Glut glutammato + piruvato
Glutammato, nella reazione catalizzata dalla glutammato deidrogenasi (EC 1.4.1 .2), un enzima presente nella matrice mitocondriale, forma lo ammonium ammonio, che entra nel ciclo dell’urea e l’α-chetoglutarato, che può entrare nel ciclo di Krebs. Questa reazione è una reazione anaplerotica che collega il metabolismo degli aminoacidi con il ciclo di Krebs.
Glutammato + H2O + NAD+ α α-chetoglutarato + NH4+ + NADH + H+
Tuttavia, il glutammato può anche reagire con ossaloacetato per formare aspartato e α-chetoglutarato, in una reazione catalizzata dall’aspartato aminotransferasi (EC 2.6.1.1). L’aspartato è coinvolto nella formazione di urea e nella sintesi di purine e pirimidine.
Glutammato + ossaloacetato As Aspartato + α-Chetoglutarato
Anche il piruvato prodotto può avere diversi destini metabolici: può essere ossidato per la produzione di ATP, e quindi lasciare il ciclo glucosio-alanina, o entrare nella via della gluconeogenesi, e quindi continuare nel ciclo.
Il glucosio prodotto viene rilasciato dal fegato nel flusso sanguigno e consegnato a vari tessuti che lo richiedono, come il muscolo scheletrico, in cui viene utilizzato per la sintesi del piruvato. A sua volta, il piruvato appena formato può reagire con il glutammato, chiudendo così il ciclo.
Transaminasi
Come accennato in precedenza, la rimozione del gruppo amminico dagli amminoacidi avviene attraverso la transaminazione (vedi sopra per la reazione generale). Queste reazioni sono catalizzate da enzimi chiamati aminotransferasi o transaminasi.
Sono enzimi citosolici, presenti in tutte le cellule e particolarmente abbondanti nel fegato, rene, intestino e muscolo; richiedono fosfato piridossale o PLP, la forma attiva della vitamina B6 o piridossina, come coenzima, che è strettamente legato al sito attivo.
Nelle reazioni di transaminazione, il gruppo amminico degli amminoacidi liberi, ad eccezione della treonina e della lisina, viene incanalato verso un piccolo numero di α-chetoacidi, in particolare piruvato, ossaloacetato e α-chetoglutarato.
Le cellule contengono diversi tipi di aminotransferasi: molte sono specifiche per α-chetoglutarato come α-chetoacido accettore, ma differiscono in specificità per l’amminoacido, da cui prendono il nome. Esempi sono la suddetta alanina aminotransferasi, chiamata anche alanina transaminasi e glutammico piruvico transferasi o GPT, e aspartato aminotransferasi o AST, chiamata anche transaminasi glutammico-ossaloacetica o GOT.
Va sottolineato che non vi è alcuna deaminazione netta in queste reazioni, nessuna perdita di gruppi amminici, poiché l’amminoacido α-cheto accettore è amminato e l’amminoacido deaminato.
Funzioni del ciclo glucosio-alanina
Questo ciclo ha varie funzioni.
- Trasporta l’azoto in forma atossica dai tessuti periferici al fegato.
- Trasporta il piruvato, un substrato gluconeogenico, nel fegato.
- Rimuove il piruvato dai tessuti periferici. Ciò porta ad una maggiore produzione di ATP dal glucosio in questi tessuti. Infatti, il NADH prodotto durante la glicolisi può entrare nei mitocondri ed essere ossidato attraverso la fosforilazione ossidativa.
- Consente di mantenere una concentrazione relativamente elevata di alanina negli epatociti, sufficiente a inibire la degradazione delle proteine.
- Può svolgere un ruolo nella difesa dell’ospite contro le malattie infettive.
Infine, è importante sottolineare che non esiste una sintesi netta di glucosio nel ciclo glucosio-alanina.
Costo energetico del ciclo glucosio-alanina
Come il ciclo Cori, anche il ciclo glucosio-alanina ha un costo energetico, pari a 3-5 ATP.
La parte del ciclo che si svolge nei tessuti periferici comporta la produzione di 5-7 ATP per molecola di glucosio:
- 2 Gli ATP sono prodotti dalla glicolisi;
- 3-5 ATP derivano da NADH / FADH2 (vedi sotto).
Invece nel fegato, la gluconeogenesi e il ciclo dell’urea costano 10 ATP:
- 6 ATP sono consumati nel durante gluconeogenesi per molecola di glucosio sintetizzato;
- 4 ATP sono consumati nel ciclo dell’urea per molecola di urea sintetizzata.
Il ciclo glucosio-alanina, come il ciclo Cori, sposta parte del carico metabolico dai tessuti extraepatici al fegato. Tuttavia, il costo dell’energia pagato dal fegato è giustificato dai vantaggi che il ciclo si porta a tutto il corpo, in quanto consente, in particolari condizioni, un efficiente ripartizione delle proteine nei tessuti extraepatici (in particolare del muscolo scheletrico), che a sua volta permette di ottenere gluconeogenic substrati, come pure l’uso di aminoacidi per l’energia nei tessuti extraepatici.
Somiglianze e differenze tra il ciclo di Cahill e il ciclo di Cori
Ci sono alcune analogie tra i due cicli, che sono elencati di seguito.
- Il ciclo di Cahill si sovrappone parzialmente al ciclo di Cori quando il piruvato viene convertito in glucosio e il monosaccaride viene trasportato nei tessuti extraepatici, nei quali viene nuovamente convertito in piruvato attraverso la via glicolitica.
- L’ingresso nella via della gluconeogenesi è simile per i due cicli: sia l’alanina che il lattato vengono convertiti in piruvato.
- Come i Cori ciclo glucosio-alanina ciclo che si verifica tra i diversi tipi di cellule, a differenza di vie metaboliche come la glicolisi, ciclo di Krebs o gluconeogenesi che si verificano all’interno di singole celle
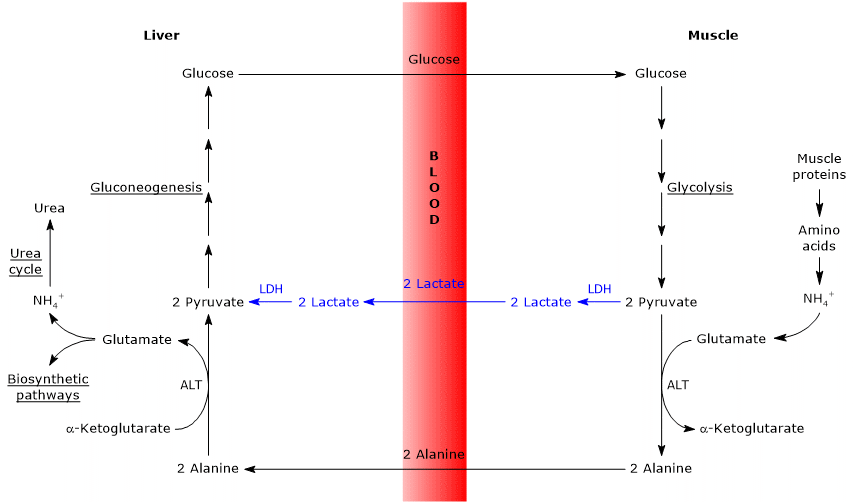
di Seguito, alcune differenze tra i due cicli.
- La differenza principale riguarda i tre intermedi di carbonio che dai tessuti periferici raggiungono il fegato: lattato nel ciclo Cori e alanina nel ciclo glucosio-alanina.
- Un’altra differenza riguarda il destino del NADH prodotto dalla glicolisi nei tessuti periferici.
Nel ciclo Cori, il coenzima agisce come agente riducente per ridurre il piruvato a lattato, nella reazione catalizzata dalla lattato deidrogenasi (EC 1.1.1.27).
Nel ciclo glucosio-alanina, questa riduzione non si verifica e gli elettroni del NADH possono essere trasportati nei mitocondri attraverso le navette malato-aspartato e glicerolo 3-fosfato, generando NADH, la prima navetta, e FADH2, l’altra navetta. E la resa di ATP da NADH e FADH2 è 2,5 e 1,5, rispettivamente. - Infine, dal punto precedente, è chiaro che, a differenza del ciclo Cori, il ciclo di Cahill richiede la presenza di ossigeno e mitocondri nei tessuti periferici.
Berg JM, Tymoczko JL, e Stryer L. Biochimica. 5a edizione. W. H. Freeman and Company, 2002
Felig P., Pozefsk T., Marlis E., Cahill G. F. Alanine: ruolo chiave nella gluconeogenesi. Scienza 1970;167(3920):1003-4. doi: 10.1126 / scienza.167.3920.1003
Gropper S. S., Smith J. L., Groff J. L. Nutrizione avanzata e metabolismo umano. Cengage Learning, 2009
Lecker S. H., Goldberg A. L. e Mitch W. E. Degradazione delle proteine mediante la via ubiquitina–proteasoma negli stati normali e patologici. J Am Soc Nephrol 2006;17 (7): 1807-19. doi:10.1681 / ASN.2006010083
Mallette L. E., Exton J. H. e Park CR Controllo della gluconeogenesi da aminoacidi nel fegato di ratto perfuso. J Biol Chem 1969;244 (20): 5713-23.
Nelson D. L., Cox M. M. Lehninger. Principi di biochimica. 6a edizione. Il sito utilizza cookie tecnici e cookie di profilazione di terze parti. Biochimica medica illustrata. Jaypee Brothers Publishers, 2005
Wu G. Aminoacidi: biochimica e nutrizione. CRC Stampa, 2013