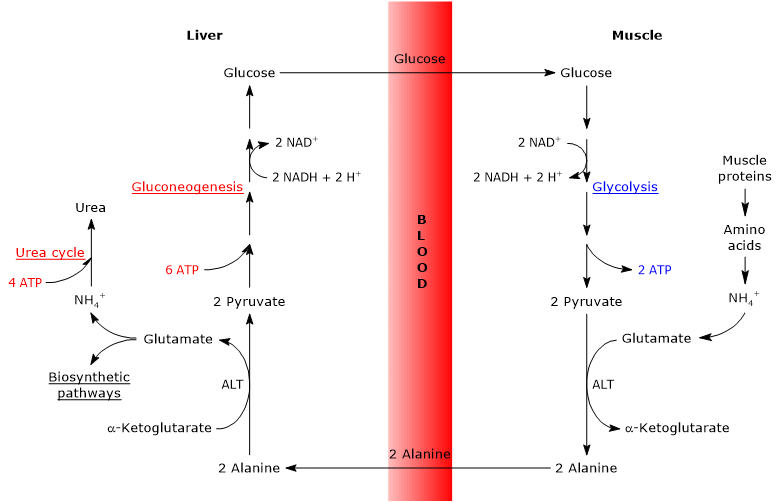
glucose-alanin cyklus, eller Cahill cyklus, foreslået for første gang af Mallette, Ekston og Park, og Felig et al. mellem 1969 og 1970 består af en række trin, hvorigennem ekstrahepatiske væv, for eksempel skeletmuskulaturen, eksporterer pyruvat-og aminogrupper som alanin til leveren og modtager glukose fra leveren via blodbanen.
de vigtigste trin i glucose-alanincyklussen er opsummeret nedenfor.
- når der i ekstrahepatiske væv anvendes aminosyrer til energi, anvendes pyruvat, afledt af glycolyse, som aminogruppeacceptor, der danner alanin, en ikke-essentiel aminosyre.
- alanin diffunderer ind i blodbanen og når leveren.
- i leveren overføres aminogruppen af alanin til henholdsvis Kurt-ketoglutarat til dannelse af pyruvat og glutamat.
- aminogruppen af glutamat går for det meste ind i urinstofcyklussen og fungerer delvist som en nitrogendonor i mange biosyntetiske veje.
pyruvat går ind i glukoneogenese og bruges til glucosesyntese. - den nydannede glukose diffunderer ind i blodbanen og når de perifere væv, hvor der på grund af glykolyse omdannes til pyruvat, der kan acceptere aminogrupper fra de frie aminosyrer og dermed lukke cyklussen.
derfor giver glucose-alanincyklussen en forbindelse mellem kulhydrat og aminosyremetabolisme som skematisk beskrevet nedenfor.
Glucoseprirus pyruvat
glucose-alanincyklussen forekommer ikke kun mellem skeletmuskulaturen, det første væv, hvori det blev observeret, og leveren, men involverer andre celler og ekstrahepatiske væv, herunder celler i immunsystemet, såsom lymfoide organer.
indhold
- trinene i glucose-alanincyklussen
- Cahill-cyklussen i skeletmuskulatur
- Cahill-cyklussen i leveren
- transaminaser
- funktioner af glucose-alanincyklussen
- energikostnader for glucose-alanincyklussen
- ligheder og forskelle mellem Cahill-cyklus og Cori-cyklus
trinene i glucose-alanincyklussen
analysen af trinene i glucose-alanincyklussen foretages i betragtning af cyklussen mellem skeletmuskulatur og lever.
både intracellulære og ekstracellulære proteiner hydrolyseres kontinuerligt til de bestanddele aminosyrer og resyntetiseres, og den hastighed, hvormed disse processer forekommer, afbalanceres nøjagtigt og forhindrer derved tab af fedtfri masse.
under kataboliske forhold, såsom intens og langvarig træning eller faste, overstiger hastigheden af nedbrydning af muskelprotein syntese. Dette fører til frigivelse af aminosyrer, hvoraf nogle bruges til energi og andre til glukoneogenese. En væsentlig energikilde for musklen kan være iltning af carbon skeletter af aminosyrer, især forgrenede aminosyrer eller BCAA (leucin, isoleucin og valin). 90 minutters anstrengende træning giver aminosyreoksidering i muskler 10-15% af den energi, der er nødvendig til sammentrækning.
udnyttelsen af carbonskeletterne af aminosyrer til energi indebærer fjernelse af aminogruppen og derefter udskillelsen af aminokrogen i en ikke-toksisk form.
fjernelsen af gruppen af L-aminoer sker ved transaminering, som kan opsummeres som følger:
l-Keto-syre + aminosyre L-ny aminosyre + ny L-keto-syre
sådanne reaktioner, katalyseret af aminotransferaser eller transaminaser (EC 2.6.1) Er frit reversible.
forgrenede aminosyrer overfører f .eks. aminogruppen til Kurt-ketoglutarat eller 2-oksoglutarsyre til dannelse af glutamat og Kurt-keto-syren afledt af den oprindelige aminosyre i en reaktion katalyseret af forgrenet aminotransferase eller BCAT (EC 2.6.1.42).
Cahill-cyklussen i skeletmuskulatur
i skeletmuskulatur kan det nydannede glutamat reagere med ammoniak til dannelse af glutamin for mange væv og organer, såsom hjernen, det største middel til interorgan transport af nitrogen. Reaktionen katalyseres af den cytosoliske glutaminsyntetase (EC 6.3.1.2) og forbruger en ATP.
glutamat + NH4+ + ATP-Kurt Glutamin + ADP + Pi
i dette tilfælde forlader glutamat Cahill-cyklussen.
alternativt, og i modsætning til hvad der sker i de fleste af de andre væv, kan det nydannede glutamat overføre aminogruppen til pyruvat, afledt af glykolyse, til dannelse af alanin og Purpur-ketoglutarat. Denne transaminering katalyseres af alaninaminotransferase eller ALAT (EC 2.6.1.2), som findes i de fleste dyre-og plantevæv.
glutamat + pyruvat-Kurr alanin + kurr-ketoglutarat
den producerede alanin og den, der stammer direkte fra proteinnedbrydning, og muskelproteiner er rige på alanin, kan forlade cellen og bæres af blodbanen til leveren; på denne måde når aminogruppen leveren. Og den hastighed, hvormed alanin dannet ved transaminering af pyruvat overføres til cirkulationen, er proportional med den intracellulære pyruvatproduktion.
Bemærk: alanin og glutamin er de vigtigste kilder til nitrogen og kulstof i interorgan aminosyre metabolisme.
Cahill-cyklussen i leveren
en gang i leveren katalyserer en leveralaninaminotransferase en transaminering, hvor alanin, den største glukoneogene aminosyre, fungerer som en aminogruppedonor og karret-ketoglutarat som en karret-keto-syreacceptor. Produkterne fra reaktionen er pyruvat, dvs. carbonskeletet af alanin og glutamat.
alanin + Kurt-ketoglutarat Kurt glutamat + pyruvat
glutamat, i reaktionen katalyseret af glutamatdehydrogenase (EC 1.4.1.2), der er til stede i mitokondriematricen, danner ammoniumion, der kommer ind i urinstofcyklussen, og kurshetoglutarat, som kan komme ind i Krebs-cyklussen. Denne reaktion er en anaplerotisk reaktion, der forbinder aminosyremetabolisme med Krebs-cyklussen.
glutamat + H2O + nad+ Kurt-ketoglutarat + NH4+ + NADH + h+
glutamat kan imidlertid også reagere med oksaloacetat til dannelse af aspartat og Kurt-ketoglutarat i en reaktion katalyseret af aspartataminotransferase (EC 2.6.1.1). Aspartat er involveret i dannelsen af urinstof såvel som i syntesen af puriner og pyrimidiner.
glutamat + Oksaloacetat-kurs aspartat + kurs-ketoglutarat
også det producerede pyruvat kan have forskellige metaboliske skæbner: det kan iltes til ATP-produktion og derefter forlade glucose-alanin-cyklussen eller gå ind i glukoneogenesevejen og således fortsætte i cyklussen.
den producerede glukose frigives fra leveren ind i blodbanen og leveres til forskellige væv, der kræver det, som skeletmuskulaturen, hvor den anvendes til pyruvatsyntese. Til gengæld kan det nydannede pyruvat reagere med glutamat og dermed lukke cyklussen.
transaminaser
som tidligere nævnt sker fjernelsen af aminogruppen fra aminosyrer gennem transaminering (se ovenfor for den generelle reaktion). Disse reaktioner katalyseres af aminotransferaser eller transaminaser.
de er cytosoliske stoffer, der er til stede i alle celler og især rigelige i lever, nyre, tarm og muskel; de kræver pyridoksal fosfat eller PLP, den aktive form af vitamin B6 eller pyridoksin, som et coensym, der er tæt bundet til det aktive sted.
i transamineringsreaktioner kanaliseres aminogruppen af frie aminosyrer, undtagen af threonin og lysin, mod et lille antal af purpura-ketosyrer, især pyruvat, oksaloacetat og purpura-ketoglutarat.
celler indeholder forskellige typer aminotransferaser: mange er specifikke for kurs-ketoglutarat Som kurs-keto-syreacceptor, men adskiller sig i specificitet for aminosyren, hvorfra de er navngivet. En af de mest almindelige årsager til denne sygdom er, at en person er i stand til at bestemme, om han eller hun er i stand til at tage sin medicin, eller om han eller hun er i stand til at tage medicin.
det skal understreges, at der ikke er nogen nettodeaminering i disse reaktioner, intet tab af aminogrupper, da Kurt-keto-syreacceptoren amineres og aminosyren deamineres.
funktioner af glucose-alanincyklussen
denne cyklus har forskellige funktioner.
- det transporterer nitrogen i en ikke-toksisk form fra perifere væv til leveren.
- det transporterer pyruvat, et glukoneogent substrat, til leveren.
- det fjerner pyruvat fra perifere væv. Dette fører til en højere produktion af ATP fra glukose i disse væv. Faktisk kan NADH, der produceres under glykolyse, komme ind i mitokondrierne og iltes gennem oksidativ phosphorylering.
- det tillader at opretholde en relativt høj koncentration af alanin i hepatocytter, der er tilstrækkelig til at hæmme proteinnedbrydning.
- det kan spille en rolle i værtsforsvar mod infektionssygdomme.
endelig er det vigtigt at understrege, at der ikke er nogen nettosyntese af glukose i glucose-alanincyklussen.
energikostnaden for glucose-alanincyklussen
ligesom Cori-cyklussen har glucose-alanincyklussen også en energikostnad svarende til 3-5 ATP.
den del af cyklussen, der finder sted i perifere væv, involverer produktion af 5-7 ATP pr. molekyle glucose:
- 2 ATP produceres ved glykolyse;
- 3-5 ATP stammer fra NADH/FADH2 (se nedenfor).
i stedet for i leveren koster glukoneogenese og urinstofcyklussen 10 ATP:
- 6 ATP forbruges i under glukoneogenese pr. molekyle af glucose syntetiseret;
- 4 ATP forbruges i urinstofcyklussen pr.molekyle af urinstof syntetiseret.
glucose-alanincyklussen, som Cori-cyklussen, skifter en del af den metaboliske byrde fra ekstrahepatiske væv til leveren. Imidlertid er energiomkostningerne, der betales af leveren, berettiget af de fordele, som cyklussen bringer til hele kroppen, da det under særlige forhold tillader en effektiv nedbrydning af proteiner i ekstrahepatiske væv (især skeletmuskulatur), hvilket igen gør det muligt at opnå glukoneogene substrater såvel som brugen af aminosyrer til energi i ekstrahepatiske væv.
ligheder og forskelle mellem Cahill cycle og Cori cycle
der er nogle analogier mellem de to cyklusser, som er angivet nedenfor.
- Cahill-cyklussen overlapper delvist Cori-cyklussen, når pyruvat omdannes til glukose, og monosaccharidet transporteres til ekstrahepatiske væv, hvor det igen omdannes til pyruvat via den glykolytiske vej.
- indgangen til glukoneogenesevejen er ens for de to cyklusser: både alanin og lactat omdannes til pyruvat.
- ligesom Cori-cyklussen forekommer glucose-alanin-cyklussen mellem forskellige celletyper, i modsætning til metaboliske veje såsom glykolyse, Krebs-cyklus eller glukoneogenese, der forekommer i individuelle celler
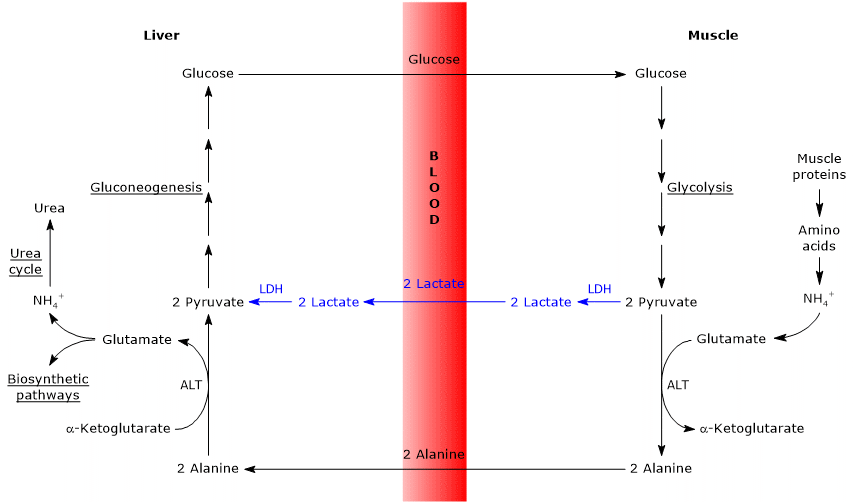
nedenfor, nogle forskelle mellem de to cyklusser.
- hovedforskellen vedrører de tre carbon mellemprodukt, der fra perifere væv når leveren: lactat i Cori-cyklussen og alanin i glucose-alanin-cyklussen.
- en anden forskel vedrører skæbnen af NADH produceret af glycolyse i perifere væv.
i Cori-cyklussen fungerer coensymet som reduktionsmiddel for at reducere pyruvat til lactat i reaktionen katalyseret af lactatdehydrogenase (EC 1.1.1.27).
i glucose-alanin-cyklussen forekommer denne reduktion ikke, og elektronerne af NADH kan transporteres ind i mitokondrierne via malat-aspartat-og glycerol-3-phosphat-pendulkørsler, der genererer NADH, den første shuttle og FADH2, den anden shuttle. Og udbyttet af ATP fra NADH og FADH2 er henholdsvis 2,5 og 1,5. - endelig er det fra det foregående punkt klart, at Cahill-cyklussen i modsætning til Cori-cyklussen kræver tilstedeværelse af ilt og mitokondrier i det perifere væv.
Berg J. M., Tymocko J. L. og Stryer L. Biochemistry. 5. udgave. Freeman and Company, 2002
Felig P., Posefsk T., Marlis E., Cahill G. F. Alanine: nøglerolle i glukoneogenese. Videnskab 1970; 167 (3920):1003-4. doi:10.1126 / videnskab.167. 3920. 1003
Gropper S. S., Smith J. L., Groff J. L. Avanceret ernæring og menneskelig metabolisme. Cengage Learning, 2009
Lecker S. H., Goldberg A. L. og Mitch V. E. protein nedbrydning ved allestedsnærværende proteasom vej i normale og sygdomstilstande. J Am Soc Nephrol 2006; 17 (7):1807-19. doi: 10.1681 / ASN.2006010083
Mallette L. E., Ekston J. H. og Park C. R. kontrol af glukoneogenese fra aminosyrer i den perfunderede rottelever. J Biol Chem 1969;244 (20): 5713-23.
Nelson D. L., K. M. M. Lehninger. Principper for biokemi. 6. udgave. Freeman and Company, 2012
Raju S. M., Madala B. Illustreret Medicinsk Biokemi. Jaypee Brothers Publishers, 2005
vi G. aminosyrer: biokemi og ernæring. CRC Press, 2013