det er ikke indlysende. Valenselektroner er dem, der er vigtige i kemisk binding. For overgangsmetaller vil ordet “vigtigt” variere afhængigt af konteksten.
det er lettere og mere praktisk at beskrive, hvilke orbitaler der er valensorbitaler, når det kommer til overgangsmetaller (selvom det bliver vanskeligt med lanthanider og actinider).
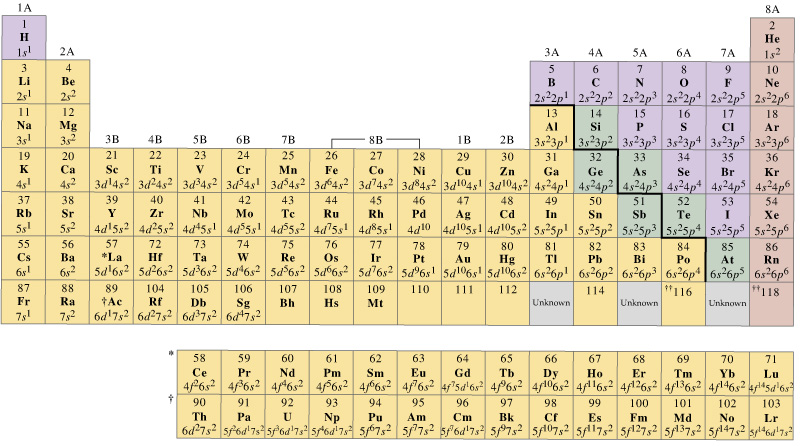
generelt har overgangsmetallerne i første række et sæt valensorbitaler, der inkluderer deres # 4s# og #3d#’er, men antallet af valenselektroner vil variere.
for eksempel…

- Scandium giver mening at have op til tre valenselektroner, da der findes en #”Sc”^(+3)# oksideringstilstand (f.eks. #”ScCl”_3#), men ikke #”Sc”^(+4)# eller højere. En# +3 # iltningstilstand ville have krævet overførsel af tre valenselektroner, hvis den skulle danne en ren kation.
- chrom kunne have op til seks valenselektroner, som ville omfatte dets # 3D # elektroner, da det kan opnå en# + 6 # iltningstilstand (dvs. i # ” Cr ” _2 ” O “_7^(2 -)# eller i # “CrO”_4^(2-)#).
- kobber har en tendens til at have en #+1# iltningstilstand (f.eks. #”CuCl”#), så det giver mening, at det bruger sin ene #4S# elektron oftest som sin valenselektron(er). #”CuCl”_2#), og det er derfor i stand til at tage fra sine #bb(3D)# elektroner også for dets valenselektron(er).
på den anden side kunne vi let sige, at valensorbitalerne i de første række overgangsmetaller er #4s# og #3D# orbitaler.
så generelt vil jeg sige, at antallet af valenselektroner til overgangsmetaller (og lanthanid og actinider) varierer på en uforudsigelig måde, men valensorbitalerne kunne undertiden forudsiges med tilstrækkelig kemisk intuition.
ansvarsfraskrivelse: Det er dog generelt vanskeligt for lanthaniderne og actiniderne at forudsige, hvilke orbitaler der er valens.
for eksempel har actiniderne #5f# og #6d# orbitaler meget tæt på energi til deres #7s# orbital, så vi kan gætte og inkludere #7s#, #6d# og #5f# i valensrummet (selvom #6d# orbitalerne er tomme), når vi udfører atomenergiberegninger.