- læringsmål
- vi bruger symboler til at beskrive valenselektronkonfigurationer af atomer og monatomiske ioner. Et symbol består af et elementært symbol omgivet af en prik for hver af dens valenselektroner:
- Luvisstrukturer
- Oktetreglen
- dobbelt og tredobbelt bindinger
- ved at skrive uparrede strukturer med Oktetreglen
- eksempel 1: skrivning af strukturer
- nøglebegreber og Resume
- øvelser
- ordliste
læringsmål
ved udgangen af dette afsnit vil du være i stand til at:
- skriv symboler for neutrale atomer og ioner
- tegn strukturer, der viser bindingen i enkle molekyler
vi har diskuteret de forskellige typer bindinger, der dannes mellem atomer og/eller ioner. I alle tilfælde involverer disse bindinger deling eller overførsel af valensskalelektroner mellem atomer. I dette afsnit vil vi undersøge den typiske metode til afbildning af valensskalelektroner og kemiske bindinger, nemlig uvis-symboler og uvis-strukturer.
vi bruger symboler til at beskrive valenselektronkonfigurationer af atomer og monatomiske ioner. Et symbol består af et elementært symbol omgivet af en prik for hver af dens valenselektroner:

Figur 1 viser symbolerne for elementerne i den tredje periode i det periodiske system.

Figur 1. Symboler, der illustrerer antallet af valenselektroner for hvert element i den tredje periode af det periodiske system.
Levis-symboler kan også bruges til at illustrere dannelsen af kationer fra atomer, som vist her for natrium og calcium:

ligeledes kan de bruges til at vise dannelsen af anioner fra atomer, som vist nedenfor for klor og svovl:

figur 2 viser brugen af Lyvissymboler til at vise overførslen af elektroner under dannelsen af ioniske forbindelser.

figur 2. Kationer dannes, når atomer mister elektroner, repræsenteret af færre uvisse prikker, mens anioner dannes af atomer, der får elektroner. Det samlede antal elektroner ændres ikke.
Luvisstrukturer
vi bruger også Luvissymboler til at indikere dannelsen af kovalente bindinger, som er vist i Luvisstrukturer, tegninger, der beskriver bindingen i molekyler og polyatomiske ioner. For eksempel, når to kloratomer danner et klormolekyle, deler de et par elektroner:

hvert Cl-atom har tre par elektroner, der ikke bruges til binding (kaldet ensomme par) og et delt par elektroner (skrevet mellem atomerne). En bindestreg (eller linje) bruges undertiden til at indikere et delt par elektroner:

et enkelt delt par elektroner kaldes en enkelt binding. Hvert Cl-atom interagerer med otte valenselektroner: de seks i de ensomme par og de to i enkeltbindingen.
Oktetreglen
de andre halogenmolekyler (F2, Br2, I2 og At2) danner bindinger som dem i klormolekylet: en enkelt binding mellem atomer og tre ensomme par elektroner pr.atom. Dette gør det muligt for hvert halogenatom at have en ædelgaselektronkonfiguration. Tendensen af hovedgruppeatomer til at danne nok bindinger til at opnå otte valenselektroner er kendt som oktetreglen.
antallet af bindinger, som et atom kan danne, kan ofte forudsiges ud fra antallet af elektroner, der er nødvendige for at nå en oktet (otte valenselektroner); dette gælder især ikke-metaller i den anden periode i det periodiske system (C, N, O og F). For eksempel har hvert atom i et gruppe 14-element fire elektroner i sin yderste skal og kræver derfor yderligere fire elektroner for at nå en oktet. Disse fire elektroner kan opnås ved at danne fire kovalente bindinger, som illustreret her for kulstof i CCl4 (carbontetrachlorid) og silicium i SiH4 (silan). Fordi brint kun har brug for to elektroner for at udfylde sin valensskal, er det en undtagelse fra oktetreglen. Overgangselementerne og de indre overgangselementer følger heller ikke oktetreglen:

Gruppe 15 elementer såsom nitrogen har fem valenselektroner i det atomare symbol: et ensomt par og tre uparrede elektroner. For at opnå en oktet danner disse atomer tre kovalente bindinger, som i NH3 (ammoniak). Ilt og andre atomer i gruppe 16 opnår en oktet ved at danne to kovalente bindinger:
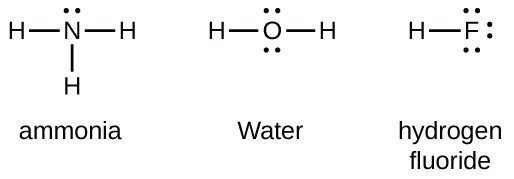
dobbelt og tredobbelt bindinger
som tidligere nævnt, når et par atomer deler et par elektroner, kalder vi dette en enkelt binding. Imidlertid kan et par atomer muligvis dele mere end et par elektroner for at opnå den nødvendige oktet. En dobbeltbinding dannes, når to par elektroner deles mellem et par atomer, som mellem kulstof-og iltatomerne i CH2O (formaldehyd) og mellem de to carbonatomer i C2H4 (ethylen):
en tredobbelt binding dannes, når tre elektronpar deles af et par atomer, som i nitrogengas (N2):
ved at skrive uparrede strukturer med Oktetreglen
For meget enkle molekyler og molekylære ioner kan vi skrive uparrede strukturer ved blot at parre de uparrede elektroner på de bestanddele. Se disse eksempler:

for mere komplicerede molekyler og molekylære ioner er det nyttigt at følge den trinvise procedure, der er beskrevet her:
- bestem det samlede antal Valens (ydre skal) elektroner.
- Tegn en skeletstruktur af molekylet, der arrangerer atomerne omkring et centralt atom. (Generelt skal det mindst elektronegative element placeres i midten.) Forbind hvert atom til det centrale atom med en enkelt binding (et elektronpar).
- fordel de resterende elektroner som ensomme par på terminalatomerne (undtagen brint) og fuldfør en oktet omkring hvert atom.
- Placer alle resterende elektroner på det centrale atom.
- Omarranger elektronerne i de ydre atomer for at gøre flere bindinger med det centrale atom for at opnå oktetter, hvor det er muligt.
lad os bestemme strukturen af PBr3 ved hjælp af ovenstående trin:
- Trin 1: Bestem det samlede antal Valens (ydre skal) elektroner.
\large \ begin{array}{l} \ \ \ phantom {\rule{0,8 em}{0eks}}{\tekst{PBr}}_{3}\\ \phantom{\rule{0,8 em}{0eks}}\tekst{P: 5 valenselektroner/atom}\gange \tekst{1 atom}=5\\ \understregning{+\tekst{Br: 7 valenselektron/atom}\gange \tekst{3 atomer}=21}\\ \\ \phantom{\rule{15.95em}{0eks}}= \ tekst{26 valenselektroner} \ end{array}
- Trin 2: Tegn en skeletstruktur af molekylet, arrangere atomerne omkring et centralt atom. (Generelt skal det mindst elektronegative element placeres i midten.) Forbind hvert atom til det centrale atom med en enkelt binding (et elektronpar).

- Trin 3: fordel de resterende elektroner som ensomme par på terminalatomerne (undtagen brint) og fuldfør en oktet omkring hvert atom.
-
 Trin 4: Placer alle resterende elektroner på det centrale atom.
Trin 4: Placer alle resterende elektroner på det centrale atom.

Bemærk: Trin 5: er ikke nødvendig, da alle atomer har en oktet.
lad os bestemme strukturen af CH2O.
- Trin 1: Bestem det samlede antal Valens (ydre skal) elektroner.
\large \begin{array}{l}\\ \phantom{\rule{0.8 em}{0eks}}{\tekst{H}_{2}}\tekst{CO}\\ \phantom{\rule{0.8 em}{0eks}}\tekst{H: 1 valenselektron/atom}\gange \tekst{2 atom}=2\\\Tekst{C: 4 valenselektroner/atom}\gange \tekst{1 atom}=4\\ \understregning{+\tekst{o: 6 valenselektroner/atom}\gange \tekst{1 atomer}=6}\\ \\ \fantom{\regel{15.95 em}{0eks}}=\tekst{12 valenselektroner}\ende{array}
- Trin 2: Tegn en skeletstruktur af molekylet, arrangere atomerne omkring et centralt atom. (Generelt skal det mindst elektronegative element placeres i midten.) Forbind hvert atom til det centrale atom med en enkelt binding (et elektronpar).

- Trin 3: fordel de resterende elektroner som ensomme par på terminalatomerne (undtagen brint) og fuldfør en oktet omkring hvert atom.

- Trin 4: ikke nødvendigt, da alle elektroner er placeret. Kulstof har dog ikke en oktet,
- Trin 5: Omarranger elektronerne i de ydre atomer for at skabe flere bindinger med det centrale atom for at opnå oktetter, hvor det er muligt.

eksempel 1: skrivning af strukturer
NASAs Cassini-Huygens-mission opdagede en stor sky af giftigt hydrogencyanid (HCN) på Titan, en af Saturns måner. Hvad er disse molekylers struktur?
Tjek din læring
kulsyre, CO2, er et produkt af forbrænding af fossile brændstoffer. CO2 har været involveret i globale klimaændringer. Hvad er Co2 ‘ s struktur?
nøglebegreber og Resume
Valens elektroniske strukturer kan visualiseres ved at tegne Luvissymboler (for atomer og monatomiske ioner) og Luvisstrukturer (for molekyler og polyatomiske ioner). Enlige par, uparrede elektroner og enkelt -, dobbelt-eller tredobbeltbindinger bruges til at indikere, hvor valenselektronerne er placeret omkring hvert atom i en naturlig struktur. De fleste strukturer—især dem, der indeholder elementer i anden række—adlyder oktetreglen, hvor hvert atom (undtagen H) er omgivet af otte elektroner. Undtagelser fra oktetreglen forekommer for ulige elektronmolekyler (frie radikaler), elektronmangel molekyler og hypervalente molekyler.
øvelser
- skriv symbolerne for hver af de følgende ioner:
- As3 –
- i–
- Be2 +
- O2–
- Ga3 +
- Li +
- N3–
- mange monatomiske ioner findes i havvand, herunder ionerne dannet ud fra følgende liste over elementer. Skriv symbolerne for de monatomiske ioner dannet af følgende elementer:
- Cl
- Na
- Mg
- Ca
- K
- Br
- Sr
- F
- skriv ionerne for ionerne i hver af de følgende ioniske forbindelser og ionerne for atomet, hvorfra de dannes:
- MgS
- Al2O3
- GaCl3
- K2O
- Li3N
- KF
- i de nedenfor anførte strukturer repræsenterer M og H forskellige elementer i den tredje periode af det periodiske system. Skriv formlen for hver forbindelse ved hjælp af de kemiske symboler for hvert element:
- skriv strukturen for det diatomiske molekyle P2, en ustabil form for fosfor, der findes i fosfordamp ved høj temperatur.
- skriv strukturer for følgende:
- H2
- HBr
- PCl3
- skriv strukturer for følgende:
- O2
- H2CO
- AsF3
- SiCl4
ordliste
dobbeltbinding: kovalent binding, hvor to par elektroner deles mellem to atomer
frie radikaler: molekyle, der indeholder et ulige antal elektroner
hypervalent molekyle: molekyle indeholdende mindst et hovedgruppeelement, der har mere end otte elektroner i sin valensskal
: symbol for et element eller monatomisk ion, der bruger en prik til at repræsentere hver valenselektron i elementet eller ion
lone pair: to (et par) valenselektroner, der ikke bruges til at danne en kovalent binding
oktetregel: retningslinje, der angiver hovedgruppeatomer, vil danne strukturer, hvor otte valenselektroner interagerer med hver kerne, idet de tæller bindingselektroner som interagerende med begge atomer forbundet med bindingen
enkeltbinding: binding, hvor der er en enkelt par elektroner deles mellem to atomer
triple bond: binding, hvor tre par elektroner deles mellem to atomer


 HCN: ingen elektroner forbliver
HCN: ingen elektroner forbliver




















