beviset bag naturlige interventioner for ikke-alkoholisk fedtleversygdom: botaniske stoffer, næringsstoffer og probiotika til behandling af denne almindelige lidelse
i betragtning af stigningen i ikke-alkoholisk fedtleversygdom (NAFLD) hos både voksne og pædiatri og manglen på en angivet farmaceutisk behandling, naturlige strategier til behandling af denne tilstand står godt klar som den “næstbedste ting.”Flere kosttilskud og botaniske stoffer er blevet undersøgt klinisk og viser løfte om behandling af NAFLD og dets inflammatoriske modstykke, ikke-alkoholisk steatohepatitis (NASH). I betragtning af hvor mange af disse terapier adresserer de faktorer, der bidrager til udviklingen af NAFLD, kræver det ikke meget ræsonnement at forstå, hvordan de effektivt kan tackle nogle af de grundlæggende årsager til sygdom, snarere end blot at tackle et symptom.
fem supplerende interventioner med klinisk eller epidemiologisk bevis for deres anvendelse i indstillingen af NAFLD er phosphatidylcholin, som tilvejebringer phospholipider og cholin, E-vitamin, både som alfa-tocopheroler og en blanding af delta-og gamma-tocotrienoler, mælketistelfrøekstrakt, berberin og probiotika.
- Fedtleverændringer: korreleret med en Phosphatidylcholinmangel?
- E-Vitamin
- mælketistel
- berberin
- probiotika
- konklusion
- Dr. Carrie Decker, nd dimitterede med udmærkelse fra National College of Natural Medicine (nu National University of Natural Medicine) i Portland, Oregon. Dr. Decker ser patienter eksternt med fokus på gastrointestinal sygdom, humør ubalancer, spiseforstyrrelser, autoimmun sygdom og kronisk træthed. Før han blev naturopatisk læge, var Dr. Decker ingeniør og opnåede kandidatgrader i biomedicinsk og maskinteknik fra henholdsvis University of Illinois i Urbana-Champaign. Dr. Decker fortsætter med at nyde akademisk forskning og skrivning og bruger disse færdigheder til at støtte integrativ medicinuddannelse som forfatter og bidragyder til forskellige ressourcer. Dr. Decker støtter Allergy Research Group som medlem af deres uddannelses-og produktudviklingsteam.
- kilder:
- Spengler EK, Loomba R. anbefalinger til diagnose, henvisning til leverbiopsi og behandling af ikke-alkoholisk fedtleversygdom og ikke-alkoholisk steatohepatitis. Mayo Clinic Proceedings. 2015;90(9):1233–1246.
- Berardis S, Sokal E. pædiatrisk ikke-alkoholisk fedtleversygdom: et stigende folkesundhedsspørgsmål. Eur J Pediatr. 2014 Februar;173 (2): 131-9.
- Jadeja R, et al. Urtemedicin til behandling af ikke-alkoholisk steatohepatitis: aktuelle scenarier og fremtidsudsigter. Evid Baseret Komplement Alternat Med. 2014:648308.
- Pomorski T, et al. Lipidfordeling og transport på tværs af cellemembraner. Semin Cell Dev Biol. 2001 April;12 (2): 139-48.
- Yamaji-Hasegava A, et al. Asymmetrisk fordeling af phospholipider i biomembraner. Biol Pharm Bull. 2006 August;29 (8): 1547-53.
- Hej Hr. Biliær lipidsekretion. Turk J Gastroenterol. 2007 Jun;18 (2): 65-70.
- Fischer LM, et al. Køn og menopausal status påvirker menneskets kostbehov for næringsstoffet cholin. Am J Clin Nutr. 2007 Maj;85 (5): 1275-85.
- TC, et al. Sædvanlige Kolinindtag er forbundet med æg-og Proteinfødeforbrug i USA. Næringsstof. 2017 August 5; 9 (8).
- Seisel SH. Genresponselementer, genetiske polymorfier og epigenetik påvirker det menneskelige diætbehov for cholin. IUBMB liv. 2007 Jun;59 (6): 380-7.
- Seisel SH. Genresponselementer, genetiske polymorfier og epigenetik påvirker det menneskelige diætbehov for cholin. IUBMB liv. 2007 Jun;59 (6): 380-7.
- Guerrerio AL, et al. Cholinindtag i en stor kohorte af patienter med ikke-alkoholisk fedtleversygdom. Am J Clin Nutr. 2012 April; 95 (4): 892-900.
- Ma et al. Polyenylphosphatidylcholin dæmper ikke-alkoholisk hepatisk fibrose og fremskynder dens regression. J Hepatol. 1996 Maj;24 (5): 604-13.
- Lieber CS, et al. Phosphatidylcholin beskytter mod fibrose og cirrose i bavianen. Gastroenterologi. 1994 Jan;106(1):152-9.
- Chanussot F, et al. Forebyggelse ved diæt (n-6) flerumættede phosphatidylcholiner af intrahepatisk kolestase induceret af cyclosporin A hos dyr. Livet Sci. 2003 Juni 13;73 (4): 381-92.
- Karaman A, et al. Beskyttende virkning af flerumættet phosphatidylcholin på leverskader induceret af galdeobstruktion hos rotter. J Pediatr Surg. 2003 Sep;38 (9): 1341-7.
- Karaman A, et al. Beskyttende virkning af flerumættet phosphatidylcholin på leverskader induceret af galdeobstruktion hos rotter. J Pediatr Surg. 2003 Sep;38 (9): 1341-7.
- Stremel M, et al. Mucosal beskyttelse af phosphatidylcholin. Dig Dis. 2012; 30 Suppl 3: 85-91.
- Parlesak A, et al. Konjugerede primære galdesalte reducerer permeabiliteten af endotoksin gennem tarmepitelceller og synergiserer med phosphatidylcholin til undertrykkelse af inflammatorisk cytokinproduktion. Crit Care Med. 2007 oktober; 35 (10): 2367-74.
- Mitscherling K, et al. Phosphatidylcholin reverserer ethanolinduceret stigning i transepithelial endotoksinpermeabilitet og afskaffer transepithelial leukocytaktivering. 2009 Mar; 33 (3): 557-62.
- Musetti E, et al. Den multiple hit patogenese af ikke-alkoholisk fedtleversygdom (NAFLD). Stofskifte. 2016 Aug;65 (8):1038-48.
- El Hadi H, et al. E-Vitamin som behandling for ikke-alkoholisk fedtleversygdom: virkelighed eller myte? Antioksidanter (Basel). 2018 Jan 16;7(1).
- Bugianesi E, et al. Et randomiseret kontrolleret forsøg med metformin versus E-vitamin eller receptpligtig diæt ved ikke-alkoholisk fedtleversygdom. Er J Gastroenterol. 2005 Maj;100 (5): 1082-90.
- Sanyal Aj, et al. E-vitamin eller placebo til ikke-alkoholisk steatohepatitis. N Engl J Med. 2010 6. maj;362 (18): 1675-85.
- Lavine JE. E-vitamin behandling af ikke-alkoholisk steatohepatitis hos børn: pilotundersøgelse. J Pediatr. 2000 Jun;136 (6): 734-8.
- Peh HY, et al. E-vitamin terapi ud over kræft: Tocopherol versus tocotrienol. Pharmacol Ther. 2016 Juni;162: 152-69.
- et al. Dosisafhængig modulering af lipidparametre, cytokiner og RNA af delta-tocotrienol hos hypercholesterolemiske forsøgspersoner begrænset til AHA Trin-1 diæt. Brit J af med & med Res. 2015; 6 (4): 351-66.
- et al. Virkning af delta-tocotrienol på inflammatoriske biomarkører og oksidativ stress hos hyperkolesterolemiske personer. Cardiology. 2015;6(4):1000367.
- Saiden N, et al. Gamma delta-tocotrienoler reducerer hepatisk triglyceridsyntese og VLDL-sekretion. J Ateroskler Thromb. 2010 oktober 27;17 (10): 1019-32.
- Magosso E, et al. Tocotrienoler til normalisering af hepatisk ekkogent respons i ikke-alkoholisk fedtlever: et randomiseret placebokontrolleret klinisk forsøg. Nutr J. 2013 27.December;12(1):166.
- Perves MA, et al. Virkninger af Delta-Tocotrienoltilskud på leversygdomme, Inflammation, Oksidativ stress og hepatisk steatose hos patienter med ikke-alkoholisk fedtleversygdom. Turk J Gastroenterol. 2018 Mar;29(2):170-176.
- Abenavoli L, et al. Mælketistel i leversygdomme: fortid, nutid, fremtid. Phytother Res. 2010 Oktober;24 (10): 1423-32.
- Valuela A, et al. Selektivitet af silymarin på stigningen af GSH-indholdet i forskellige væv af rotten. Planta Med. 1989 okt; 55 (5): 420-2.
- Rui YC. Fremskridt i farmakologiske undersøgelser af silymarin. Mem Inst Osvaldo. 1991; 86 Suppl 2: 79-85.
- Gu M, et al. Silymarin forbedrer metabolisk dysfunktion forbundet med diætinduceret fedme via aktivering af Farnesyl Receptor. Front Pharmacol. 2016 September 28; 7: 345.
- Ali AH, et al. De seneste fremskridt i udviklingen af farnesoid-receptoragonister. Ann Transl Med. 2015 Jan;3(1):5.
- Traussnigg S, et al. Effekt og sikkerhed af non-steroide farnesoid-receptoragonist PKS-104 hos patienter med ikke-alkoholisk fedtleversygdom (NAFLD). E-mail: . 2017 Kan; 55 (05): A71.
- Jong S, et al. Den terapeutiske virkning af silymarin til behandling af ikke-alkoholisk fedtsygdom: en metaanalyse (PRISMA) af randomiserede kontrolforsøg. Medicin (Baltimore). 2017 Dec;96 (49): e9061.
- Hajiaghamohammadi AA, et al. Behandling af ikke-alkoholisk fedtleversygdom: en randomiseret kontrolleret pilotundersøgelse. Hepat Mon. 2012 August;12 (8): e6099.
- Birdsall TC, et al. Berberin: terapeutisk potentiale for en alkaloid, der findes i flere medicinske planter. Altern Med Rev. 1997; 2: 94-103.
- Imanshahidi M, et al. Farmakologiske og terapeutiske virkninger af Berberis vulgaris og dets aktive bestanddel, berberin. Phytother Res. 2008 August;22(8):999-1012.
- et al. De potentielle mekanismer af berberin til behandling af ikke-alkoholisk fedtleversygdom. Molekyle. 2016 Oktober 14;21 (10).
- Lan J, et al. Meta-analyse af berberins virkning og sikkerhed ved behandling af type 2 diabetes mellitus, hyperlipæmi og hypertension. J Ethnopharmacol. 2015 Februar 23; 161: 69-81.
- Sun R, et al. Oralt administreret berberin modulerer hepatisk lipidmetabolisme ved at ændre mikrobiel Galdesyremetabolisme og den intestinale signalvej. Mol Pharmacol. 2017 Februar; 91 (2): 110-122.
- Guo T, et al. Berberin forbedrer hepatisk steatose og undertrykker lever-og Fedtvævsbetændelse hos mus med diætinduceret fedme. Sci Rep. 2016 Mar 3; 6: 22612.
- Schattenberg JM, et al. JNK1 men ikke JNK2 fremmer udviklingen af steatohepatitis hos mus. Hepatologi. 2006 Jan;43(1):163-72.
- Han J, et al. Modulerende tarmmikrobiota som en antidiabetisk mekanisme af berberin. Med Sci Monit. 2011; 17: RA164-7.
- Gu L, et al. Berberin forbedrer tarmepitelskader med tæt kryds og nedregulerer myosin-lette kædekinaseveje i en musemodel af endotoksinæmi. J Inficere Dis. 2011 juni 1;203 (11): 1602-12.
- Li N, et al. Berberin dæmper proinflammatorisk cytokininduceret tæt forbindelsesforstyrrelse i en in vitro-model af tarmepitelceller. Eur J Pharm Sci. 2010 April 16; 40 (1): 1-8.
- Ma et al. Patogenesen af Diabetes mellitus ved Oksidativ Stress og Inflammation: dens hæmning af berberin. Front Pharmacol. 2018 juli 27; 9: 782.
- Yan HM, et al. Effekt af berberin hos patienter med ikke-alkoholisk fedtleversygdom. PLoS One. 2015 August 7;10(8):e0134172.
- Ma YY, et al. Virkninger af probiotika på ikke-alkoholisk fedtleversygdom: en metaanalyse. Verden J Gastroenterol. 2013 Oktober 28;19 (40): 6911-8.
- Vajro P, et al. Virkninger af Lactobacillus rhamnosus stamme GG i pædiatrisk fedme-relateret leversygdom. J Pediatr Gastroenterol Nutr. 2011 juni;52 (6):740-3.
- Alisi A, et al. Randomiseret klinisk forsøg: de gavnlige virkninger af VSL#3 hos overvægtige børn med ikke-alkoholisk steatohepatitis. Aliment Pharmacol Ther. 2014 Jun;39 (11): 1276-85.
- P Rubio KG, et al. Virkning af administration af berberin på metabolisk syndrom, insulinfølsomhed og insulinsekretion. Metab Syndr Relatere Disord. 2013 Oktober;11 (5): 366-9.
- Iacono A, et al. Probiotika som en ny terapeutisk strategi til behandling af NAFLD: fokus på molekylære og biokemiske mekanismer. J Nutr Biochem. 2011 August;22(8):699-711.
- Honda Y, et al. Effekt af glutathion til behandling af ikke-alkoholisk fedtleversygdom: en åben, enkeltarm, multicenter, pilotundersøgelse. BMC Gastroenterol. 2017 August 8;17 (1): 96.
- Dentico P, et al. . Recenti Prog Med. 1995 Jul-Aug; 86 (7-8): 290-3.
- Khoshbaten M, et al. N-acetyl-cystein forbedrer leverfunktionen hos patienter med ikke-alkoholisk fedtleversygdom. Hepatitis Mon. 2010;10(1):12-16.
- Muto C, et al. Gamma-tocotrienol reducerer triacylglycerolniveauet i rotte primære hepatocytter gennem regulering af fedtsyremetabolisme. J Clin Biochem Nutr. 2013;52(1):32-37.
- Parker HM, et al. Omega-3 tilskud og ikke-alkoholisk fedtleversygdom: en systematisk gennemgang og meta-analyse. J Hepatol. 2012;56(4):944-51.
Fedtleverændringer: korreleret med en Phosphatidylcholinmangel?
phosphatidylcholin (PC) er afgørende for sundheden for alle celler i kroppen og er en af de vigtigste phospholipider, som cellulære membraner består af., PC udgør over 90% af det samlede indhold af galdefosfolipider og letter fedtemulgering, absorption og transport. Undersøgelser har vist, at det anbefalede tilstrækkelige indtag (AI) af cholin (Se tabel 1) muligvis ikke er tilstrækkeligt til forebyggelse af symptomer på mangel, såsom fedtleverændringer eller muskelskader. Derudover fandt en nylig undersøgelse, at kun 8% af amerikanske voksne opfylder den anbefalede AI af cholin, med vegetarer, postmenopausale kvinder og mænd med størst risiko for utilstrækkelighed., Genetiske polymorfier kan også øge behovet for cholin, som også er en kilde til methylgrupper i kroppen.
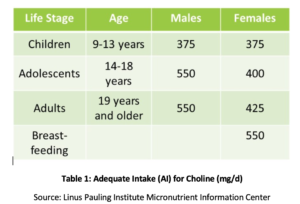
hos postmenopausale kvinder med NAFLD har nedsat kolinindtag vist sig at være signifikant forbundet med en øget risiko for fibrose. Hos dyr har PC vist sig at beskytte mod fibrose forbundet med leverbetændelse., Øget indtagelse af PC har vist sig at forbedre biliær lipidsekretion og derved forhindre kolestase og efterfølgende leverskade via adskillige mekanismer, herunder undertrykkelse af nuklear faktor kappa B (NF-kB), en godt forstået molekylær udløser af betændelse., I en dyremodel af galdeobstruktion har supplerende PC vist sig at reducere leverskade, duktal proliferation og fibrose.
PC er også afgørende for tarmens sundhed og er en primær komponent i det beskyttende tarmslimlag. I cellekulturer har behandling med PC vist sig at reducere migrationen af endotoksin gennem tarmepitelceller, hvilket yderligere undertrykker det tilknyttede inflammatoriske cytokinrespons. PC reducerer også endotoksintranslokation i indstillingen af alkoholinducerede stigninger i tarmpermeabilitet. Denne gavnlige virkning er blevet foreslået som en af de mekanismer, hvormed PC kan betragtes som terapeutisk ved alkoholisk leversygdom.
E-Vitamin
da der er blevet foreslået et antioksidativt stressslag og formindsket antioksidantforsvar som en faktor, der fører udviklingen af NAFLD, bør det ikke være overraskende, at antioksidanter er blevet undersøgt som en potentiel behandling for tilstanden.
 E-Vitamin er blevet undersøgt i flere kliniske forsøg til behandling af NAFLD, både som en selvstændig og supplerende terapi. I en gennemgang af disse undersøgelser varierede doseringen af E-vitamin fra 400 til 1200 IE/dag, og studievarigheden var fra 24 uger til mere end to år. Resultaterne var generelt positive, hvilket viste, at når E-vitamin blev inkluderet, blev der set forbedringer i histologi, steatose og/eller transaminaseniveauer., I pædiatri med NAFLD er E-vitamin også blevet undersøgt som en terapi. I en åben pilotundersøgelse, der omfattede 11 børn med NAFLD, blev tilskud på mellem 400 og 1200 IE E-vitamin i fire til ti måneder fundet at normalisere transaminase-og alkaliske fosfataseniveauer under behandlingen, men de vendte tilbage til unormale, når behandlingen blev stoppet. Hepatisk ekkogenicitet ændrede sig ikke i løbet af behandlingen.
E-Vitamin er blevet undersøgt i flere kliniske forsøg til behandling af NAFLD, både som en selvstændig og supplerende terapi. I en gennemgang af disse undersøgelser varierede doseringen af E-vitamin fra 400 til 1200 IE/dag, og studievarigheden var fra 24 uger til mere end to år. Resultaterne var generelt positive, hvilket viste, at når E-vitamin blev inkluderet, blev der set forbedringer i histologi, steatose og/eller transaminaseniveauer., I pædiatri med NAFLD er E-vitamin også blevet undersøgt som en terapi. I en åben pilotundersøgelse, der omfattede 11 børn med NAFLD, blev tilskud på mellem 400 og 1200 IE E-vitamin i fire til ti måneder fundet at normalisere transaminase-og alkaliske fosfataseniveauer under behandlingen, men de vendte tilbage til unormale, når behandlingen blev stoppet. Hepatisk ekkogenicitet ændrede sig ikke i løbet af behandlingen.
tocotrienoler er den mindre studerede familie af de naturligt forekommende former for E-vitamin, med tocopherolerne, der oftere findes i naturen, dominerer videnskabelig forskning. Imidlertid er tocotrienoler potente antioksidanter, citeret i nogle undersøgelser for at have 40 til 60 gange tocopherols antioksidantpotentiale. Tocotrienoler har vist sig at forbedre total kolesterol og dets fraktioner, hvilket reducerer total-og LDL-kolesterol med 15 til 20%, og triglycerider op til næsten 30%. Tocotrienoler har også vist sig at have antiinflammatoriske og antioksidante virkninger in vivo, hvilket sænker C-reaktivt protein (hs-CRP) med høj følsomhed og reducerer LDL-iltning.
tocotrienoler er også blevet undersøgt som en behandling for NAFLD. Hos patienter med ultralyddiagnosticeret NAFLD blev 200 mg blandede tocotrienoler (hentet fra palmeolie med en høj gammafraktion og yderligere 61 mg alfa-tocopheroler) taget to gange dagligt i et år vist sig at normalisere hepatisk ekkogen respons og remissionshastighed signifikant sammenlignet med placebo. I en anden undersøgelse, herunder patienter med ultralyddiagnosticeret NAFLD og transaminaseforhøjelse, reducerede 300 mg tocotrienoler (en 90:10 delta:gamma-blanding) to gange dagligt i 12 uger signifikant aspartataminotransferase (ASAT), alaninaminotransferase (ALT), hs-CRP og malondialdehyd (en markør for oksidativ stress) niveauer samt fedtlever indeks score sammenlignet med placebo.
mælketistel
mælketistel (Silybum marianum) er muligvis den mest kendte leverbeskyttende botaniske. Silymarin, en blanding af de aktive bestanddele i mælketistel og silibinin, den mest aktive forbindelse, der findes i den, er blevet vist i dyreforsøg for at reducere leverskade forårsaget af acetaminophen, alkohol, jernoverbelastning og stråling blandt andre kendte levertoksiske stoffer. Silymarin har vist sig at øge niveauet af glutathion, en kraftig antioksidant, i både leveren og tarmene. Det reducerer også lipid peroksidering, som beskadiger cellulære membraner, ændrer deres funktion og muligvis forårsager cellulær død.
Silibinin og silymarin har vist sig at aktivere en nuklear galdesyrereceptor kendt som farnesoid-receptor (FEKSR) i leveren, nedregulerende inflammatoriske veje og korrigering af insulinresistens og dyslipidæmi induceret ved fodring med fedtfattig diæt (HFD). Det er en vigtig regulator af galdesyre, glukose og lipid balance i kroppen. Medicin, der interagerer med FEKSR på samme måde som disse mælketistelafledte forbindelser, undersøges også til behandling af NAFLD og de relaterede metaboliske udfordringer.
kliniske undersøgelser har også vist, at mælketistel forbedrer forskellige parametre forbundet med NAFLD. En metaanalyse fra 2017 viste, at behandling med mælketistel signifikant reducerer ALT og AST med henholdsvis -5,08 IE/L og -5,44 IE/l hos patienter med NAFLD. Doserne varierede fra 140 mg en gang dagligt til 200 mg tre gange dagligt i en varighed på 8 til 24 uger. Ved den laveste dosis på 140 mg dagligt, efter 8 uger, blev der set signifikante forbedringer i fastende blodglukose (FBG), lipidprofil og seruminsulinniveauer ud over ASAT-og ALAT-reduktioner fra 56 Til 37.Hhv.77 IE/L og 78, 73 Til 53, 05 IE/L.
berberin
berberin, den orangish-gule alkaloid, der findes i botaniske stoffer som Oregon drue rod og bark, goldenseal og barbær, er et andet botanisk afledt stof, der har adskillige mekanismer, hvormed det kan hjælpe med at beskytte mod NAFLD og understøtte dets opløsning.,,
de antidiabetiske og lipidbalancerende virkninger af berberin er blevet påvist i flere kliniske forsøg, og kan være midler, hvorigennem berberin påvirker leverfunktionen positivt. Berberin har vist sig at ændre metabolismerelateret genekspression og galdesyremetabolisme via veje, der også involverer FKSR. I dyreforsøg har berberin vist sig at have den virkning at forhindre HFD-associeret fedme og hepatisk triglyceridakkumulering i vildtype (normale) mus, men ikke hos dem, der havde den genetiske eliminering af intestinal ekspression. Berberin har også vist sig at undertrykke fedme-associeret inflammation og hepatisk steatose hos mus ved at nedsætte phosphorylering af det inflammatoriske kompleks kendt som JNK1, en proteinkinase impliceret i udviklingen af steatohepatitis. JNK1 aktiveres kraftigt af miljømæssige stressfaktorer og proinflammatoriske cytokiner.
kan være midler, hvorigennem berberin påvirker leverfunktionen positivt. Berberin har vist sig at ændre metabolismerelateret genekspression og galdesyremetabolisme via veje, der også involverer FKSR. I dyreforsøg har berberin vist sig at have den virkning at forhindre HFD-associeret fedme og hepatisk triglyceridakkumulering i vildtype (normale) mus, men ikke hos dem, der havde den genetiske eliminering af intestinal ekspression. Berberin har også vist sig at undertrykke fedme-associeret inflammation og hepatisk steatose hos mus ved at nedsætte phosphorylering af det inflammatoriske kompleks kendt som JNK1, en proteinkinase impliceret i udviklingen af steatohepatitis. JNK1 aktiveres kraftigt af miljømæssige stressfaktorer og proinflammatoriske cytokiner.
berberin virker også i tarmen. Det påvirker ikke kun tarmens mikrobielle balance, men påvirker også direkte tarmpermeabilitet og forbedrer tæt krydsintegritet hos dyr, der er udsat for endotoksæmi eller cellekulturer behandlet med proinflammatoriske cytokiner., Direkte antiinflammatoriske virkninger er også blevet påvist.
fordelene ved berberin i NAFLD er også blevet påvist klinisk i et randomiseret, parallelt kontrolleret, åbent klinisk forsøg. Hos patienter med NAFLD viste berberin sig at genoprette normal leverarkitektur, lipid og blodsukkermetabolisme med signifikante forbedringer set over befolkningen, der kun implementerede livsstilsændringer.
probiotika
i betragtning af forholdet mellem de mange fordøjelsessystemforstyrrelser og leverforhøjelse er det ikke overraskende, at probiotika også er blevet undersøgt som en behandling for NAFLD. En nylig metaanalyse opsummerer godt de kollektive fund.
et hundrede fireogtredive patienter diagnosticeret med Nafl/NASH ved leverbiopsi blev inkluderet i denne analyse, og hver intervention anvendt i de fire randomiserede, kontrollerede forsøg, der var berettiget til denne metaanalyse, var unik (Lactobacillus bulgaricus og Streptococcus thermophilus i tre måneder; Lactobacillus GG i otte uger; Bifidobacterium longum og fructooligosaccharider (FOS) i 24 uger; og en proprietær kombination af Lactobacillus plantarum, L. delbrueckii, L. acidophilus, L. rhamnosus og Bifidobacterium bifidum i seks måneder). Doseringen af probiotika varierede fra 500 millioner til 12 milliarder kolonidannende enheder (CFU ‘ er) dagligt. De probiotiske behandlinger viste sig at reducere ALAT-og AST-niveauerne signifikant med henholdsvis -23,71 UI/L og -19,77 UI/L. Signifikante forbedringer i total cholesterol, tumornekrosefaktor (TNF)-kur-niveauer og insulinresistens blev også noteret.
to yderligere kliniske forsøg undersøgte probiotika som behandling for pædiatrisk NAFLD. I en dobbeltblind, placebokontrolleret pilotundersøgelse, tolv børn, der har en gennemsnitlig alder på 10 år.7 år gammel med ultralyddiagnosticerede fedtleverændringer og vedvarende transaminaseforhøjelse fik 12 milliarder CFU ‘ er af L. rhamnosus GG eller placebo dagligt i 8 uger. Behandling med probiotikum reducerede alat-niveauer signifikant sammenlignet med placebo, men leverekogenicitet og asat-niveauer ændrede sig ikke. Derudover faldt anti-peptidoglycan-polysaccharidantistoffer, en indikator for bakterier eller bakteriel membrantranslokation gennem tarmbarrieren, signifikant hos børn, der fik probiotikumet sammenlignet med placebo. Den anden undersøgelse undersøgte behandling af børn, der havde biopsibevist NAFLD med VSL #3, en blanding med høj styrke af 8 probiotiske stammer (inklusive Streptococcus thermophilus, 3 Bifidobacteria spp. og 4 Lactobacillus spp.sammenlignet med placebo. Hos børn, der fik det probiotiske, blev fedtleverscore signifikant forbedret med sandsynligheden for, at ingen, let, moderat eller svær Fedtlever i slutningen af undersøgelsen var 21%, 70%, 9% og 0% sammenlignet med 0%, 7%, 76% og 17% i placebogruppen.
konklusion
der er en bred vifte af sikre og effektive muligheder, der understøtter genoprettelsen af sundhed hos dem med NAFLD. Selvom hver enkelt person kan have forskellige underliggende mekanismer, der bidrager til leverdysfunktion og inflammatoriske ændringer, kan hver af disse understøttende naturlige stoffer—og mange andre (Se tabel 2)—understøtte normal leverfunktion hos personer med disse udfordringer.
tabel 2: ernæringsmæssige og botaniske interventioner for NAFLD. Næringsstoffer som disse bør anvendes under vejledning af en kvalificeret og autoriseret sundhedsperson.
| næringsstof | dosering | mekanisme |
| phosphatidylcholin (PC), en kilde til diætcholin | 1, 5 g to gange dagligt med måltider (PC) eller 200 mg to gange dagligt (cholin) | cholin er en almindelig diætmangel. PC er nødvendig for produktion af galde og beskyttende gastrointestinal slimhinde barriere. |
| mælketistelfrø | 140 til 200 mg en gang til tre gange dagligt | hepatoprotektiv. Understøtter hepatiske glutathionniveauer, stabiliserer galdesalteksportpumpe (BSEP) og aktiverer FEKSR-veje. |
| berberin HCl | 500 mg to til tre gange dagligt | forbedrer serumglukose-og lipidprofiler, hvilket også reducerer leverfedtindholdet. |
| probiotika, herunder stammer som B. longum, B. bifidum, S. thermophilus, L. rhamnosus, L. acidophilus og L. plantarum | 12 milliarder kolonidannende enheder (CFU ‘ er) dagligt | forbedret tarmepitelbarrierefunktion og reduceret tarm-og systemisk inflammation. |
| Acetyl-glutathion | 300 mg dagligt | forbedrer afgiftende evne af hepatocytter. |
| N-acetylcystein (NAC) | 500-600 mg to gange dagligt, bedst taget på tom mave | NAC blokerer udbredelsen af lipid peroksidering og understøtter hepatiske glutathionniveauer. |
| E-Vitamin (tocopheroler)
eller tocotrienoler |
400 til 1200 IE dagligt med mad
200 til 300 mg to gange dagligt med mad |
beskyttende antioksidant.
tocotrienoler dæmper triglyceridakkumulering ved at regulere fedtsyresyntase og carnitinpalmitoyltransferase, hvilket fører til en reduktion af leverbetændelse og endoplasmatisk retikulumspænding. |
| Omega-3 essentielle fedtsyrer | 2 – 4 g dagligt med måltider | Omega-3 flerumættede fedtsyrer er kendt for at nedregulere sterolregulerende elementbindende protein-1c og opregulere peroksisom proliferatoraktiveret receptor alfa, hvilket favoriserer fedtsyreoksidering og reducerer steatose. |