introduktion
Peyronies sygdom (PD) er en lokaliseret, sårhelende, bindevævssygdom i penis, der er kendetegnet ved ardannelse i tunica albuginea. Dette fibrøse uelastiske ar fører til penis smerter, penis deformitet og erektil dysfunktion (ED) med vanskeligheder med at udføre coitus. Francois De La Peyronie beskrev først tilstanden i 1743, mens han var kirurg for Louis. Selvom tidligere undersøgelser rapporterede en forekomst på 0,3-0,7%, har nylige publikationer vist en samlet forekomst på 3,2–8,9%, Hvor mere end 75% af tilfældene forekom hos mænd mellem 45 og 65 år (1,2). Det bemærkes, at 10% af patienterne oplever symptomdebut før 40 år (2). Desuden rapporteres forekomsten af PD efter radikal prostatektomi at være så høj som 15,9%, og en nylig undersøgelse viste, at penis krumning er et almindeligt fund (38,6%) på tidspunktet for Oppustelig penisproteseimplantationskirurgi for ED efter prostatacancerbehandling (3,4).
behandlingen af PD begynder med en fokuseret historie og fysisk eksamen. En detaljeret historie skal vurdere oplysninger om sygdommens begyndelse og varighed, tilknyttet traumatisk etiologi, grad af penis krumning, tab af længde under erektion og subjektivt niveau af seksuel funktion. Med hensyn til subjektiv seksuel evaluering, standardiserede spørgeskemaer såsom Det internationale indeks for erektil funktion (IIEF) giver mulighed for objektive og subjektive indledende vurderinger og et værktøj til måling af effektivitet under behandlingen. Fysisk undersøgelse af det genitourinære system bør omfatte penis længde mens strakt, plak placering og størrelse. Krumningsgraden kan vurderes af patienten, der tager fotografier af den oprejste fallus eller ved vasoaktive injektioner i kombination med Doppler-ultralyd med penis dupleks.
forståelse af PD ‘ s naturlige historie og patogenese er vigtig for at vælge passende behandlingsregimer. Mens patofysiologien ikke forstås fuldstændigt, antages det, at den tilskyndende begivenhed er en subklinisk traumatisk tåre til tunica albuginea. Tåren fører til en proliferativ fibrotisk reaktion, hvilket resulterer i et uelastisk ar. Behandlingen af PD adskilles i dem inden for den akutte fase og dem i den kroniske stabiliseringsfase. Den akutte fasetid defineres løst som mindre end 12 måneder fra symptomdebut. I løbet af denne tid fortsætter patientens ar med at ændre og ændre sig. Den kroniske fase bestemmes, når patientens krumning har været stabil i mindst 6 måneder. Mens kirurgisk behandling forbliver guldstandarden for PD, tilbydes den for det meste mænd i den kroniske fase af sygdommen. For de patienter i den akutte fase giver farmakoterapi potentialet til at forbedre funktionen, reducere deformitet og stabilisere arprogression (5). Heri gennemgår vi den aktuelle tilgængelige viden om orale behandlingsmuligheder for PD. Det er vigtigt at bemærke, at mens visse anbefalinger, der er anført, er baseret på evidensbaserede fund; andre afspejler ekspertudtalelse (tabel 1).

fuld tabel
Kaliumpara-aminoat (POTABA)
POTABA er en forbindelse kendt for sine antifibrotiske og antiinflammatoriske egenskaber, der hjælper med behandling af fibrotiske lidelser såsom dermatomyositis og sklerodermi. Dens effektivitet menes at skyldes en reduktion i kollagendannelse via faldende serotoninniveauer, stigende monoaminoksidaseaktivitet og hæmning af fibroblast glycosaminoglycansekretion (6). Den første foreslåede anvendelse af POTABA til behandling af PD var i 1959 af Sarafonetis og Horraks (7). I 2005, et al. udført et multicenter, randomiseret, dobbeltblindt placebokontrolleret forsøg med POTABA (51 patienter) versus placebo (52 patienter) i behandling na-patienter med ikke-forkalket plak. Forsøgsarmen modtog 3 g POTABA oralt, 4 gange om dagen i 12 måneder. Efter 12 måneder havde patienter på POTABA signifikant forbedring i penisplakstørrelse sammenlignet med dem, der fik placebo. Derudover blev patienter, der fik placebo, bemærket at have forværring af deres krumning. Forfatterne konkluderede, at POTABA kan hjælpe med stabilisering af arvæv, hvilket ville forhindre progression af krumning (6). Der har ikke været yderligere randomiserede kontrolforsøg for at evaluere effektiviteten af POTABA. Dette skyldes måske dets bivirkningsprofil, som omfatter gastrointestinal lidelse, diarre, akut hepatitis og hypoglykæmi (8).
E-Vitamin
E-Vitamin, et fedtopløseligt antioksidant, inaktiverer frie radikaler, der mætter salpetersyre (NO) og derved holder aktive no-niveauer forhøjede for at muliggøre korrekt sårheling. Ved at begrænse oksidativ stress giver det potentielt også en antiinflammatorisk effekt. Det blev først beskrevet til behandling af PD i 1948 (9) og på grund af dets lave omkostninger og tilgængelighed forbliver det hyppigst ordinerede orale middel til PD (10). På trods af dets anvendelse i løbet af de sidste syv årtier har flere placebokontrollerede designs ikke vist nogen signifikant forbedring i smerte, krumningsgrad, plakstørrelse eller evne til at have samleje. I 1983 afsluttede Pryor og Farrell et dobbeltblindt, placebokontrolleret forsøg med E-vitamin hos 40 PD-patienter og fandt ingen signifikant forbedring i plakstørrelse eller penis krumning (11). Desuden en nyere undersøgelse i 2007 af Safarinejad et al. forudsat det største forsøg til dato evaluering af E-vitamin til PD. Forfatterne sammenlignede E-vitamin alene og i kombination med L-carnitin til placebo hos 236 mænd med tidlig kronisk PD; klassificeret som patient med smerter under erektioner, peniskrumning, der ikke forstyrrer vaginal penetration, ikke-smertefuldt håndgribeligt ar, hyperechoisk læsion ved penile ultralyd, fravær af forkalkning og total plakareal <2 cm2. Gruppe 1 (58 mænd) modtog E-vitamin 300 mg oralt to gange dagligt. Gruppe 2 (59 mænd) modtog propionyl-L-carnitin, 1 g oralt to gange om dagen. Gruppe 3 (60 mænd) modtog E-vitamin 300 mg oralt to gange dagligt samt propionyl-L-carnitin 1 g oralt to gange dagligt. Endelig fik gruppe 4 et lignende placebo-regime i løbet af 6-måneders forsøgsperioden. Efter behandling var der ingen signifikant ændring i reduktion af penis krumning mellem de fire grupper (P=0,9) eller noget fald i plakstørrelse (P=0,1) (12).
på trods af manglende beviser, der beviser E-vitamin-effektivitet, ordineres det stadig ofte og gives ofte samtidig med andre behandlingsmetoder med håb om en synergistisk rolle. Almindelige bivirkninger ved brug af E-vitamin omfatter kvalme, opkastning, diarre og øget risiko for prostatacancer og cerebrovaskulære hændelser (13).
colchicin
selvom colchicin mest er kendt for sin behandling af gigt, udviser den også egenskaber, der hjælper med behandlingen af PD. Colchicin depolymeriserer tubulin og hæmmer derved cellemitose, leukocytadhæsion og kollagentransport. Anvendelse af denne egenskab bør colchicin teoretisk mindske sårkontraktion ved at hæmme kollagenaflejring (14). De fleste undersøgelser, der evaluerer colchicin, har beskrevet en vis forbedring i krumning, men disse undersøgelser blev ikke randomiseret, og de gav heller ikke objektiv måling til definition af forbedring. Safarinejad et al. viste sig at være et af de få forsøg, der evaluerede de terapeutiske virkninger af colchicin ved at gennemføre et enkelt center, randomiseret, dobbeltblindt, placebokontrolleret forsøg med 84 PD-patienter uden forkalkede plaketter (15). Patienter i colchicin-armen blev behandlet med 0,5-2,5 mg colchicin dagligt i 4 måneder. Ved afslutningen af forsøget viste colchicin-gruppen ikke objektiv forbedring i penis krumning eller plakstørrelse. Andre undersøgelser har evalueret de synergistiske virkninger af colchicin med vitamin E. Prieto Castro et al. rapporteret signifikant forbedring i plakstørrelse og penis krumning hos patienter, der bruger daglig E-vitamin og colchicin sammenlignet med ibuprofen alene (16). Bemærk, at der kun var 45 patienter i dette forsøg, og der var ingen placebo-arm. En efterfølgende retrospektiv undersøgelse af 100 mænd afslørede imidlertid ingen statistisk signifikante forskelle i effekt til smertelindring, penis krumning eller plakstørrelse mellem colchicin og colchicin kombineret med E-vitamin (17).
Tamoksifen
Tamoksifen er en non-steroide østrogenreceptorantagonist. Ved behandling af PD har det vist sig at formindske fibrogenese i tunica albuginea via modulering af frigivelsen af TGF-karrus frigivet fra fibroblast (18). Ralph et al. først foreslog sin behandling i 1992 som et resultat af en ukontrolleret undersøgelse, der viste forbedring i penis deformitet for 11 ud af 31 mænd. Disse fund var imidlertid ikke reproducerbare, når tamoksifen blev evalueret i et prospektivt, placebokontrolleret forsøg med 25 patienter med PD uden forkalkede plakker. På trods af brugen af 20 mg tamoksifen to gange dagligt var der ingen signifikant forbedring i smerte, krumning eller plakstørrelse sammenlignet med placebo (19).
carnitin
carnitin er en hæmmer af acetyl-Coen-A, der muliggør reduktion af dannelse af frie radikaler i tider med cellestress. I 2001 Biagiotti et al. udført et randomiseret forsøg med 96 PD patienter til L-carnitin versus tamoksifen. Resultaterne viste signifikant forbedring af penis krumning i L-carnitingruppen (20). Som nævnt viste Safarinejad 2007 4-arm forsøg (vitamin E, carnitin, vitamin E og carnitin og placebo) ingen signifikant forbedring i penis krumning, plakstørrelse eller smerte (12).
Omega 3 fedtsyre
i lighed med andre orale midler er omega-3 fedtsyrer blevet evalueret i behandlingen af PD på grund af dets kendte antiinflammatoriske egenskaber. I 2009 Safarinejad et al. offentliggjort deres resultater på en prospektiv, randomiseret dobbeltblind omega-3 fedtsyrer versus placebo forsøg. I alt 224 patienter med tidligt kronisk stadium PD blev randomiseret til 1.84 g daglig omega – 3-tilskud versus placebo i 6 måneder. Patienterne blev vurderet med IIEF-5 og PDDU før og efter de 6 måneders medicin. Desværre var der ingen signifikant forbedring med hensyn til plakvolumen, penis krumning, smerter under erektion og erektil funktion (21). I øjeblikket mangler der data, der understøtter en gavnlig effekt af omega-3-tilskud i det tidlige kroniske stadium af PD.
Prokarbasin
Prokarbasin er et alkylerende kemoterapimedicin, der ofte bruges til behandling af CNS-lymfom, Hodgkins lymfom og gliomer af høj kvalitet. I 1968 Aron et al. bemærkede en regression af Dupuytrens sygdom hos patienter, der gennemgår behandling af Hodgkins sygdom med prokarbasin, hvilket antyder dets anvendelse i en sygdom med proliferation af bindevæv (22). Med denne forudsætning, i 1970 ‘ erne, foreslog Bystr Kristm prokarbasin til behandling af PD, men efterfølgende undersøgelser afslørede ingen objektiv fordel. Derudover afslørede undersøgelser signifikante bivirkninger af den cytotoksiske medicin, og det blev anbefalet ikke at blive brugt i den godartede sygdom i PD. Bivirkninger omfatter myelosuppression, hepatotoksicitet, træthed, GI-lidelse og CNS-forstyrrelser (23,24).
Phosphodiesterase type 5-hæmmere (PDE-5-hæmmere)
selvom PDE-5-hæmmere almindeligvis betragtes som en behandling for ED, har nylige undersøgelser vist dets potentielle anvendelse til behandling af PD hos patienter med eller uden ED. PDE – 5-hæmmere øger cyklisk guanosinmonophosphat (cGMP) ved at hæmme nedbrydningen af cGMP til GMP. Med stigningen i cGMP og NO hæmmes kollagensyntese og aflejring, og der opstår apoptose af fibroblast og myofibroblast (25). På grund af denne egenskab kan PDE-5-hæmmere vise sig at være fordelagtige ved ombygning af ar. I en rottemodel af PD viste sildenafil sig at forårsage signifikant reduktion i kollagen-til-fibroblastforholdet i tunica albuginea såvel som plakstørrelse (25). Chung og kolleger studerer brugen af tadalafil til behandling af PD hos mennesker. De rapporterede, at 2.5 mg tadalafil dagligt i 6 måneder resulterede i opløsning af septal ar hos 69% (24/35) af patienterne uden håndgribelig penile plak. Kun 10% af den ikke-behandlingsarm bemærkede opløsning af ar. Det er vigtigt at nævne, at septalarret ikke var klinisk håndgribeligt, og de fleste patienter i denne undersøgelse havde ikke krumning (26). For nylig rapporterede en undersøgelse fra 2014 behandlingsresultater hos patienter med PD, der brugte 50 mg sildenafil dagligt eller 400 IE E-vitamin i 3 måneder. Efter 12 uger viste begge grupper lignende reduktion i plakvolumen og penis krumning, der var statistisk signifikant. Forskellene mellem de to grupper var imidlertid ikke statistisk signifikante. Sildenafil-kohorten viste statistisk signifikant forbedring i IIEF-score og smertereduktion sammenlignet med E-vitamin alene (27). Et stort dobbeltblindt placebo-forsøg skal udføres og validere den kliniske fordel ved PDE-5-hæmmer, men den nuværende forskning er lovende (tabel 2).
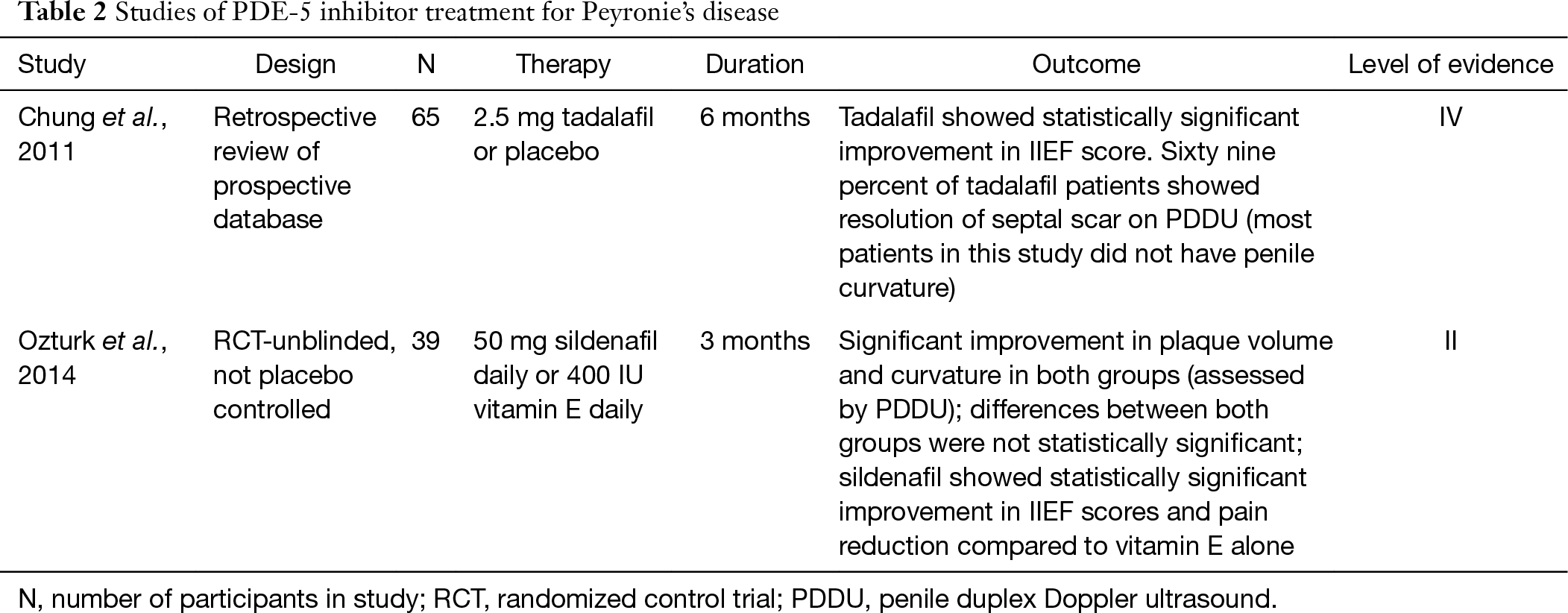
fuld tabel
L-arginin
L-arginin er en ingen forløber, der stimulerer ingen syntase. Dette medfører en stigning i NO, samt en reduktion i fibroblast på grund af apoptose. Disse to egenskaber menes at være mekanismerne bag L-arginin som et antifibrotisk middel (25). Som nævnt, Valente et al. evaluerede penisplakker i rottemodeller behandlet med PDE-5-hæmmere, men også med l-arginin. På samme måde som PDE-5-hæmmere udviste L-arginin signifikant reduktion i plakstørrelse såvel som kollagen til fibroblastforhold (25). En senere undersøgelse af Medeiros et al. demonstreret, at arginin også har en beskyttende virkning mod dannelse af arvæv, når man sender penis af rotter til bækkenstråling (28). I 2012 abern et al. bemærkede en tendens mod krumningsforbedring hos PD-patienter behandlet med penile trækkraftbehandling i forbindelse med intralesional verapamil, oral L-arginin og oral pentoksifyllin (29). Mens denne undersøgelse har adskillige variabler, der kan bidrage til krumningsforbedring, viser det sig at være et af de få humane forsøg, hvor L-arginin blev brugt til behandling af PD. I betragtning af disse fund kan L-arginin vise sig at være en værdifuld behandlingsmulighed for PD, men yderligere menneskelige forsøg er nødvendige.
Pentoksifyllin
selvom de fleste af de orale lægemidler, der er undersøgt til behandling af PD, har vist dårlige eller ubestemte resultater i kontrollerede studier, har PTK klaret sig meget bedre. Et derivat, der fungerer som en uspecifik phosphodiesterasehæmmer med kendte antiinflammatoriske og antifibrogene egenskaber (30). Det er blevet foreslået til behandling af PD på grund af en in vitro-undersøgelse, der viser, at det forhindrer tunica albuginea fibroblastproliferation, dæmper TGF-B-medieret aflejring af kollagen, reducerer aflejring af elastin og øger fibrinolytisk aktivitet (31-33). I betragtning af disse egenskaber forsøgte en dobbeltblind, placebokontrolleret undersøgelse fra 2010 at bestemme effekten af PTKS hos patienter med tidlig kronisk PD (30). To hundrede otteogtyve patienter blev randomiseret til at modtage 400 mg vedvarende frigivelse versus placebo i 6 måneder. De fleste deltagere havde undladt mindst en tidligere PD-behandling. Placebogruppen var 4 gange mere sandsynlig (42%) for at have sygdomsprogression sammenlignet med behandlingsarmen (11%). (I) forbedring i penis krumning målt ved dupleks ultralyd før og efter korporal injektion med prostaglandin E1; (II) plakvolumen og (III) IIEF-score (30). Nyere undersøgelser har evalueret oral pkt i forbindelse med orale antioksidanter, intralesional pkt og intralesional verapamil med varierende resultater (34,35). Mens PK fortsat er en stærk konkurrent til PD-behandling, skal yderligere store multicenterforsøg afsluttes for at sikre, at resultaterne er reproducerbare (tabel 3).

fuld tabel
konklusioner
på trods af årtiers PD-forskning er den endelige etiologi og patofysiologi ikke blevet fuldstændigt belyst. Mens kirurgisk terapi forbliver guldstandarden for kronisk svær PD, er der et utal af andre mindre invasive behandlingsmuligheder, nemlig oral og intralesional medicin. Heri, vi har gennemgået de mest almindeligt ordinerede eller diskuterede orale midler til behandling af PD. Selvom en række veldesignede undersøgelser har opdaget positive reaktioner med oral medicin, begrænser deres lille prøvestørrelse undersøgelsens styrke og reproducerbarhed. I øjeblikket, American Urological Association retningslinjer tilstand klinikere bør ikke tilbyde oral behandling med E-vitamin, tamoksifen, omega-3 fedtsyre eller kombination af E-vitamin med L-carnitin. Tilsvarende støttede Den Internationale høring om seksuel medicin fra 2010 ikke den rutinemæssige kliniske anvendelse af orale midler til PD (5). To orale lægemidler, der ikke er begrænset af retningslinjerne, er PDE-5-hæmmere og PTKS. Yderligere forskning på PDE – 5 og PTKS, for at inkludere store multicenter dobbeltblinde, randomiserede kontrolforsøg, er nødvendige for at bestemme deres effektivitet. Begge medicinklasser giver håb om fraværet af tilladte orale lægemidler til behandling af PD.
Anerkendelser
Ingen.
fodnote
interessekonflikter: forfatterne har ingen interessekonflikter at erklære.
- Mulhall JP, Creech SD, Boorjian SA, et al. Subjektiv og objektiv analyse af forekomsten af Peyronies sygdom hos en population af mænd, der præsenterer for screening af prostatacancer. J Urol 2004;171:2350-3.
- Mulhall JP, Schiff J, Guhring P. En analyse af den naturlige historie af Peyronies sygdom. J Urol 2006;175: 2115-8; diskussion 2118.
- Tal R, Heck M, Teloken P, et al. Peyronies sygdom efter radikal prostatektomi: forekomst og forudsigere. J Køn Med 2010; 7:1254-61.
- Lin H, Alba F, Romero C, et al. 1815 penis krumning er et almindeligt fund ved implantation af penisprotese for patienter med erektil dysfunktion efter radikal prostatektomi. J Urol 2011; 185: e728-e729.
- Ralph D, Mirone V, et al. Håndtering af Peyronies sygdom: evidensbaserede retningslinjer fra 2010. J Køn Med 2010; 7: 2359-74.
- Hauck y, Schnitker J, et al. Behandling af Peyronies sygdom: en prospektiv, placebokontrolleret, randomiseret undersøgelse. EUR Urol 2005;47:530-5; diskussion 535-6.
- CJ, TM. Behandling af Peyronies sygdom med kaliumparaminobensoat (potaba). J Urol 1959; 81: 770-2.
- Roy J, bærer S. akut hepatitis forbundet med behandling af Peyronies sygdom med kaliumparaminobensoat (Potaba). J Køn Med 2008; 5: 2967-9.
- Scott, Scardino PL. Et nyt koncept i behandlingen af Peyronies sygdom. Syd Med J 1948;41:173-7.
- Levine LA, Burnett AL. Standardprocedurer for Peyronies sygdom. J Køn Med 2013; 10: 230-44.
- Pryor JP, Farrell jf. Kontrolleret klinisk forsøg med E-vitamin i Peyronies sygdom. Prog Reprod Biol 1983; 9: 41-5.
- Safarinejad MR, Hosseini SY, Kolahi AA. Sammenligning af E-vitamin og propionyl-L-carnitin, separat eller i kombination, hos patienter med tidlig kronisk Peyronies sygdom: en dobbeltblind, placebokontrolleret, randomiseret undersøgelse. J Urol 2007;178:1398-403; diskussion 1403.
- Klein EA, Thompson IM Jr, Tangen CM, et al. E-Vitamin og risikoen for prostatakræft: selen-og e-Vitaminforebyggelsesforsøg (SELECT). JAMA 2011; 306: 1549-56.
- El-Sakka AI, Bakircioglu ME, Bhatnagar RS, et al. Virkningerne af colchicin på en Peyronies-lignende tilstand i en dyremodel. J Urol 1999;161: 1980-3.
- Safarinejad Mr. terapeutiske virkninger af colchicin i håndteringen af Peyronies sygdom: En randomiseret dobbeltblind, placebokontrolleret undersøgelse. Int J Impot Res 2004; 16: 238-43.
- Prieto Castro RM, Leva Vallejo ME, Regueiro Lopes JC, et al. Kombineret behandling med E-vitamin og colchicin i de tidlige stadier af Peyronies sygdom. BJU Int 2003; 91: 522-4.
- Cort Cortus JR., Glina S. konservativ behandling af Peyronies sygdom: colchicin vs. colchicin plus vitamin E. Actas Urol Esp 2010;34:444-9.
- Ralph DJ, Brooks MD, GF, et al. Behandling af Peyronies sygdom med tamoksifen. Br J Urol 1992; 70: 648-51.
- Teloken C, Rhoden EL, TM, et al. Behandling af Peyronies sygdom. J Urol 1999; 162: 2003-5.
- Biagiotti G, Cavallini G. Acetyl-L-carnitin vs tamoksifen i oral terapi af Peyronies sygdom: en foreløbig rapport. BJU Int 2001; 88: 63-7.
- Safarinejad Mr. effekt og sikkerhed af omega-3 til behandling af tidlig fase Peyronies sygdom: en prospektiv, randomiseret, dobbeltblind placebokontrolleret undersøgelse. J Køn Med 2009; 6: 1743-54.
- Aron E. medicinsk behandling af Dupuytrens sygdom med et cytostatisk middel (methylhydrasin). Presse Med 1968; 76: 1956.
- Bystrr Larsm J, Johansson B, Edsmyr F, et al. Induratio penis plastica (Peyronies sygdom). Resultaterne af de forskellige former for behandling. Scand J Urol Nephrol 1972; 6: 1-5.
- Oosterlinck H, gør G. behandling af Peyronies sygdom med prokarbasin. Br J Urol 1975;47:219-20.
- Valente EG, Vernet D, Ferrini MG, et al. L-arginin og phosphodiesterase (PDE) hæmmere modvirker fibrose i Peyronies fibrotiske plak og relaterede fibroblastkulturer. 2003; 9: 229-44.
- Chung E, Deyoung L, Brock GB. PDE5-hæmmernes rolle i ombygning af penis septal ar: vurdering af kliniske og radiologiske resultater. J Køn Med 2011; 8:1472-7.
- Okturk U, Yesil S, Goktug HN, et al. Virkninger af sildenafilbehandling på patienter med Peyronies sygdom og erektil dysfunktion. Ir J Med Sci 2014; 183: 449-53.
- Medeiros Jl Jr, Costa vs. Beskyttende virkninger af ernæringstilskud med arginin og glutamin på penis hos rotter, der udsættes for bækkenstråling. Andrologi 2014; 2: 943-50.
- Abern MR, Larsen S, Levine LA. Kombination af penis trækkraft, intralesional verapamil og oral terapi for Peyronies sygdom. J Køn Med 2012; 9: 288-95.
- Safarinejad MR, Asgari MA, Hosseini SY, et al. En dobbeltblind placebokontrolleret undersøgelse af effekt og sikkerhed af pentoksifyllin ved tidlig kronisk Peyronies sygdom. BJU Int 2010; 106: 240-8.
- Raetsch C, Jia JD, Boigk G, et al. Profibrogene cytokiner og prokollagen i-ekspression nedreguleres ved sekundær biliær fibrose hos rotter. Tarm 2002; 50: 241-7.
- Schanden L, Vandenbussche P, Crusiauks A, et al. Differentielle virkninger af pentoksifyllin på produktionen af tumornekrosefaktor-alfa (TNF-alfa) og interleukin-6 (IL-6) af monocytter og T-celler. Immunologi 1992; 76: 30-4.
- Shindel av, Lin G, Ning H, et al. Pentoksifyllin dæmper transformerende vækstfaktor-kurr1-stimuleret kollagenaflejring og elastogenese i humane tunica albuginea-afledte fibroblaster del 1: indvirkning på ekstracellulær matrice. J Køn Med 2010; 7: 2077-85.
- Paulis G, Barletta D, Turchi P, et al. Effekt – og sikkerhedsevaluering af pentoksifyllin forbundet med andre antioksidanter til medicinsk behandling af Peyronies sygdom: en case-control-undersøgelse. Res Rep Urol 2015; 8: 1-10.
- Alisadeh M, Karimi F, Fallah MR. evaluering af verapamils virkning ved Peyronies sygdom sammenlignet med pentoksifyllin. Glob J Sundhed Sci 2014; 6: 23-30.
- Smith JF, Shindel, Huang YC, et al. Behandling af penile forkalkninger hos mænd med Peyronies sygdom. Asiatisk J Androl 2011;13:322-5.