introduktion
spændingsstyrede kaliumkanaler danner en stor og forskelligartet familie, der evolutionært bevares. Der er 40 humane spændingsstyrede kaliumkanalgener, der tilhører 12 underfamilier. Disse kV-kanaler viser brede fordelinger i nervesystemet og andre væv. For spændende celler som neuroner, kardiomyocytter og muskler regulerer KV-kanaler bølgeformen og fyringsmønsteret for handlingspotentialer. KV-kanaler kan også regulere cellevolumen, proliferation og migration af en lang række celletyper.
spændingsstyrede kaliumkanaler (KV) tilhører en af de største og meget evolutionært konserverede ionkanalfamilier . Hver kV-kanal indeholder fire lignende eller identiske poredannende poreenheder, og den kan også indeholde hjælpeenheder, der kan påvirke kanalfunktionen og/eller lokaliseringen . Hver poreformende underenhed af KV-kanaler indeholder seks transmembrane segmenter (S1-S6), hvor de første fire transmembrane segmenter (S1-S4) udgør spændingssensoren og de sidste to transmembrane segmenter flankerer en poresløjfe (S5-P-S6) som poredomæne. Ud over kromosomplaceringen af hvert KV-kanalgen i menneske, mus og rotte er kanalens fysiologiske og farmakologiske egenskaber og dens vævsfordeling og patofysiologi leveret af Ionkanaldatabasen af Underudvalget om spændingsstyrede kaliumkanaler fra Nomenklaturudvalget for International Union of Pharmacology (NC-IUPHAR). Denne artikel præsenterer en introduktion til mangfoldigheden og funktionerne i spændingsstyrede kaliumkanaler.
evolutionær bevarelse af kaliumkanaler
K+-selektiviteten, der opstod i prokaryoter, bevares i et stort antal kaliumkanaler med bemærkelsesværdig mangfoldighed . Som vist i Figur 1, et evolutionært træ af den spændingsstyrede kationkanal superfamilie kan foreslås baseret på sammenligningen af kanalgener i det menneskelige genom med dem i genomerne fra andre metasoere inklusive mus, kylling, pufferfisk, tunikat, frugtflue, myg, nematode og havanemone . Dette evolutionære træ forestiller sig en enkelt Oprindelse af K+ – selektiviteten til indadrettet kalium (Kir) kanaler, spændingsstyrede kalium (KV) kanaler og to-porekalium (K2P) kanaler. Det er dog vigtigt at bemærke, at en tydelig K+-selektivitet sandsynligvis er forbundet med den evolutionært konserverede organelle K+ kanal, der ligger i endosomer og lysosomer .
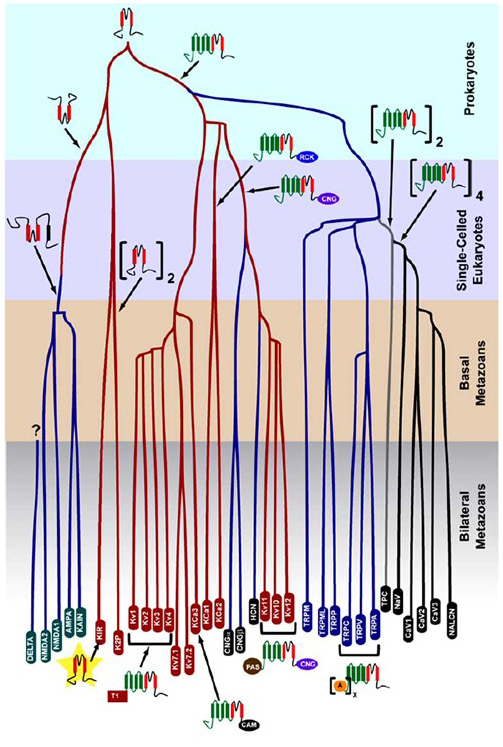
Figur 1. Et evolutionært træ til tilblivelsen af den spændingsstyrede kationkanal superfamilie. Baseret på genom-dækkende analyser af ionkanaler fra cnidarians og bilaterale metaser , skildrer dette evolutionære træ en fælles oprindelse for K+-selektiviteten af kaliumkanaler (med familienavne i røde ovaler), som er relateret til tetramer cyklisk nukleotid-gated kation (CNG) kanaler, hyperpolariseringsgated kation (HCN) kanaler og TRP kanaler, de dimeriske TPC kanaler og monomer Na+, Ca2+ og NALCN kanaler. Grenlængderne afspejler ikke tid. Genfamilienavnene i bunden markerer individuelle grene. Ionotrope glutamatreceptorer er inkluderet baseret på hypotesen om, at de stammer fra en inversion af det kaliumkanalporedannende domæne med to transmembrane segmenter (rød). Spændingsfølerdomænet har fire transmembrane segmenter (grøn). A: ankryin gentager; CAM: calmodulin-bindende domæne; CNG: cyklisk nukleotidbindende domæne; PAS: Per-ARNT-Sim-domæne; RCK: regulator for konduktans af K+ domæne; T1: tetrameriseringsdomæne.
mangfoldighed af spændingsstyrede kaliumkanaler
det humane genom indeholder ~80 kaliumkanalgener, hvoraf 40 gener koder for spændingsstyrede kaliumkanalporedannende underenheder, der falder i 12 underfamilier (Fig. 2). Fysiologisk opdelt i a-type kaliumkanaler, der viser hurtig inaktivering og forsinkede ensretterkaliumkanaler uden hurtig inaktivering, er disse KV-kanaler molekylært og funktionelt forskellige. Hurtig inaktivering, som kan påvirke handlingspotentialets varighed under gentagen fyring, er tydelig i KV1-kanaler, der indeholder KV1.4 eller kV-K1, KV3-kanaler og KV4-kanaler . Den forsinkede ensretterkaliumstrøm, der oprindeligt var kendetegnet ved Hodgkin og Huoksley for sin rolle i handlingspotentialet, svarer sandsynligvis til blæksprutte KV1-kanalerne, der kan stole på RNA-redigering for at opnå den fleksible funktionelle mangfoldighed, da mange små aksoner af de gigantiske fiberlapneuroner smelter sammen for at danne blæksprutte-gigantaksonet med større handlingspotentiale ledningshastighed .
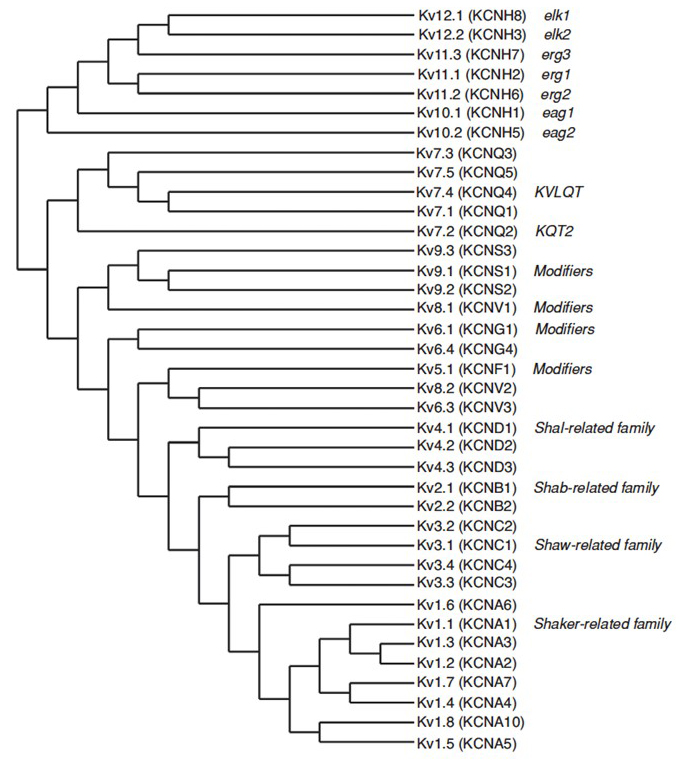
figur 2. Fylogenetisk træ til KV1 – 12 familierne. Dette fylogenetiske træ genereres baseret på analyser af det hydrofobe domæne, der indeholder de seks transmembransegmenter (S1-S6) . Både IUPHAR og HGNC (i parentes) navne vises sammen med andre almindeligt anvendte navne til disse spændingsstyrede kaliumkanaler.
bemærkelsesværdig mangfoldighed af KV-kanaler kan opnås på grund af blanding og match af KV-kanalunderenheder. Inden for hver af KV1 -, KV2 -, KV3 -, KV4-og KV7-familierne kan homomere og heteromere kanaler dannes med en række funktionelle egenskaber . KV2 familiemedlemmer kan også samles med KV5, KV6 , KV8 eller KV9 familiemedlemmer med mere begrænsede udtryksmønstre i nervesystemet og glatte muskler, som illustreret skematisk i Fig. 3.

figur 3. KV kanal mangfoldighed via blanding og match af poreformende kanal underenheder. (A) de tetrameriske KV-kanaler med forskellige egenskaber og distribution omfatter homomere KV1 -, KV2 -, KV3 -, KV4-og KV7-kanaler, heteromere kanaler dannet af forskellige medlemmer inden for hver af disse kV-kanalfamilier og heteromere kanaler dannet ved samling af KV2-familiemedlemmer med KV5 -, KV6 -, KV8-eller KV9-familiemedlemmer . KV5 -, KV6 -, KV8-og KV9-familier giver anledning til homomere kanaler, der sandsynligvis er elektrisk tavse på grund af deres tilbageholdelse i det endoplasmatiske retikulum, derfor kaldes de KVS. B) samling af KV2 – og KVS-familiemedlemmer involverer deres cytoplasmatiske n-og C-terminale domæner. (C, D) samling af KV2-og KVS-familiemedlemmer giver anledning til heteromere kanaler med forskellig spændingsafhængighed (C) og gatingmekanismer (D) sammenlignet med homomere kanaler dannet af KV2-familiemedlemmer .
funktionelle forskelle i spændingsafhængighed og kinetik af KV-kanaler ligger til grund for deres differentielle Bidrag til handlingspotentialemodulation (Fig. 4). Mens KV1 -, KV4-og KV7-kanaler kræver lave niveauer af membran depolarisering for deres aktivering, aktiveres KV2-og KV3-kanaler ved større depolarisering. De tidligere, LAVSPÆNDINGSAKTIVEREDE KV-kanaler kan påvirke tærsklen for aktionspotentialegenerering og antallet af handlingspotentialer genereret under depolarisering eller stimulerende synaptiske potentialer. I modsætning hertil kan de højspændingsaktiverede KV-kanaler modulere handlingspotentialets varighed og fyringsmønster . Kinetikken af KV-kanaler påvirker også de måder, de bidrager til aktionspotentialegenerering. Mens de LAVSPÆNDINGSAKTIVEREDE KV1-kanaler med hurtig aktivering kan påvirke handlingspotentialets tærskel og bølgeform, kan de HØJSPÆNDINGSAKTIVEREDE KV3-kanaler og KV2-kanaler aktiveres sekventielt under et handlingspotentiale på grund af forskellen i deres aktiveringskinetik, og KV2-kanaler kan have mere langvarige effekter på grund af deres langsomme inaktiveringskinetik. Desuden kunne KV4-kanaler med hurtig inaktivering bidrage til forskellen i handlingspotentialets bølgeform under gentagen fyring på grund af undertrykkelse af KV4-kanalaktiviteten ved depolarisering .
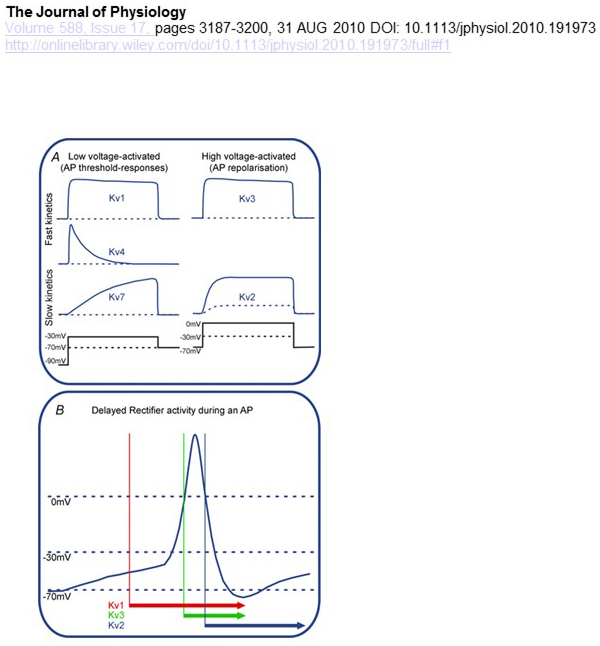
figur 4. Funktionelle forskelle mellem KV-kanaler og deres bidrag til handlingspotentialet. (A) Forskellige kV-kanaler har forskellig spændingsafhængighed for aktivering og forskellig kinetik . (B) de LAVSPÆNDINGSAKTIVEREDE KV1-kanaler med hurtig kinetik åbnes, når cellen depolariseres mod tærsklen for aktionspotentialegenerering. Mens både KV2-og KV3-kanaler er højspændingsaktiverede, åbner KV3-kanaler hurtigere end KV2-kanaler under et handlingspotentiale. KV2-kanaler kan også tage længere tid at lukke efter et handlingspotentiale .
potentielle terapeutiske anvendelser af kaliumkanalmodulatorer
kaliumkanalmodulatorers evne til at ændre handlingspotentielle fyringsmønstre har rejst spørgsmålet om, hvorvidt de kan være af terapeutisk værdi . Som angivet i Fig. 5 kan forskellige neurologiske og psykologiske lidelser involvere ændringer i handlingspotentialet fyringsmønstre, som kunne moduleres af KV-kanalaktivatorer og blokkere . Spændingsstyrede kaliumkanaler kan også spille en rolle i celleproliferation og migration; KV-kanalmodulatorer er derfor blevet overvejet for potentielle behandlinger af kræftvækst og metastase . I Fig. 6 anvendes KV1.2-kanalstrukturen skematisk til at illustrere, at KV-kanalmodulatorer kan hæmme kanalaktiviteten enten ved at okkludere kanalgennemtrængningsvejen, som i tilfældet med ydre poreblokerende toksiner og indre poreblokkere, eller via deres interaktion med spændingssensoren for at stabilisere kanalens lukkede tilstand, som i tilfældet med gating modifier toksiner. Alternativt virker nogle små molekyler ved at binde til gatingmaskineriet som gatingmodifikatorer eller ved at interagere med grænsefladen mellem de røde og røde underenheder for at ændre kanalaktivitet .
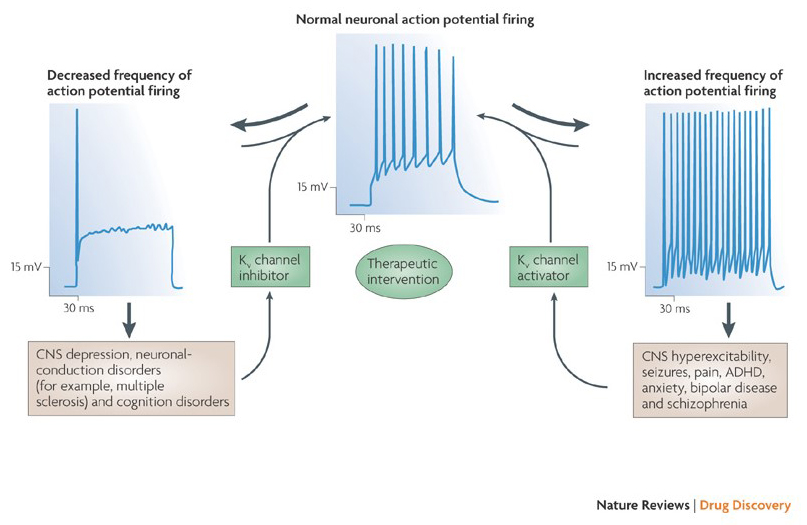
figur 5. Potentielle anvendelser af KV-kanalmodulatorer. Fordi unormale handlingspotentielle fyringsmønstre har været forbundet med sygdomme såsom epilepsi og multipel sklerose, KV-kanalaktivatorer og hæmmere er blevet overvejet for potentielle terapeutiske behandlinger af sygdomme, der involverer ændring af neuronal ophidselse .
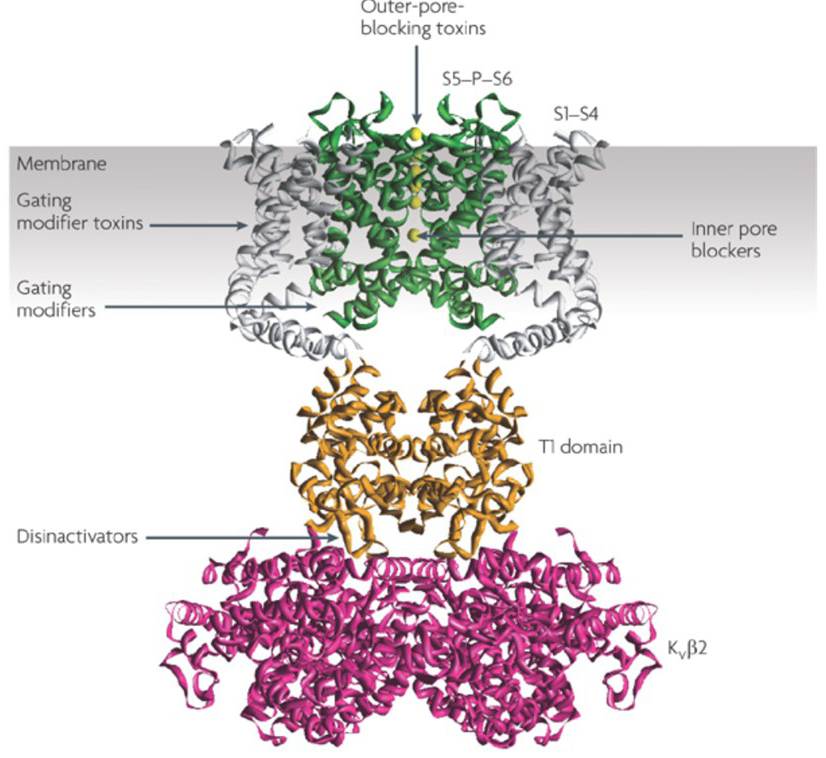
figur 6. Eksempler på virkemåder for KV-kanalmodulatorer. Der er flere forskellige måder for peptidtoksiner og små molekyler til at modulere kV-kanalaktivitet. KV1 .2-strukturen er vist med poredomænerne (S5-P-S6) i grønt, spændingssensordomænerne (S1-S4) i gråt, T1-tetrameriseringsdomænerne i orange og kV-Trip2-hjælpeenheder i magenta. Ydre poreblokerende toksiner fra skorpioner, havanemoner, slanger og keglesnegle kan binde sig til den ydre vestibule og blokere ionpermeation. Gating modifier toksiner fra edderkopper som hanatoksin kan interagere med spændingsføleren for at øge stabiliteten af den lukkede tilstand, hvilket forårsager højre forskydning af spændingsafhængighedskurven for kanalaktivering. Der er også små molekylekanalmodulatorer, der binder til den indre pore (indre poreblokkere), gating hængslerne (gating modifikatorer) eller grænsefladen mellem de røde og røde underenheder (disinaktivatorer) .
Spændingsgated kaliumkanalstruktur
den bemærkelsesværdige selektivitet af kaliumkanaler, som gør det muligt for K+-ioner at gå gennem kanalporen med størrelsesordener større lethed end de mindre Na+-ioner og med næsten diffusionsbegrænset hastighed , redegøres for evnen af backbone-karbonylerne i selektivitetsfilteret til at koordinere K+ – ioner , der stort set er fjernet fra deres hydratiseringsskaller, så mere end en K+ – ion bevæger sig gennem dette smaleste segment af porerne, hvilket gør det muligt for i tandem (fig. 7) – en lang pore for enkeltfil K+ ionpermeation som baseret .
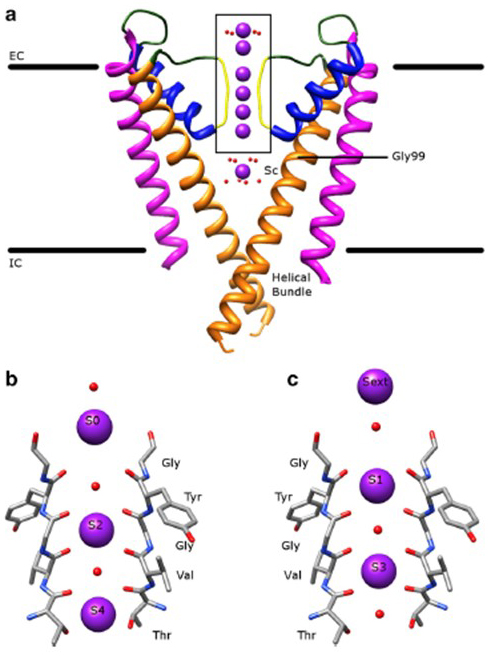
Figur 7. Poredomænet af kaliumkanaler. (a) struktur af KcsA i ledende tilstand (FBF: 1k4c) med de ydre spiraler i magenta , indre spiraler i orange, porehelices i blåt og selektivitetsfilteret i gult. K + ioner er i lilla, mens dets omgivende vandmolekyler er i rødt. EC: ekstracellulær; IC: intracellulær. (b, c) selektivitetsfilteret i det boksede område af KcsA-strukturen er vist med K+ – ioner, der optager enten S2-og S4-positionerne (b) eller S1-og S3-positionerne (c) for at illustrere K+ ionpermeation i en enkelt fil .
spændingsafhængigheden af KV-kanalaktivering stammer fra deres spændingsfølerdomæner . Som vist i Fig. 8, kV-kanaler og relaterede kanaler såsom spændingsstyrede natriumkanaler og TRPV1-kanaler i samme superfamilie har lignende arrangementer af deres poredomæner og spændingsfølerdomæner. Spændingsfølerdomænet for en underenhed interagerer med poredomænet for en nærliggende underenhed i en domænebyttekonfiguration, og inden for en spændingssensor kan de positivt ladede argininrester på S4 interagere med negativt ladede sure rester i tilstødende spiraler (Fig. 9).
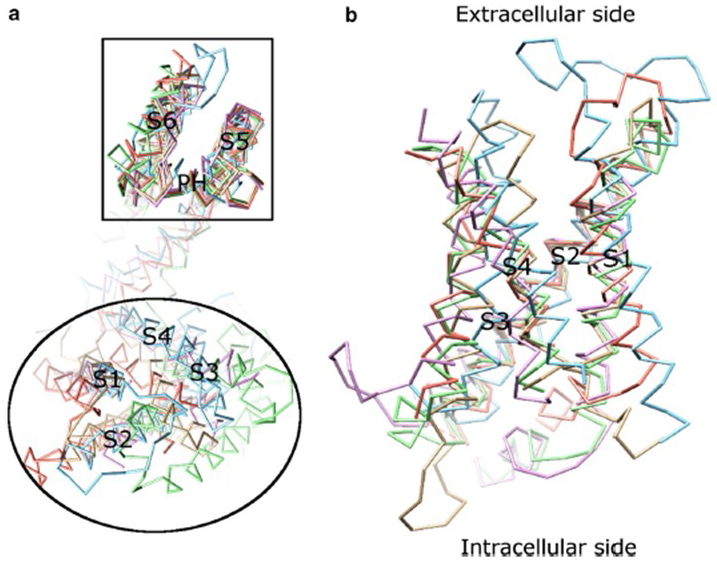
figur 8. Spændingsfølerdomænet for spændingsstyrede kaliumkanaler. (a) justering af poredomænet (S5-P-S6) af forskellige ionkanaler afslører, at deres spændingsfølerdomæner (S1-S4) kan antage en række retninger (set fra den ekstracellulære side). (B) overlejring af spændingsfølerdomænet i KV1.2 (FBF: 3LUT, lys magenta) med spændingsfølerdomænerne i MlotiK1 (FBF: 3BEH, lysebrun), NaVAb (FBF: 3rvy, lysegrøn), NaVRh (FBF: 4DV, lys orange) og TRPV1 (FBF: 3j5p, Lyseblå) (set fra membranen).
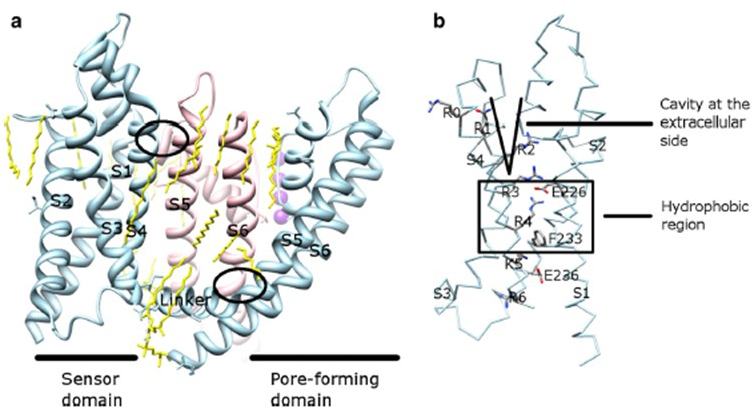
figur 9. Kontakter mellem poredomænet og spændingsfølerdomænet på KV-kanaler. (a) KV1.2-KV2.1 chimera (FBF: 2r9r) med spændingsfølerdomænet for en underenhed (Lyseblå) i kontakt med poredomænet for en nærliggende underenhed (lyserød). Kontakterne på den intracellulære side involverer interaktionen mellem S4-S5-linkeren med S6, og kontakterne på den ekstracellulære side involverer interaktionen mellem S1 og porespiralen . Lipider (gule), der omgiver kanalen og mellem poredomænet og spændingsfølerdomænet, kan påvises i krystalstrukturen. B) basiske rester af S4 og sure rester i deres nærhed i spændingsfølerdomænet .
Kanalopatier knyttet til spændingsstyrede kaliumkanaler
spændingsstyrede kaliumkanaler udtrykkes bredt i en række væv. I neuroner er de målrettet mod forskellige subcellulære rum (Fig. 10), og kanaler med forskellige underenhedssammensætninger kan være til stede i forskellige underpopulationer af neuroner . Mutationer af KV-kanalgener kan forårsage neurologiske sygdomme som episodisk ataksi og epilepsier, hjertesygdomme og døvhed . Evolutionær bevarelse af KV-kanalfunktionen er for eksempel tydelig fra de lignende bevægelsesforstyrrelser forårsaget af mutation af KV1-ortologer hos mennesker, mus og frugtflue .
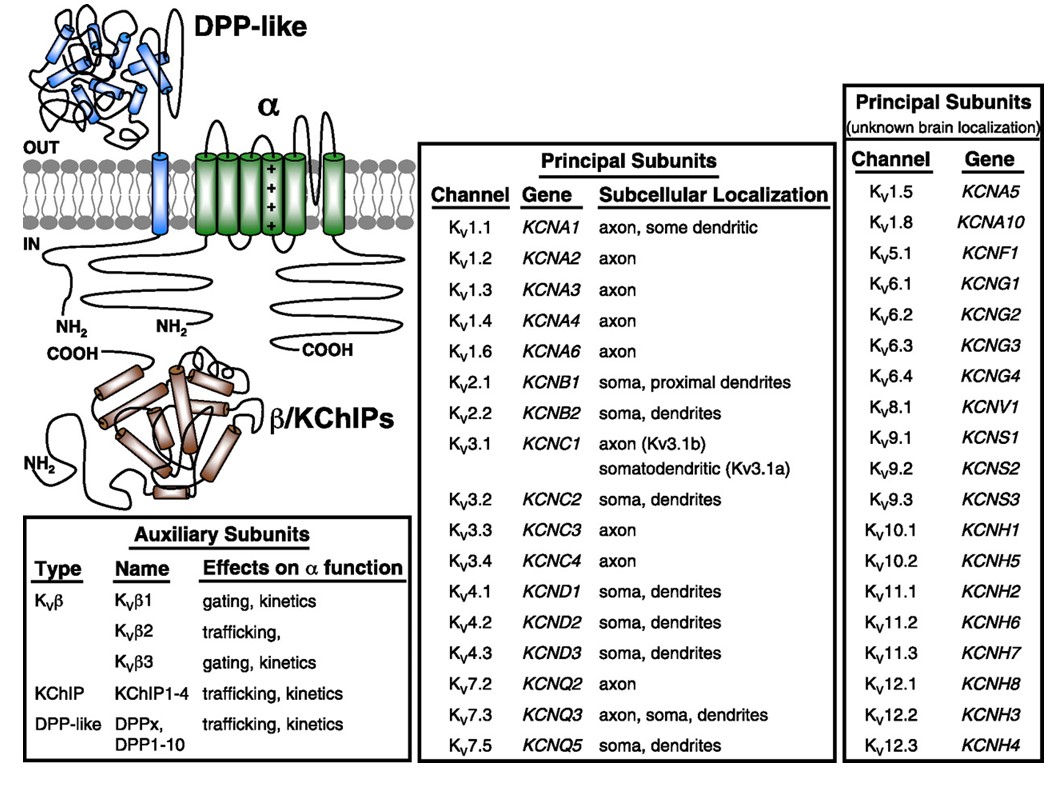
Figur 10. Subcellulær fordeling af spændingsstyrede kaliumkanaler. Skematisk øverst til venstre viser en KV4-kanal med to forskellige hjælpeenheder. Subcellulær lokalisering af forskellige KV-kanaler i pattedyrs centrale neuroner er angivet i den midterste boks .
referencer og noter
1.Hille, B., Ioniske kanaler af spændende membraner, 3., Red. 2001: Sinauer Associates Inc.
2.C., Et Al., K(+) kanaler: funktion-strukturel oversigt. Compr Physiol, 2012. 2 (3): s. 2087-149.
3.Vacher, H., D. P. Mohapatra og J. S. Trimmer, lokalisering og målretning af spændingsafhængige ionkanaler i pattedyrs centrale neuroner. Physiol Rev, 2008. 88 (4): s. 1407-47.
4.Jegla, T. J., et al., Udvikling af det menneskelige ionkanalsæt. Kam Chem Høj Gennemløb Skærm, 2009. 12 (1): s. 2-23.
5.Cang, C., Et al., TMEM175 er en Organelle K (+) kanal, der regulerer Lysosomal funktion. Celle, 2015. 162 (5): s. 1101-12.
6.Hodgkin, A. L. og A. F., strømme båret af natrium – og kaliumioner gennem membranen af den gigantiske akson af Loligo. J Physiol, 1952. 116 (4): s. 449-72.
7.Rosenthal, J. J., T. I. Liu og H. F. Gilly, en familie af forsinket ensretter KV1 cDNA ‘ er, der viser celletypespecifik ekspression i blæksprutte stellate ganglion/giant fiber lobe kompleks. J Neurosci, 1997. 17 (13): s. 5070-9.
8.Unge, J. J., sammensmeltede neuroner og synaptiske kontakter i de gigantiske nervefibre af blæksprutter. Phil Trans R Soc Lond B, 1939. 229: s. 465-503.
9.Rosenthal, J. J. og F. Besanilla, Omfattende redigering af mRNA ‘ er til blæksprutte forsinket ensretter K+ kanal regulerer underenhed tetramerisering. Neuron, 2002. 34 (5): s. 743-57.
10.Jan, L. Y. og Y. N. Jan, spændingsstyrede kaliumkanaler og mangfoldigheden af elektrisk signalering. J Physiol, 2012. 590 (11): s. 2591-9.
11.Johnston, J., I. D. Forsythe og C. Kopp-Scheinpflug, går indfødt: spændingsstyrede kaliumkanaler, der styrer neuronal spænding. J Physiol, 2010. 588 (Pt 17): s. 3187-200.
12.Bocksteins, E., KV5, KV6, KV8 og KV9 underenheder: ingen enkle tavse tilskuere. J Gen Physiol, 2016. 147 (2): s. 105-25.
13.L. A. Pardo, spændingsstyrede kaliumkanaler som terapeutiske mål. Nat Rev Drug Discov, 2009. 8 (12): s. 982-1001.
14.Bates, E., Ionkanaler i udvikling og kræft. Annu Rev Cell Dev Biol, 2015. 31: s. 231-47.
15.Huang og L. Y. Jan er målrettet mod kaliumkanaler i kræft. J Celle Biol, 2014. 206 (2): s. 151-62.
16.Huang, et al., EAG2 kaliumkanal med evolutionært konserveret funktion som et hjernetumormål. Nat Neurosci, 2015. 18 (9): s. 1236-46.
17.K., ionkanaler og kræft. J Membr Biol, 2005. 205 (3): s. 159-73.
18.Li ionkanaler som mål for kræftbehandling. Int J Physiol Patofysiol Pharmacol, 2011. 3 (2): s. 156-66.
19.Pardo, L. A., Spændingsstyrede kaliumkanaler i celleproliferation. Fysiologi (Bethesda), 2004. 19: s. 285-92.
20.Urrego, D., et al., Kaliumkanaler i cellecyklus og celleproliferation. Philos Trans R Soc Lond B Biol Sci, 2014. 369 (1638): s. 20130094.
21.Y., et al., Kemi af ionkoordinering og hydrering afsløret af et k+ channel-Fab-kompleks ved 2,0 a opløsning. Natur, 2001. 414 (6859): s. 43-8.
22.MacKinnon, R., kaliumkanaler. FEBS Lett, 2003. 555 (1): s. 62-5.
23.Kuang, P. Purhonen og H. Hebert, struktur af kaliumkanaler. Cell Mol Life Sci, 2015. 72 (19): s. 3677-93.
24.Isacoff, E. Y., L. Y. Jan og D. L. Minor, Jr., Conduits of life ‘ s spark: et perspektiv på ionkanalforskning siden neurons fødsel. Neuron, 2013. 80 (3): s. 658-74.
25.K. J., Sensing spænding på tværs af lipidmembraner. Natur, 2008. 456 (7224): s. 891-7.
26.Differentiel subcellulær fordeling af ionkanaler og mangfoldigheden af neuronal funktion. Curr Opin Neurobiol, 2012. 22 (3): s. 366-71.
27.Lujan, R., organisering af kaliumkanaler på den neuronale overflade. J Chem Neuroanat, 2010. 40 (1): s. 1-20.
28.Abriel, H. og E. V. Hjertekanalopatier: genetiske og molekylære mekanismer. Gene, 2013. 517 (1): s. 1-11.
29.Kullmann, D. M. Og M. G. Hanna, neurologiske lidelser forårsaget af arvelige ionkanalmutationer. Lancet Neurol, 2002. 1 (3): s. 157-66.
30.Lehmann-Horn, F. og K. Jurkat-Rott, spændingsstyrede ionkanaler og arvelig sygdom. Physiol Rev, 1999. 79 (4): s. 1317-72.
31.Villa, C. Og R. Combi, kaliumkanaler og humane epileptiske fænotyper: en opdateret oversigt. Front Cell Neurosci, 2016. 10: s. 81.
32.Long, S. B., E. B. Campbell og R. Mackinnon, krystalstruktur af en pattedyrs spændingsafhængig Shaker familie K+ kanal. Videnskab, 2005. 309 (5736): s. 897-903.
33.Chen, et al., Struktur af Shaker-kaliumkanalen i fuld længde KV1.2 ved normal-tilstand-baseret røntgenkrystallografisk forfining. Proc Natl Acad Sci U S A, 2010. 107 (25): s. 11352-7.
34.Clayton, G. M., et al., Struktur af transmembranregionerne i en bakteriel cyklisk nukleotidreguleret kanal. Proc Natl Acad Sci U S A, 2008. 105 (5): s. 1511-5.
35.Payandeh, J., et al., Krystalstrukturen af en spændingsgated natriumkanal. Natur, 2011. 475 (7356): s. 353-8.
36.Jørgen, J., et al., Krystalstruktur af en ortolog af den nachbac spændingsgated natriumkanal. Natur, 2012. 486 (7401): s. 130-4.
37.Liao, M., et al., Struktur af TRPV1 ionkanalen bestemt ved elektronkryomikroskopi. Natur, 2013. 504 (7478): s. 107-12.
38.Long, S. B., Et Al., Atomstruktur af en spændingsafhængig K+ kanal i et lipidmembranlignende miljø. Natur, 2007. 450 (7168): S. 376-82.