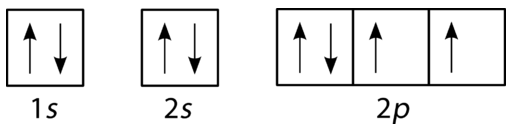
Orbital Filling Diagrams
Ein Orbitalfülldiagramm ist die visuellere Möglichkeit, die Anordnung aller Elektronen in einem bestimmten Atom darzustellen. In einem Orbitalfülldiagramm werden die einzelnen Orbitale als Kreise (oder Quadrate) dargestellt und Orbitale innerhalb einer Unterebene horizontal nebeneinander gezeichnet. Jede Unterebene ist durch ihr Hauptenergieniveau und ihre Unterebene gekennzeichnet. Elektronen werden durch Pfeile innerhalb der Kreise angezeigt. Ein nach oben zeigender Pfeil zeigt eine Drehrichtung an, während ein nach unten zeigender Pfeil die andere Richtung anzeigt. Die Orbitalfülldiagramme für Wasserstoff, Helium und Lithium sind in der folgenden Abbildung dargestellt.
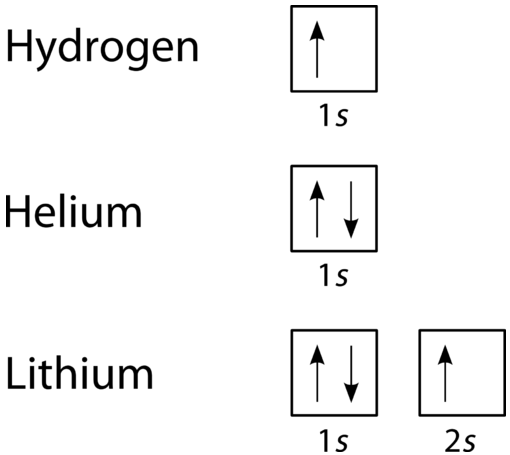
Nach dem Aufbauprozess werden Unterebenen und Orbitale in der Reihenfolge zunehmender Energie mit Elektronen gefüllt. Da die \ (s\) -Unterebene nur aus einem Orbital besteht, paart sich das zweite Elektron einfach mit dem ersten Elektron wie in Helium. Das nächste Element ist Lithium und erfordert die Verwendung der nächsten verfügbaren Unterebene, der \(2s\).
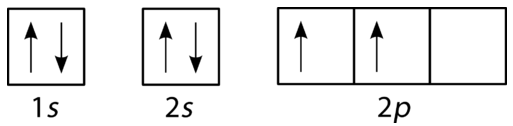
Das Fülldiagramm für Kohlenstoff ist in der folgenden Abbildung dargestellt. Es gibt zwei \ (2p \) Elektronen für Kohlenstoff und jedes besetzt sein eigenes \ (2p \) Orbital.
Sauerstoff hat vier \(2p\) Elektronen. Nachdem jedes \ (2p \) Orbital ein Elektron enthält, kann das vierte Elektron in das erste \ (2p\) Orbital mit einem Spin gegenüber dem des anderen Elektrons in diesem Orbital platziert werden.