Zurück zum Schreiben von Lewis-Strukturen für Moleküle
Die Skelettstruktur eines kovalenten Moleküls kann oft unter Berücksichtigung der Valenzen der konstituierenden Atome bestimmt werden. Normalerweise befindet sich das Atom, das die größte Anzahl von Bindungen bildet, in der Mitte des Skeletts, wo es sich mit der maximalen Anzahl anderer Atome verbinden kann.
Beispiel 1: Hypochlorige Säure hat die Summenformel HOCl. Zeichnen Sie eine
Strukturformel.
Lösung Es gibt mehrere Möglichkeiten, die Atome miteinander zu verbinden
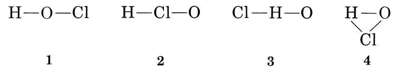
Die übliche Wertigkeit von H ist 1, so dass Strukturen 3 und 4, die zwei Bindungen zu H haben, eliminiert werden können. Die übliche Valenz von Cl ist ebenfalls 1, so dass auch Struktur 2 ausgeschlossen werden kann. Struktur 1 zeigt H, das eine Bindung bildet, Cl, das eine bildet, und O, das zwei bildet, in Übereinstimmung mit den üblichen Valenzen, und so wird es gewählt.
Die Gesamtzahl der verfügbaren Valenzelektronen beträgt 1 von H plus 6 von O plus 7 von Cl oder 14. Füllen Sie diese in das Skelett, das wir haben
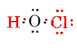
Beachten Sie, dass sich O, das die größte Wertigkeit hatte, in der Mitte des Skeletts befindet.
Beispiel 2:
Zeichnen Sie eine Strukturformel für Hydroxylamin, NH3O.
Lösung In diesem Fall hat N die größte Wertigkeit (3), gefolgt von O (2) und H (1). Sowohl N als auch O können „Brücken“ zwischen anderen Atomen bilden, H jedoch nicht. Deshalb setzen wir N und O in die Mitte des Skeletts, um zu geben
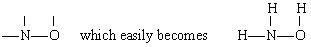
durch Addition der drei H-Atome.
Es gibt insgesamt 5 + 3 + 6 = 14 Valenzelektronen aus N, 3H und O. Diese können wie folgt platziert werden:
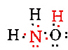
Sobald das Lewis-Diagramm bestimmt wurde, wird die Molekülformel oft umgeschrieben, um uns an die Strukturformel zu erinnern. Zum Beispiel wird die molekulare Formel für Hydroxylamin normalerweise NH2OH anstelle von NH3O geschrieben, um uns daran zu erinnern, dass zwei H an N und eins an O gebunden sind. Es wird angenommen, dass die Person, die die Formel liest, erkennt, dass N und O jeweils ein Valenzelektron haben, das sie miteinander teilen und —NH VERBINDEN2 mit —OH. In einigen Fällen erfüllt mehr als eine Skelettstruktur die Wertigkeit jedes Atoms und auch die Oktettregel. Sie können beispielsweise überprüfen, ob die Summenformel C2H6O den beiden folgenden entspricht:
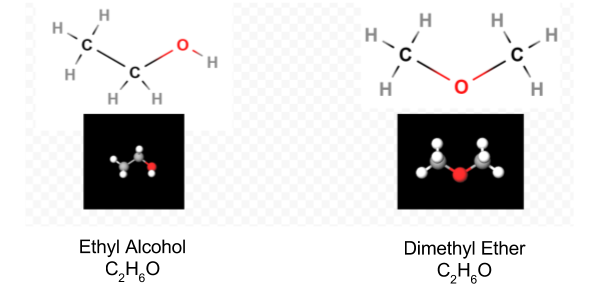
In einem solchen Fall können wir nur experimentell entscheiden, welche Molekülstruktur wir haben. Die Eigenschaften von Ethylalkohol, wenn er mit Wasser verdünnt und konsumiert wird, sind bekannt. Dimethylether ist ein Gas. Wie der in Operationssälen verwendete Diethylether ist er hochexplosiv und kann Sie in den Schlaf versetzen. Zwei Moleküle, wie Dimethylether und Ethylalkohol, die die gleiche Molekülformel, aber unterschiedliche Strukturformeln haben, werden als Isomere bezeichnet.
Zurück zum Schreiben von Lewis-Strukturen für Moleküle
Danksagungen:
Die C2H6O-Moleküle und ihre Skelettstrukturen wurden mit MolView erstellt.