Reaktionsraten
Variation der Raten beim Wechsel des Halogens
Die Reaktionsraten steigen in der Größenordnung HF – HCl – HBr – HI. Fluorwasserstoff reagiert viel langsamer als die anderen drei und wird normalerweise ignoriert, wenn über diese Reaktionen gesprochen wird.
Wenn die Halogenwasserstoffe mit Alkenen reagieren, muss die Wasserstoff-Halogen-Bindung gebrochen werden. Die Haftfestigkeit sinkt, wenn Sie von HF zu HI wechseln, und die Wasserstoff-Fluor-Bindung ist besonders stark. Weil es schwierig ist, die Bindung zwischen dem Wasserstoff und dem Fluor zu brechen, ist die Zugabe von HF gebunden langsam zu sein.
Variation der Raten beim Wechsel des Alkens
Dies gilt sowohl für unsymmetrische als auch für symmetrische Alkene. Der Einfachheit halber sind die unten angegebenen Beispiele alle symmetrisch – müssen es aber nicht sein.
Die Reaktionsgeschwindigkeiten nehmen zu, wenn das Alken komplizierter wird – im Sinne der Anzahl der Alkylgruppen (z. B. Methylgruppen), die an den Kohlenstoffatomen an beiden Enden der Doppelbindung gebunden sind. Zum Beispiel:
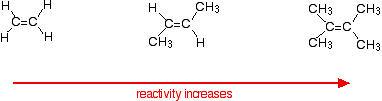
Es gibt zwei Möglichkeiten, die Gründe dafür zu betrachten – beide müssen Sie über den Mechanismus für die Reaktionen wissen.
Alkene reagieren, weil die Elektronen in der Pi-Bindung Dinge mit beliebiger positiver Ladung anziehen. Alles, was die Elektronendichte um die Doppelbindung erhöht, hilft dabei.
Alkylgruppen neigen dazu, Elektronen von sich weg zur Doppelbindung zu „schieben“. Je mehr Alkylgruppen Sie haben, desto negativer wird der Bereich um die Doppelbindungen.
Je negativer diese Region geladen wird, desto mehr zieht sie Moleküle wie Chlorwasserstoff an.
Der wichtigere Grund liegt jedoch in der Stabilität des während der Reaktion gebildeten Zwischenions. Die drei oben angegebenen Beispiele erzeugen diese Carbokationen (Carboniumionen) auf halbem Weg der Reaktion:
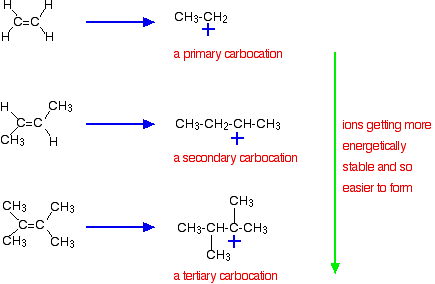
Die Stabilität der Zwischenionen bestimmt die Aktivierungsenergie für die Reaktion. Wenn Sie sich den komplizierteren Alkenen zuwenden, sinkt die Aktivierungsenergie für die Reaktion. Das bedeutet, dass die Reaktionen schneller werden.