Lernziele
Am Ende dieses Abschnitts können Sie:
- Lewis-Symbole für neutrale Atome und Ionen schreiben
- Lewis-Strukturen zeichnen, die die Bindung in einfachen Molekülen darstellen
Wir haben die verschiedenen Arten von Bindungen diskutiert, die sich zwischen Atomen und / oder Ionen bilden. In allen Fällen beinhalten diese Bindungen die gemeinsame Nutzung oder Übertragung von Valenzschalenelektronen zwischen Atomen. In diesem Abschnitt werden wir die typische Methode zur Darstellung von Valenzschalenelektronen und chemischen Bindungen untersuchen, nämlich Lewis-Symbole und Lewis-Strukturen.
Lewis-Symbole
Wir verwenden Lewis-Symbole, um Valenzelektronenkonfigurationen von Atomen und einatomigen Ionen zu beschreiben. Ein Lewis-Symbol besteht aus einem Elementsymbol, das für jedes seiner Valenzelektronen von einem Punkt umgeben ist:
Abbildung 1 zeigt die Lewis-Symbole für die Elemente der dritten Periode des Periodensystems.

Abbildung 1. Lewis-Symbole, die die Anzahl der Valenzelektronen für jedes Element in der dritten Periode des Periodensystems darstellen.
Lewis-Symbole können auch verwendet werden, um die Bildung von Kationen aus Atomen zu veranschaulichen, wie hier für Natrium und Calcium gezeigt:

Ebenso können sie verwendet werden, um die Bildung von Anionen aus Atomen zu zeigen, wie unten für Chlor und Schwefel gezeigt:

Abbildung 2 zeigt die Verwendung von Lewis-Symbolen zur Darstellung der Übertragung von Elektronen während der Bildung ionischer Verbindungen.

Abbildung 2. Kationen werden gebildet, wenn Atome Elektronen verlieren, dargestellt durch weniger Lewis-Punkte, während Anionen durch Atome gebildet werden, die Elektronen gewinnen. Die Gesamtzahl der Elektronen ändert sich nicht.
Lewis-Strukturen
Wir verwenden auch Lewis-Symbole, um die Bildung kovalenter Bindungen anzuzeigen, die in Lewis-Strukturen dargestellt sind, Zeichnungen, die die Bindung in Molekülen und mehratomigen Ionen beschreiben. Wenn beispielsweise zwei Chloratome ein Chlormolekül bilden, teilen sie sich ein Elektronenpaar:

Die Lewis-Struktur zeigt an, dass jedes Cl-Atom drei Elektronenpaare hat, die nicht zum Binden verwendet werden (einsame Paare genannt), und ein gemeinsames Elektronenpaar (zwischen den Atomen geschrieben). Ein Strich (oder eine Linie) wird manchmal verwendet, um ein gemeinsames Elektronenpaar anzuzeigen:

Ein einzelnes gemeinsames Elektronenpaar wird als Einfachbindung bezeichnet. Jedes Cl-Atom interagiert mit acht Valenzelektronen: die sechs in den einsamen Paaren und die beiden in der Einfachbindung.
Die Oktettregel
Die anderen Halogenmoleküle (F2, Br2, I2 und At2) bilden Bindungen wie im Chlormolekül: eine einfache Bindung zwischen Atomen und drei einsame Elektronenpaare pro Atom. Dadurch kann jedes Halogenatom eine Edelgaselektronenkonfiguration aufweisen. Die Tendenz von Hauptgruppenatomen, genügend Bindungen zu bilden, um acht Valenzelektronen zu erhalten, wird als Oktettregel bezeichnet.
Die Anzahl der Bindungen, die ein Atom bilden kann, kann oft aus der Anzahl der Elektronen vorhergesagt werden, die benötigt werden, um ein Oktett zu erreichen (acht Valenzelektronen); Dies gilt insbesondere für die Nichtmetalle der zweiten Periode des Periodensystems (C, N, O und F). Zum Beispiel hat jedes Atom eines Elements der Gruppe 14 vier Elektronen in seiner äußersten Schale und benötigt daher vier weitere Elektronen, um ein Oktett zu erreichen. Diese vier Elektronen können durch die Bildung von vier kovalenten Bindungen gewonnen werden, wie hier für Kohlenstoff in CCl4 (Tetrachlorkohlenstoff) und Silizium in SiH4 (Silan) dargestellt. Da Wasserstoff nur zwei Elektronen benötigt, um seine Valenzhülle zu füllen, ist er eine Ausnahme von der Oktettregel. Die Übergangselemente und inneren Übergangselemente folgen ebenfalls nicht der Oktettregel:

Elemente der Gruppe 15 wie Stickstoff haben fünf Valenzelektronen im atomaren Lewis-Symbol: ein einzelnes Paar und drei ungepaarte Elektronen. Um ein Oktett zu erhalten, bilden diese Atome drei kovalente Bindungen, wie in NH3 (Ammoniak). Sauerstoff und andere Atome in Gruppe 16 erhalten ein Oktett, indem sie zwei kovalente Bindungen bilden:
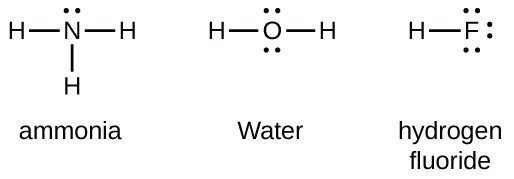
Doppel- und Dreifachbindungen
Wie bereits erwähnt, wenn ein Atompaar ein Elektronenpaar teilt, nennen wir dies eine Einfachbindung. Ein Atompaar muss jedoch möglicherweise mehr als ein Elektronenpaar teilen, um das erforderliche Oktett zu erreichen. Eine Doppelbindung entsteht, wenn zwei Elektronenpaare zwischen einem Atompaar geteilt werden, wie zwischen den Kohlenstoff- und Sauerstoffatomen in CH2O (Formaldehyd) und zwischen den beiden Kohlenstoffatomen in C2H4 (Ethylen):
Eine Dreifachbindung entsteht, wenn drei Elektronenpaare von einem Atompaar geteilt werden, wie in Stickstoffgas (N2):
Schreiben von Lewis-Strukturen mit der Oktettregel
Für sehr einfache Moleküle und Molekülionen können wir die Lewis-Strukturen schreiben, indem wir lediglich die ungepaarten Elektronen auf den konstituierenden Atomen paaren. Sehen Sie sich diese Beispiele an:

Für kompliziertere Moleküle und Molekülionen ist es hilfreich, das hier beschriebene Schritt-für-Schritt-Verfahren zu befolgen:
- Bestimmen Sie die Gesamtzahl der Valenzelektronen (Außenschale).
- Zeichnen Sie eine Skelettstruktur des Moleküls und ordnen Sie die Atome um ein Zentralatom an. (Im Allgemeinen sollte das am wenigsten elektronegative Element in der Mitte platziert werden.) Verbinden Sie jedes Atom mit einer Einfachbindung (ein Elektronenpaar) mit dem Zentralatom.
- Verteilen Sie die verbleibenden Elektronen als einzelne Paare auf die Endatome (außer Wasserstoff) und vervollständigen Sie ein Oktett um jedes Atom.
- Platzieren Sie alle verbleibenden Elektronen auf dem Zentralatom.
- Ordnen Sie die Elektronen der äußeren Atome neu an, um Mehrfachbindungen mit dem Zentralatom einzugehen, um nach Möglichkeit Oktette zu erhalten.
Bestimmen wir die Lewis-Struktur von PBr3 mit den obigen Schritten:
- Schritt 1: Bestimmen Sie die Gesamtzahl der Valenzelektronen (Außenschale).
\ groß \begin{array}{l} \\ \phantom{\Regel {0.8em} {0ex}}{\text{PBr}}_{3}\\ \phantom{\Regel {0.8em}{0ex}}\text {P: 5 Valenzelektronen / Atom} \ Zeiten \ text {1 Atom} = 5 \\ \ unterstreichen {+\ text {Br: 7 Valenzelektronen / Atom}\Zeiten \ text {3 Atome} = 21} \\ \\ \ phantom {\ Regel {15.95em}{0ex}}=\text{26 Valenzelektronen}\Ende{array}
- Schritt 2: Zeichnen Sie eine Skelettstruktur des Moleküls und ordnen Sie die Atome um ein Zentralatom an. (Im Allgemeinen sollte das am wenigsten elektronegative Element in der Mitte platziert werden.) Verbinden Sie jedes Atom mit einer Einfachbindung (ein Elektronenpaar) mit dem Zentralatom.

- Schritt 3: Verteilen Sie die verbleibenden Elektronen als einzelne Paare auf den Endatomen (außer Wasserstoff) und vervollständigen Sie ein Oktett um jedes Atom.
-
 Schritt 4: Platzieren Sie alle verbleibenden Elektronen auf dem Zentralatom.
Schritt 4: Platzieren Sie alle verbleibenden Elektronen auf dem Zentralatom.

Hinweis: Schritt 5: Wird nicht benötigt, da alle Atome ein Oktett haben.
Bestimmen wir die Lewis-Struktur von CH2O.
- Schritt 1: Bestimmen Sie die Gesamtzahl der Valenzelektronen (Außenschale).
\ groß \begin{array}{l}\\ \phantom{\rule{0.8em}{0ex}}{\text{H}_{2}}\text{CO}\\ \phantom{\rule{0.8em}{0ex}}\text{H: 1 Valenzelektron / Atom}\times \text{2 atom} =2\\\ text {C: 4 Valenzelektronen / Atom}\times \text{1 atom}=4\\ \unterstreichen{+\text{O: 6 Valenzelektronen/Atom} \times \text{1 atome}=6}\\ \\ \phantom{\rule{15.95em}{0ex}}=\text{12 Valenzelektronen}\end{array}
- Schritt 2: Zeichnen Sie eine Skelettstruktur des Moleküls und ordnen Sie die Atome um ein Zentralatom an. (Im Allgemeinen sollte das am wenigsten elektronegative Element in der Mitte platziert werden.) Verbinden Sie jedes Atom mit einer Einfachbindung (ein Elektronenpaar) mit dem Zentralatom.

- Schritt 3: Verteilen Sie die verbleibenden Elektronen als einzelne Paare auf den Endatomen (außer Wasserstoff) und vervollständigen Sie ein Oktett um jedes Atom.

- Schritt 4: Nicht erforderlich, da alle Elektronen platziert wurden. Kohlenstoff hat jedoch kein Oktett,
- Schritt 5: Ordnen Sie die Elektronen der äußeren Atome neu an, um Mehrfachbindungen mit dem Zentralatom herzustellen, um nach Möglichkeit Oktette zu erhalten.

Beispiel 1: Schreiben von Lewis-Strukturen
Die Cassini-Huygens-Mission der NASA entdeckte eine große Wolke giftigen Cyanwasserstoffs (HCN) auf Titan, einem der Saturnmonde. Was sind die Lewis-Strukturen dieser Moleküle?
Überprüfen Sie Ihr Lernen
Kohlendioxid, CO2, ist ein Produkt der Verbrennung fossiler Brennstoffe. CO2 ist am globalen Klimawandel beteiligt. Was ist die Lewis-Struktur von CO2?
Schlüsselkonzepte und Zusammenfassung
Valenzelektronische Strukturen können durch Zeichnen von Lewis-Symbolen (für Atome und einatomige Ionen) und Lewis-Strukturen (für Moleküle und mehratomige Ionen) visualisiert werden. Einsame Paare, ungepaarte Elektronen und Einzel-, Doppel- oder Dreifachbindungen werden verwendet, um anzuzeigen, wo sich die Valenzelektronen um jedes Atom in einer Lewis-Struktur befinden. Die meisten Strukturen — insbesondere solche, die Elemente der zweiten Reihe enthalten — gehorchen der Oktettregel, in der jedes Atom (außer H) von acht Elektronen umgeben ist. Ausnahmen von der Oktettregel treten für ungerade Elektronenmoleküle (freie Radikale), elektronenarme Moleküle und hypervalente Moleküle auf.
Übungen
- Schreiben Sie die Lewis-Symbole für jedes der folgenden Ionen:
- As3-
- Ich–
- Be2+
- O2-
- Ga3+
- Li +
- N3–
- Viele einatomige Ionen finden sich im Meerwasser, einschließlich der Ionen, die aus der folgenden Liste von Elementen gebildet werden. Schreiben Sie die Lewis-Symbole für die einatomigen Ionen, die aus den folgenden Elementen gebildet werden:
- Cl
- Na
- Mg
- Ca
- K
- Br
- Sr
- F
- Schreiben Sie die Lewis-Symbole der Ionen in jede der folgenden ionischen Verbindungen und die Lewis-Symbole des Atoms, aus dem sie gebildet werden:
- MgS
- Al2O3
- GaCl3
- K2O
- Li3N
- KF
- In den unten aufgeführten Lewis-Strukturen repräsentieren M und X verschiedene Elemente in der dritten Periode des Periodensystems. Schreiben Sie die Formel jeder Verbindung mit den chemischen Symbolen jedes Elements:
- Schreiben Sie die Lewis-Struktur für das zweiatomige Molekül P2, eine instabile Form von Phosphor, die in Hochtemperatur-Phosphordampf gefunden wird.
- Schreiben Sie Lewis-Strukturen für Folgendes:
- H2
- HBr
- PCl3
- Schreiben Sie Lewis-Strukturen für Folgendes:
- O2
- H2CO
- AsF3
- SiCl4
Glossar
Doppelbindung: kovalente Bindung, bei der zwei Elektronenpaare zwischen zwei Atomen geteilt werden
freies Radikal: Molekül, das eine ungerade Anzahl von Elektronen enthält
hypervalentes Molekül: Molekül, das mindestens ein Hauptgruppenelement enthält, das mehr als acht Elektronen in seiner Valenzhülle hat
Lewis-Struktur: Diagramm, das einzelne Paare und Bindungspaare von Elektronen in einem Molekül oder einem Ion zeigt
Lewis-Symbol: symbol für ein Element oder ein einatomiges Ion, das jedes Valenzelektron im Element oder Ion mit einem Punkt darstellt
einsames Paar: zwei (ein Paar) Valenzelektronen, die nicht zur Bildung einer kovalenten Bindung verwendet werden
Oktettregel: Richtlinie, die besagt, dass Atome der Hauptgruppe Strukturen bilden, in denen acht Valenzelektronen mit jedem Kern interagieren, wobei die Bindungselektronen als Wechselwirkung mit beiden durch die Bindung verbundenen Atomen gezählt werden
Einzelbindung: Bindung, in der ein einzelnes Elektronenpaar wird zwischen zwei Atomen geteilt
Dreifachbindung: bindung, in der drei Elektronenpaare zwischen zwei Atomen geteilt werden


 HCN: Es bleiben keine Elektronen zurück
HCN: Es bleiben keine Elektronen zurück




















