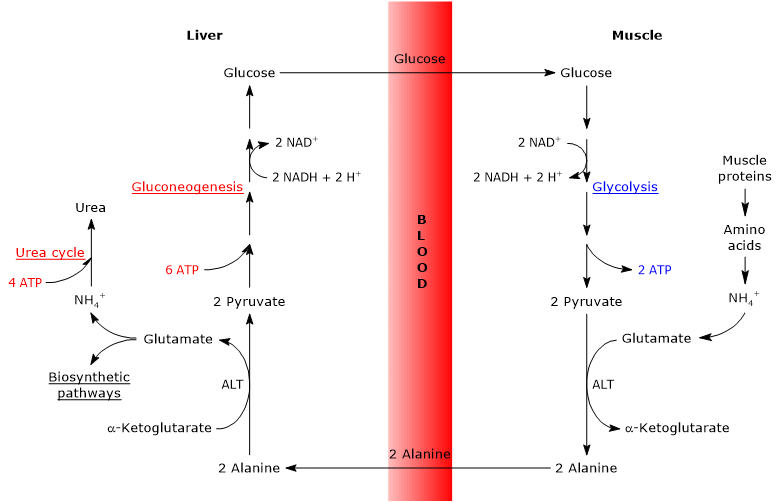
Der Glucose-Alanin-Zyklus oder Cahill-Zyklus, der erstmals von Mallette, Exton und Park und Felig et al. besteht zwischen 1969 und 1970 aus einer Reihe von Schritten, durch die extrahepatische Gewebe, beispielsweise der Skelettmuskel, Pyruvat und Aminogruppen als Alanin in die Leber exportieren und Glukose aus der Leber über den Blutkreislauf erhalten.
Die wichtigsten Schritte des Glucose-Alanin-Zyklus sind nachstehend zusammengefasst.
- Wenn in extrahepatischen Geweben Aminosäuren zur Energiegewinnung verwendet werden, wird Pyruvat, das aus der Glykolyse stammt, als Aminogruppenakzeptor verwendet und bildet Alanin, eine nicht essentielle Aminosäure.
- Alanin diffundiert in den Blutkreislauf und erreicht die Leber.
- In der Leber wird die Aminogruppe von Alanin auf α-Ketoglutarat übertragen, um Pyruvat bzw.
- Die Aminogruppe von Glutamat tritt hauptsächlich in den Harnstoffzyklus ein und wirkt teilweise als Stickstoffdonor in vielen Biosynthesewegen.
Pyruvat tritt in die Glukoneogenese ein und wird zur Glukosesynthese verwendet. - Die neu gebildete Glukose diffundiert in den Blutkreislauf und erreicht das periphere Gewebe, wo sie durch Glykolyse in Pyruvat umgewandelt wird, das Aminogruppen aus den freien Aminosäuren aufnehmen kann, wodurch der Zyklus geschlossen wird.
Daher stellt der Glucose-Alanin-Zyklus eine Verbindung zwischen Kohlenhydrat- und Aminosäurestoffwechsel her, wie nachstehend schematisch beschrieben.
Glucose → Pyruvat → Alanin → Pyruvat → Glucose
Der Glucose-Alanin-Zyklus tritt nicht nur zwischen dem Skelettmuskel, dem ersten Gewebe, in dem er beobachtet wurde, und der Leber auf, sondern umfasst auch andere Zellen und extrahepatische Gewebe, einschließlich Zellen des Immunsystems, wie lymphoide Organe.
INHALT
- Die Schritte des Glucose-Alanin-Zyklus
- Der Cahill-Zyklus im Skelettmuskel
- Der Cahill-Zyklus in der Leber
- Transaminasen
- Funktionen des Glucose-Alanin-Zyklus
- Energiekosten des Glucose-Alanin-Zyklus
- Ähnlichkeiten und Unterschiede zwischen Cahill-Zyklus und Cori-Zyklus
Die Schritte des Glucose-Alanin-Zyklus
Die Analyse der Schritte des Glucose-Alanin-Zyklus erfolgt unter Berücksichtigung des Zyklus zwischen Skelettmuskel und Leber.
Sowohl intrazelluläre als auch extrazelluläre Proteine werden kontinuierlich zu den konstituierenden Aminosäuren hydrolysiert und resynthetisiert, und die Geschwindigkeit, mit der diese Prozesse ablaufen, wird genau ausgeglichen, wodurch der Verlust von fettfreier Masse verhindert wird.
Unter katabolen Bedingungen wie intensivem und längerem Training oder Fasten übersteigt die Rate des Muskelproteinabbaus jedoch die Synthese. Dies führt zur Freisetzung von Aminosäuren, von denen einige zur Energiegewinnung und andere zur Glukoneogenese verwendet werden. Und die Oxidation der Kohlenstoffskelette von Aminosäuren, insbesondere verzweigtkettigen Aminosäuren oder BCAA (Leucin, Isoleucin und Valin), kann eine bedeutende Energiequelle für den Muskel sein. Zum Beispiel liefert die Aminosäureoxidation im Muskel nach etwa 90 Minuten anstrengenden Trainings 10-15% der Energie, die für die Kontraktion benötigt wird.
Die Nutzung der Kohlenstoffgerüste von Aminosäuren zur Energiegewinnung beinhaltet die Entfernung der Aminogruppe und dann die Ausscheidung von Aminostickstoff in einer nicht toxischen Form.
Die Entfernung der α-Aminogruppe erfolgt durch Transaminierung, die wie folgt zusammengefasst werden kann:
α-Ketosäure + Aminosäure ⇄ Neue Aminosäure + Neue α-Ketosäure
Solche Reaktionen, katalysiert durch Enzyme, die als Aminotransferasen oder Transaminasen (EC 2.6.1) bezeichnet werden, sind frei reversibel.
Verzweigtkettige Aminosäuren übertragen beispielsweise die Aminogruppe auf α-Ketoglutarat oder 2-Oxoglutarsäure, um Glutamat und die von der ursprünglichen Aminosäure abgeleitete α-Ketosäure in einer durch verzweigtkettige Aminotransferase oder BCAT katalysierten Reaktion zu bilden (EC 2.6 .1.42).
Der Cahill-Zyklus im Skelettmuskel
Im Skelettmuskel kann das neu gebildete Glutamat mit Ammoniak reagieren, um Glutamin zu bilden, für viele Gewebe und Organe, wie das Gehirn, das Hauptvehikel für den interorganischen Transport von Stickstoff. Die Reaktion wird durch das zytosolische Enzym Glutaminsynthetase (EC 6.3.1.2) katalysiert und verbraucht ein ATP.
Glutamat + NH4+ + ATP → Glutamin + ADP + Pi
In diesem Fall verlässt Glutamat den Cahill-Zyklus.
Alternativ und im Gegensatz zu den meisten anderen Geweben kann das neu gebildete Glutamat die Aminogruppe auf Pyruvat übertragen, das aus der Glykolyse stammt, um Alanin und α-Ketoglutarat zu bilden. Diese Transaminierung wird durch Alaninaminotransferase oder ALT (EC 2.6.1.2) katalysiert, ein Enzym, das in den meisten tierischen und pflanzlichen Geweben vorkommt.
Glutamat + Pyruvat ⇄ Alanin + α-Ketoglutarat
Das produzierte Alanin, das direkt aus dem Proteinabbau stammt, und Muskelproteine, die reich an Alanin sind, können die Zelle verlassen und über den Blutkreislauf in die Leber transportiert werden; Auf diese Weise erreicht die Aminogruppe die Leber. Und die Geschwindigkeit, mit der Alanin, das durch Transaminierung von Pyruvat gebildet wird, in den Kreislauf überführt wird, ist proportional zur intrazellulären Pyruvatproduktion.
Hinweis: Alanin und Glutamin sind die Hauptquellen für Stickstoff und Kohlenstoff im interorganischen Aminosäurestoffwechsel.
Der Cahill-Zyklus in der Leber
Einmal in der Leber katalysiert eine hepatische Alaninaminotransferase eine Transaminierung, bei der Alanin, die wichtigste glukoneogene Aminosäure, als Aminogruppendonor und α-Ketoglutarat als α-Ketosäureakzeptor wirkt. Die Reaktionsprodukte sind Pyruvat, d. H. Das Kohlenstoffgerüst von Alanin, und Glutamat.
Alanin + α-Ketoglutarat ⇄ Glutamat + Pyruvat
Glutamat, in der durch Glutamatdehydrogenase katalysierten Reaktion (EC 1.4.1.2), ein Enzym, das in der Mitochondrienmatrix vorhanden ist, bildet Ammoniumion, das in den Harnstoffzyklus eintritt, und α-Ketoglutarat, das in den Krebszyklus eintreten kann. Diese Reaktion ist eine anaplerotische Reaktion, die den Aminosäurestoffwechsel mit dem Krebszyklus verbindet.
Glutamat + H2O + NAD+ ⇄ α-Ketoglutarat + NH4+ + NADH + H+
Glutamat kann jedoch auch mit Oxalacetat unter Bildung von Aspartat und α-Ketoglutarat in einer durch Aspartataminotransferase katalysierten Reaktion reagieren (EC 2.6.1.1). Aspartat ist an der Bildung von Harnstoff sowie an der Synthese von Purinen und Pyrimidinen beteiligt.
Glutamat + Oxalacetat ⇄ Aspartat + α-Ketoglutarat
Auch das produzierte Pyruvat kann unterschiedliche metabolische Schicksale haben: Es kann für die ATP-Produktion oxidiert werden und dann den Glucose-Alanin-Zyklus verlassen oder in den Gluconeogenese-Weg eintreten und somit im Zyklus fortfahren.
Die produzierte Glukose wird aus der Leber in den Blutkreislauf freigesetzt und an verschiedene Gewebe abgegeben, die sie benötigen, wie der Skelettmuskel, in dem sie für die Pyruvatsynthese verwendet wird. Das neu gebildete Pyruvat wiederum kann mit Glutamat reagieren und so den Zyklus schließen.
Transaminasen
Wie bereits erwähnt, erfolgt die Entfernung der Aminogruppe aus Aminosäuren durch Transaminierung (siehe oben für die allgemeine Reaktion). Diese Reaktionen werden durch Enzyme katalysiert, die als Aminotransferasen oder Transaminasen bezeichnet werden.
Es handelt sich um zytosolische Enzyme, die in allen Zellen vorkommen und besonders häufig in Leber, Niere, Darm und Muskel vorkommen. Sie benötigen Pyridoxalphosphat oder PLP, die aktive Form von Vitamin B6 oder Pyridoxin, als Coenzym, das fest an das aktive Zentrum gebunden ist.
Bei Transaminierungsreaktionen wird die Aminogruppe der freien Aminosäuren, mit Ausnahme von Threonin und Lysin, zu einer kleinen Anzahl von α-Ketosäuren geleitet, insbesondere Pyruvat, Oxalacetat und α-Ketoglutarat.
Zellen enthalten verschiedene Arten von Aminotransferasen: Viele sind spezifisch für α-Ketoglutarat als α-Ketosäureakzeptor, unterscheiden sich jedoch in der Spezifität für die Aminosäure, nach der sie benannt sind. Beispiele sind die oben genannte Alaninaminotransferase, auch Alanintransaminase und Glutaminbenztraubentransferase oder GPT genannt, und Aspartataminotransferase oder AST, auch Glutaminoxalessigsäure-Transaminase oder GOT genannt.
Es sollte unterstrichen werden, dass bei diesen Reaktionen keine Nettodesaminierung und kein Verlust von Aminogruppen auftritt, da der α-Ketosäureakzeptor aminiert und die Aminosäure desaminiert wird.
Funktionen des Glucose-Alanin-Zyklus
Dieser Zyklus hat verschiedene Funktionen.
- Es transportiert Stickstoff in ungiftiger Form von peripheren Geweben zur Leber.
- Es transportiert Pyruvat, ein glukoneogenes Substrat, in die Leber.
- Es entfernt Pyruvat aus peripheren Geweben. Dies führt zu einer höheren Produktion von ATP aus Glukose in diesen Geweben. Tatsächlich kann das während der Glykolyse produzierte NADH in die Mitochondrien gelangen und durch oxidative Phosphorylierung oxidiert werden.
- Es ermöglicht, eine relativ hohe Konzentration von Alanin in Hepatozyten aufrechtzuerhalten, die ausreicht, um den Proteinabbau zu hemmen.
- Es kann eine Rolle bei der Abwehr von Infektionskrankheiten spielen.
Schließlich ist es wichtig zu betonen, dass es im Glucose-Alanin-Zyklus keine Nettoglucosesynthese gibt.
Energiekosten des Glucose-Alanin-Zyklus
Wie der Cori-Zyklus hat auch der Glucose-Alanin-Zyklus Energiekosten von 3-5 ATP.
Der Teil des Zyklus, der in peripheren Geweben stattfindet, beinhaltet die Produktion von 5-7 ATP pro Molekül Glucose:
- 2 ATP werden durch Glykolyse hergestellt;
- 3-5 ATP stammen aus NADH /FADH2 (siehe unten).
Stattdessen kosten Glukoneogenese und Harnstoffzyklus in der Leber 10 ATP:
- 6 ATP werden während der Glukoneogenese pro synthetisiertes Glucosemolekül verbraucht;
- 4 ATP werden im Harnstoffzyklus pro synthetisiertes Harnstoffmolekül verbraucht.
Der Glucose-Alanin-Zyklus verschiebt wie der Cori-Zyklus einen Teil der Stoffwechsellast von extrahepatischen Geweben in die Leber. Die von der Leber gezahlten Energiekosten sind jedoch durch die Vorteile gerechtfertigt, die der Zyklus für den gesamten Körper mit sich bringt, da er unter bestimmten Bedingungen einen effizienten Abbau von Proteinen in extrahepatischen Geweben (insbesondere Skelettmuskeln) ermöglicht, was wiederum die Gewinnung glukoneogener Substrate sowie die Verwendung von Aminosäuren zur Energiegewinnung in extrahepatischen Geweben ermöglicht.
Ähnlichkeiten und Unterschiede zwischen Cahill-Zyklus und Cori-Zyklus
Es gibt einige Analogien zwischen den beiden Zyklen, die unten aufgeführt sind.
- Der Cahill-Zyklus überlappt den Cori-Zyklus teilweise, wenn Pyruvat in Glucose umgewandelt wird und das Monosaccharid zu extrahepatischen Geweben transportiert wird, in denen es über den glykolytischen Weg wieder in Pyruvat umgewandelt wird.
- Der Eintritt in die Glukoneogenese ist für die beiden Zyklen ähnlich: Sowohl Alanin als auch Lactat werden in Pyruvat umgewandelt.
- Wie der Cori-Zyklus tritt der Glucose-Alanin-Zyklus zwischen verschiedenen Zelltypen auf, im Gegensatz zu Stoffwechselwegen wie Glykolyse, Krebs-Zyklus oder Glukoneogenese, die innerhalb einzelner Zellen auftreten
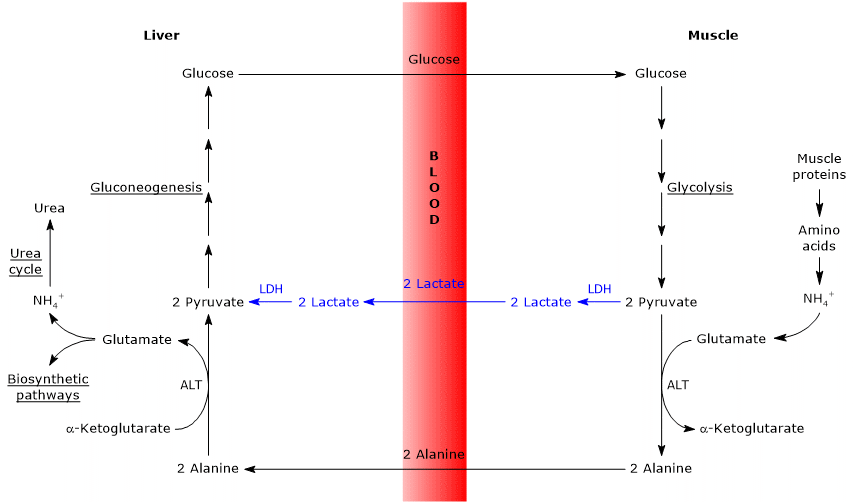
Nachfolgend einige Unterschiede zwischen den beiden Zyklen.
- Der Hauptunterschied betrifft die drei Kohlenstoffatome, die aus peripheren Geweben in die Leber gelangen: laktat im Cori-Zyklus und Alanin im Glucose-Alanin-Zyklus.
- Ein weiterer Unterschied betrifft das Schicksal des NADH, das durch Glykolyse in peripheren Geweben produziert wird.
Im Cori-Zyklus wirkt das Coenzym als Reduktionsmittel, um Pyruvat in der durch Lactatdehydrogenase katalysierten Reaktion zu Lactat zu reduzieren (EC 1.1.1.27).
Im Glucose-Alanin-Zyklus tritt diese Reduktion nicht auf und die Elektronen von NADH können über die Malat-Aspartat- und Glycerin-3-Phosphat-Shuttles in die Mitochondrien transportiert werden, wobei NADH, das erste Shuttle, und FADH2, das andere Shuttle, erzeugt werden. Und die Ausbeute an ATP aus NADH und FADH2 beträgt 2,5 bzw. 1,5. - Schließlich ist aus dem vorherigen Punkt klar, dass der Cahill-Zyklus im Gegensatz zum Cori-Zyklus die Anwesenheit von Sauerstoff und Mitochondrien in den peripheren Geweben erfordert.
Berg J.M., Tymoczko J.L. und Stryer L. Biochemie. 5. Auflage. W. H. Freeman and Company, 2002
Felig P., Pozefsk T., Marlis E., Cahill G.F. Alanin: Schlüsselrolle bei der Glukoneogenese. Wissenschaft 1970; 167 (3920): 1003-4. doi:10.1126/Wissenschaft.167.3920.1003
Gropper S.S., Schmied J.L., Groff J.L. Erweiterte ernährung und menschlichen stoffwechsel. Cengage Learning, 2009
Lecker S.H., Goldberg A.L. und Mitch W.E. Proteinabbau durch den Ubiquitin-Proteasom-Weg in normalen und Krankheitszuständen. J Am Soc Nephrol 2006;17(7):1807-19. Ursprungsbezeichnung:10.1681/ASN.2006010083
Mallette LE, Exton JH und Park CR Kontrolle der Gluconeogenese aus Aminosäuren in der perfundierten Rattenleber. J Biol Chemie 1969;244(20): 5713-23.
Nelson D.L., Cox M.M. Lehninger. Prinzipien der Biochemie. 6. Auflage. W.H. Freeman und Unternehmen, 2012
Raju S.M., Madala B. Illustrierte medizinische Biochemie. Jaypee Brothers Publishers, 2005
Wu G. Aminosäuren: Biochemie und Ernährung. SFB Presse, 2013