Die Beweise für natürliche Interventionen für nichtalkoholische Fettlebererkrankung: Pflanzenstoffe, Nährstoffe und Probiotika zur Behandlung dieser häufigen Erkrankung
Angesichts des Anstiegs der nichtalkoholischen Fettlebererkrankung (NAFLD) bei Erwachsenen und Pädiatrie und das Fehlen einer indizierten pharmazeutischen Behandlung, Natürliche Strategien zur Behandlung dieser Erkrankung stehen als „nächstbeste Sache“ gut da.“ Mehrere Nahrungsergänzungsmittel und Pflanzenstoffe wurden klinisch untersucht und sind vielversprechend für die Behandlung von NAFLD und seinem entzündlichen Gegenstück, der nichtalkoholischen Steatohepatitis (NASH). Angesichts der Tatsache, wie viele dieser Therapien die Faktoren ansprechen, die zur Entwicklung von NAFLD beitragen, bedarf es nicht vieler Überlegungen, um zu verstehen, wie sie einige der Grundursachen von Krankheiten wirksam angehen können, anstatt nur ein Symptom anzugehen.
Fünf ergänzende Interventionen mit klinischem oder epidemiologischem Nachweis für ihre Verwendung bei der Behandlung von NAFLD sind Phosphatidylcholin, das Phospholipide und Cholin liefert, Vitamin E, sowohl als Alpha-Tocopherole als auch eine Mischung aus Delta- und Gamma-Tocotrienolen, Mariendistelsamenextrakt, Berberin und Probiotika.
- Fettleberveränderungen: Korreliert mit einem Phosphatidylcholinmangel?
- Vitamin E
- Mariendistel
- Berberin
- Probiotika
- Fazit
- Dr. Carrie Decker, ND, schloss ihr Studium mit Auszeichnung am National College of Natural Medicine (heute National University of Natural Medicine) in Portland, Oregon, ab. Dr. Decker sieht Patienten aus der Ferne, mit Schwerpunkt auf Magen-Darm-Erkrankungen, Stimmungsstörungen, Essstörungen, Autoimmunerkrankungen und chronischer Müdigkeit. Bevor er Naturheilkundler wurde, war Dr. Decker Ingenieur und erwarb einen Abschluss in Biomedizin und Maschinenbau an der University of Wisconsin-Madison bzw. der University of Illinois in Urbana-Champaign. Dr. Decker genießt weiterhin die akademische Forschung und das Schreiben und nutzt diese Fähigkeiten, um die Ausbildung in integrativer Medizin als Autor und Mitwirkender an verschiedenen Ressourcen zu unterstützen. Dr. Decker unterstützt die Allergy Research Group als Mitglied ihres Ausbildungs- und Produktentwicklungsteams.
- Quellen:
- Spengler EK, Loomba R. Empfehlungen zur Diagnose, Überweisung zur Leberbiopsie und Behandlung von nichtalkoholischer Fettlebererkrankung und nichtalkoholischer Steatohepatitis. Mayo Clinic Verfahren. 2015;90(9):1233–1246.
- Berardis S, Sokal E. Pädiatrische nichtalkoholische Fettlebererkrankung: ein zunehmendes Problem der öffentlichen Gesundheit. In: Eur Jjr. 2014 Februar;173(2):131-9.
- Jadeja R, et al. Pflanzliche Arzneimittel zur Behandlung von nichtalkoholischer Steatohepatitis: aktuelles Szenario und Zukunftsaussichten. Evid Basierte Ergänzung Alternat Med. 2014:648308.
- Pomorski T, et al. Lipidverteilung und Transport über Zellmembranen. In: Semin Cell Dev Biol. 2001 April;12(2):139-48.
- Yamaji-Hasegawa A, et al. Asymmetrische Verteilung von Phospholipiden in Biomembranen. In: Biol Pharm Bull. 2006 August;29(8): 1547-53.
- Hişmioğullari AA, et al. Biliäre Lipidsekretion. In: Turk J Gastroenterol. 2007 Juni;18(2):65-70.
- Fischer LM, et al. Geschlecht und Menopausenstatus beeinflussen die Ernährungsbedürfnisse des Menschen für den Nährstoff Cholin. Bin J Clin Nutr. 2007 Mai;85(5):1275-85.
- Wallace TC, et al. Die übliche Cholinaufnahme ist in den USA mit dem Verzehr von Eiern und Proteinen verbunden. Nährstoff. 2017 August 5;9(8).
- Zeisel SH. Genantwortelemente, genetische Polymorphismen und Epigenetik beeinflussen den menschlichen Ernährungsbedarf an Cholin. IUBMB Leben. 2007 Juni;59(6): 380-7.
- Zeisel SH. Genantwortelemente, genetische Polymorphismen und Epigenetik beeinflussen den menschlichen Ernährungsbedarf an Cholin. IUBMB Leben. 2007 Juni;59(6): 380-7.
- Guerrerio AL, et al. Cholinaufnahme in einer großen Kohorte von Patienten mit nichtalkoholischer Fettlebererkrankung. Bin J Clin Nutr. 2012 April;95(4):892-900.
- Ma X, et al. Polyenylphosphatidylcholin dämpft die nichtalkoholische Leberfibrose und beschleunigt deren Rückbildung. J Hepatol. 1996 Mai;24(5): 604-13.
- Lieber CS, et al. Phosphatidylcholin schützt vor Fibrose und Zirrhose im Pavian. Gastroenterologie. 1994 Januar;106(1):152-9.
- Chanussot F, et al. Prävention durch diätetische (n-6) mehrfach ungesättigte Phosphatidylcholine der durch Cyclosporin A induzierten intrahepatischen Cholestase bei Tieren. Life Sci. 2003 Juni 13;73(4): 381-92.
- Karaman A, et al. Schützende Wirkung von mehrfach ungesättigtem Phosphatidylcholin auf Leberschäden, die durch Gallenobstruktion bei Ratten induziert werden. J Pediatr Surg. 2003 September;38(9):1341-7.
- Karaman A, et al. Schützende Wirkung von mehrfach ungesättigtem Phosphatidylcholin auf Leberschäden, die durch Gallenobstruktion bei Ratten induziert werden. J Pediatr Surg. 2003 September;38(9):1341-7.
- Stremmel W, et al. Schleimhautschutz durch Phosphatidylcholin. Dig Dis. 2012;30 Ergänzung 3:85-91.
- Parlesak A, et al. Konjugierte primäre Gallensalze reduzieren die Permeabilität von Endotoxin durch Darmepithelzellen und synergisieren mit Phosphatidylcholin bei der Unterdrückung der entzündlichen Zytokinproduktion. In: Crit Care Med. 2007 Oktober;35(10): 2367-74.
- Mitzscherling K, et al. Phosphatidylcholin kehrt den Ethanol-induzierten Anstieg der transepithelialen Endotoxinpermeabilität um und hebt die transepitheliale Leukozytenaktivierung auf. Alkohol Clin Exp Res. 2009 Beschädigen;33(3): 557-62.
- Buzzetti E, et al. Die Multiple-Hit-Pathogenese der nichtalkoholischen Fettlebererkrankung (NAFLD). Stoffwechsel. August 2016;65(8):1038-48.
- El Hadi H, et al. Vitamin E als Behandlung für nichtalkoholische Fettlebererkrankung: Realität oder Mythos? Antioxidantien (Basel). 2018 Januar 16;7(1).
- Bugianesi E, et al. Eine randomisierte kontrollierte Studie mit Metformin im Vergleich zu Vitamin E oder einer verschreibungspflichtigen Diät bei nichtalkoholischer Fettlebererkrankung. Bin J Gastroenterol. 2005 Mai;100(5):1082-90.
- Sanyal AJ, et al. Pioglitazon, Vitamin E oder Placebo bei nichtalkoholischer Steatohepatitis. In: N Engl J Med. 2010 Mai 6;362(18): 1675-85.
- Lavine JE. Vitamin E Behandlung von nichtalkoholischer Steatohepatitis bei Kindern: Pilotstudie. J Pädiatrie. 2000 Juni;136(6): 734-8.
- Peh HY, et al. Vitamin E-Therapie jenseits von Krebs: Tocopherol versus Tocotrienol. In: Pharmacol Ther. 2016 Juni;162:152-69.
- Qureshi AA, et al. Dosisabhängige Modulation von Lipidparametern, Zytokinen und RNA durch Delta-Tocotrienol bei hypercholesterinämischen Probanden beschränkt auf AHA Step-1-Diät. Brit J von Med & Med Res. 2015;6(4): 351-66.
- Qureshi AA, et al. Auswirkungen von Delta-Tocotrienol auf entzündliche Biomarker und oxidativen Stress bei hypercholesterinämischen Probanden. In: Clin Exp Cardiology. 2015;6(4):1000367.
- Zaiden N, et al. Gamma-Delta-Tocotrienole reduzieren die hepatische Triglyceridsynthese und die VLDL-Sekretion. In: J Atheroscler Thromb. 2010 Oktober 27;17(10):1019-32.
- Magosso E, et al. Tocotrienole zur Normalisierung der echogenen Reaktion der Leber bei nichtalkoholischer Fettleber: eine randomisierte placebokontrollierte klinische Studie. Nutr J. 2013 Dezember 27;12(1):166.
- Pervez MA, et al. Auswirkungen der Delta-Tocotrienol-Supplementierung auf Leberenzyme, Entzündungen, oxidativen Stress und Lebersteatose bei Patienten mit nichtalkoholischer Fettlebererkrankung. In: Turk J Gastroenterol. 29. März 2018(2):170-176.
- Abenavoli L, et al. Mariendistel bei Lebererkrankungen: Vergangenheit, Gegenwart, Zukunft. Phytother Res. 2010 Oktober;24(10): 1423-32.
- Valenzuela A, et al. Selektivität von Silymarin auf die Erhöhung des GSH-Gehalts in verschiedenen Geweben der Ratte. Planta Med. 1989 Oktober;55(5): 420-2.
- Rui YC. Fortschritte in pharmakologischen Studien von Silymarin. Mem Inst Oswaldo Cruz. 1991;86 Beilage 2:79-85.
- Gu M, et al. Silymarin verbessert die metabolische Dysfunktion im Zusammenhang mit ernährungsbedingter Fettleibigkeit durch Aktivierung des Farnesyl X-Rezeptors. Front Pharmacol. 2016 September 28;7:345.
- Ali AH, et al. Jüngste Fortschritte in der Entwicklung von Farnesoid-X-Rezeptor-Agonisten. In: Ann Transl Med. 2015 Januar;3(1):5.
- Traussnigg S, et al. Wirksamkeit und Sicherheit des nichtsteroidalen Farnesoid-X-Rezeptoragonisten PX-104 bei Patienten mit nichtalkoholischer Fettlebererkrankung (NAFLD). Zeitschrift für Gastroenterologie. 2017 Kann;55(05):A71.
- Zhong S, et al. Die therapeutische Wirkung von Silymarin bei der Behandlung von nichtalkoholischen Fettkrankheiten: Eine Metaanalyse (PRISMA) randomisierter Kontrollstudien. Medizin (Baltimore). 2017 Dezember;96(49):e9061.
- Hajiaghamohammadi AA, et al. Auswirkungen der Behandlung mit Metformin, Pioglitazon und Silymarin auf die nichtalkoholische Fettlebererkrankung: eine randomisierte kontrollierte Pilotstudie. Hepatologie. 2012 August;12(8):e6099.
- Birdsall TC, et al. Berberin: therapeutisches Potenzial eines Alkaloids, das in mehreren Heilpflanzen vorkommt. 1997;2:94-103.
- Imanshahidi M, et al. Pharmakologische und therapeutische Wirkungen von Berberis vulgaris und seinem aktiven Bestandteil Berberin. Phytother Res. 2008 Aug;22(8):999-1012.
- Zhu X, et al. Die möglichen Mechanismen von Berberin bei der Behandlung von nichtalkoholischen Fettlebererkrankungen. Moleküle. 2016 Oktober 14;21(10).
- Lan J, et al. Metaanalyse der Wirkung und Sicherheit von Berberin bei der Behandlung von Typ-2-Diabetes mellitus, Hyperlipämie und Bluthochdruck. J Ethnopharmacol. 2015 Februar 23;161:69-81.
- Sonne R, et al. Oral verabreichtes Berberin moduliert den hepatischen Fettstoffwechsel durch Veränderung des mikrobiellen Gallensäurestoffwechsels und des intestinalen FXR-Signalwegs. Mol Pharmacol. 2017 Februar;91(2):110-122.
- Guo T, et al. Berberin verbessert die Lebersteatose und unterdrückt Leber- und Fettgewebsentzündungen bei Mäusen mit ernährungsbedingter Fettleibigkeit. Sci Rep. 2016 Beschädigen 3;6:22612.
- Schattenberg JM, et al. JNK1 aber nicht JNK2 fördert die Entwicklung von Steatohepatitis bei Mäusen. Hepatologie. 2006 Januar;43(1):163-72.
- Han J, et al. Modulation der Darmmikrobiota als antidiabetischer Mechanismus von Berberin. In: Med Sci Monit. 2011;17:RA164-7.
- Gu L, et al. Berberin verbessert intestinale epitheliale Tight-Junction-Schäden und reguliert die Myosin-Light-Chain-Kinase-Pfade in einem Mausmodell der Endotoxinämie herunter. J Infizieren Sie Dis. 2011 Juni 1;203(11): 1602-12.
- Li N, et al. Berberin dämpft proinflammatorische Zytokin-induzierte Tight-Junction-Disruption in einem In-vitro-Modell von Darmepithelzellen. Eur J Pharm Sci. 2010 April 16;40(1):1-8.
- Ma X, et al. Die Pathogenese von Diabetes mellitus durch oxidativen Stress und Entzündung: Seine Hemmung durch Berberin. Front Pharmacol. 2018 Juli 27;9:782.
- Yan HM, et al. Wirksamkeit von Berberin bei Patienten mit nichtalkoholischer Fettlebererkrankung. Plus Eins. 2015 August 7;10(8):e0134172.
- Ma YY, et al. Auswirkungen von Probiotika auf nichtalkoholische Fettlebererkrankungen: eine Metaanalyse. Welt J Gastroenterol. 2013 Oktober 28;19(40): 6911-8.
- Vajro P, et al. Auswirkungen von Lactobacillus rhamnosus Stamm GG bei pädiatrischer Adipositas-bedingter Lebererkrankung. J Pediatr Gastroenterol Nutr. 2011 Juni;52(6): 740-3.
- Alisi A, et al. Randomisierte klinische Studie: Die vorteilhaften Wirkungen von VSL # 3 bei adipösen Kindern mit nichtalkoholischer Steatohepatitis. In: Aliment Pharmacol Ther. 2014 Juni;39(11): 1276-85.
- Pérez-Rubio KG, et al. Wirkung der Berberinverabreichung auf das metabolische Syndrom, die Insulinsensitivität und die Insulinsekretion. In: Metab Syndr Relat Disord. 2013 Oktober;11(5):366-9.
- Iacono A, et al. Probiotika als aufkommende therapeutische Strategie zur Behandlung von NAFLD: Fokus auf molekulare und biochemische Mechanismen. In: J Nutr Biochem. 2011 August;22(8): 699-711.
- Honda Y, et al. Wirksamkeit von Glutathion zur Behandlung der nichtalkoholischen Fettlebererkrankung: eine offene, einarmige, multizentrische Pilotstudie. In: BMC Gastroenterol. 2017 August 8;17(1):96.
- Dentico P, et al. . In: Recenti Prog Med. 1995 Juli-August;86(7-8):290-3.
- Khoshbaten M, et al. N-Acetylcystein verbessert die Leberfunktion bei Patienten mit nichtalkoholischer Fettlebererkrankung. Hepatitis Mon. 2010;10(1):12-16.
- Muto C, et al. Gamma-Tocotrienol reduziert den Triacylglycerinspiegel in primären Hepatozyten der Ratte durch Regulation des Fettsäurestoffwechsels. J Clin Biochem Nutr. 2013;52(1):32-37.
- Parker HM, et al. Omega-3-Supplementierung und nichtalkoholische Fettlebererkrankung: eine systematische Überprüfung und Metaanalyse. J Hepatol. 2012;56(4):944-51.
Fettleberveränderungen: Korreliert mit einem Phosphatidylcholinmangel?
Phosphatidylcholin (PC) ist essentiell für die Gesundheit aller Zellen im Körper und ist eines der wichtigsten Phospholipide, aus denen Zellmembranen bestehen., PC umfasst über 90% des Gesamtgallenphospholipidgehalts und erleichtert fette Emulgierung, Absorption und Transport. Studien haben gezeigt, dass die empfohlene ausreichende Zufuhr (AI) von Cholin (siehe Tabelle 1) möglicherweise nicht ausreicht, um Mangelerscheinungen wie Fettleberveränderungen oder Muskelschäden vorzubeugen. Darüber hinaus ergab eine kürzlich durchgeführte Studie, dass nur 8% der Erwachsenen in den USA die empfohlene Cholindosis einhalten, wobei Vegetarier, postmenopausale Frauen und Männer das größte Risiko für Unzulänglichkeiten haben. Genetische Polymorphismen können auch den Bedarf an Cholin erhöhen, das auch eine Quelle von Methylgruppen im Körper ist.
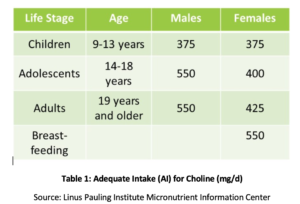
Bei postmenopausalen Frauen mit NAFLD wurde gezeigt, dass eine verminderte Cholinaufnahme signifikant mit einem erhöhten Fibroserisiko verbunden ist. Bei Tieren wurde gezeigt, dass PC vor Fibrose schützt, die mit einer Leberentzündung einhergeht. Es wurde gezeigt, dass eine erhöhte Aufnahme von PC die biliäre Lipidsekretion erhöht und dadurch Cholestase und nachfolgende Leberschäden über zahlreiche Mechanismen verhindert, einschließlich der Unterdrückung des Kernfaktors Kappa B (NF-kB), eines gut verstandenen molekularen Auslösers von Entzündungen. In einem Tiermodell der Gallenobstruktion wurde gezeigt, dass zusätzliches PC Leberschäden, duktale Proliferation und Fibrose reduziert.
PC ist auch essentiell für die Gesundheit des Darms und ist ein primärer Bestandteil der schützenden Darmschleim-Schicht. In Zellkulturen wurde gezeigt, dass die Behandlung mit PC die Migration von Endotoxin durch Darmepithelzellen reduziert und die damit verbundene entzündliche Zytokinreaktion weiter unterdrückt. PC reduziert auch die Endotoxin-Translokation in der Einstellung von Alkohol-induzierten Erhöhungen der Darmpermeabilität. Diese vorteilhafte Wirkung wurde als einer der Mechanismen vorgeschlagen, durch die PC bei alkoholischen Lebererkrankungen als therapeutisch angesehen werden kann.
Vitamin E
Da oxidativer Stress und verminderte antioxidative Abwehrkräfte als Faktor für die Entwicklung von NAFLD vorgeschlagen wurden, sollte es nicht überraschen, dass Antioxidantien als mögliche Behandlung für die Erkrankung untersucht wurden.
 Vitamin E wurde in mehreren klinischen Studien zur Behandlung von NAFLD sowohl als eigenständige als auch als Zusatztherapie untersucht. In einer Überprüfung dieser Studien lag die Dosierung von Vitamin E zwischen 400 und 1200 IE / Tag und die Studiendauer zwischen 24 Wochen und mehr als zwei Jahren. Die Ergebnisse waren im Allgemeinen positiv und zeigten, dass bei Aufnahme von Vitamin E Verbesserungen der Histologie, der Steatose und / oder der Transaminasespiegel beobachtet wurden., In der Pädiatrie mit NAFLD wurde Vitamin E auch als Therapie untersucht. In einer offenen Pilotstudie mit 11 Kindern mit NAFLD wurde festgestellt, dass die Supplementierung von 400 bis 1200 IE Vitamin E über einen Zeitraum von vier bis zehn Monaten die Transaminase- und alkalischen Phosphatase-Spiegel während der Behandlung normalisierte. Die hepatische Echogenität änderte sich im Verlauf der Behandlung nicht.
Vitamin E wurde in mehreren klinischen Studien zur Behandlung von NAFLD sowohl als eigenständige als auch als Zusatztherapie untersucht. In einer Überprüfung dieser Studien lag die Dosierung von Vitamin E zwischen 400 und 1200 IE / Tag und die Studiendauer zwischen 24 Wochen und mehr als zwei Jahren. Die Ergebnisse waren im Allgemeinen positiv und zeigten, dass bei Aufnahme von Vitamin E Verbesserungen der Histologie, der Steatose und / oder der Transaminasespiegel beobachtet wurden., In der Pädiatrie mit NAFLD wurde Vitamin E auch als Therapie untersucht. In einer offenen Pilotstudie mit 11 Kindern mit NAFLD wurde festgestellt, dass die Supplementierung von 400 bis 1200 IE Vitamin E über einen Zeitraum von vier bis zehn Monaten die Transaminase- und alkalischen Phosphatase-Spiegel während der Behandlung normalisierte. Die hepatische Echogenität änderte sich im Verlauf der Behandlung nicht.
Tocotrienole sind die weniger erforschte Familie der natürlich vorkommenden Formen von Vitamin E, wobei die in der Natur häufiger vorkommenden Tocopherole die wissenschaftliche Forschung dominieren. Tocotrienole sind jedoch starke Antioxidantien, die in einigen Untersuchungen als 40- bis 60-mal so antioxidativ wie Tocopherole bezeichnet werden. Es wurde gezeigt, dass Tocotrienole das Gesamtcholesterin und seine Fraktionen verbessern und das Gesamt- und LDL-Cholesterin um 15 bis 20% und die Triglyceride um fast 30% senken. Es wurde auch gezeigt, dass Tocotrienole in vivo entzündungshemmende und antioxidative Wirkungen haben, die den hochempfindlichen C-reaktiven Proteinspiegel (hs-CRP) senken und die LDL-Oxidation reduzieren.
Tocotrienole wurden auch zur Behandlung von NAFLD untersucht. Bei Patienten mit mit Ultraschall diagnostizierter NAFLD wurde gezeigt, dass 200 mg gemischte Tocotrienole (aus Palmöl gewonnen, mit einer hohen Gamma-Fraktion und zusätzlichen 61 mg Alpha-Tocopherolen), die zweimal täglich über ein Jahr eingenommen wurden, die echogene Reaktion und Remissionsrate der Leber im Vergleich zu Placebo signifikant normalisierten. In einer zweiten Studie, an der Patienten mit mit Ultraschall diagnostizierter NAFLD und Transaminaseerhöhung teilnahmen, senkten 300 mg Tocotrienole (eine 90: 10 Delta: Gamma-Mischung), die zweimal täglich über 12 Wochen eingenommen wurden, signifikant die Aspartataminotransferase (AST), Alaninaminotransferase (ALT), hs-CRP und Malondialdehyd (ein Marker für oxidativen Stress) sowie den Fettleberindex im Vergleich zu Placebo.
Mariendistel
Mariendistel (Silybum marianum) ist möglicherweise die bekannteste leberschützende Pflanze. Silymarin, eine Mischung der aktiven Bestandteile der Mariendistel, und Silibinin, die aktivste Verbindung, die darin gefunden wird, wurde in Tierversuchen gezeigt, um Leberschäden durch Paracetamol, Alkohol, Eisenüberladung und Strahlung unter anderen bekannten lebertoxischen Substanzen zu reduzieren. Es wurde gezeigt, dass Silymarin den Glutathionspiegel, ein starkes Antioxidans, sowohl in der Leber als auch im Darm erhöht. Es reduziert auch die Lipidperoxidation, die Zellmembranen schädigt, ihre Funktion verändert und möglicherweise den Zelltod verursacht.
Es wurde gezeigt, dass Silibinin und Silymarin einen nuklearen Gallensäurerezeptor aktivieren, der als Farnesoid-X-Rezeptor (FXR) in der Leber bekannt ist, Entzündungswege herunterreguliert und Insulinresistenz und Dyslipidämie korrigiert, die durch fettreiche Ernährung (HFD) hervorgerufen werden. FXR ist ein Schlüsselregulator des Gallensäure-, Glukose- und Lipidgleichgewichts im Körper. Medikamente, die mit FXR in ähnlicher Weise wie diese Mariendistel abgeleiteten Verbindungen interagieren, werden auch für die Behandlung von NAFLD und die damit verbundenen metabolischen Herausforderungen untersucht.
Klinische Studien haben auch gezeigt, dass Mariendistel verschiedene Parameter im Zusammenhang mit NAFLD verbessert. Eine Metaanalyse aus dem Jahr 2017 ergab, dass die Behandlung mit Mariendistel ALT und AST bei Patienten mit NAFLD signifikant um -5,08 IE / l bzw. -5,44 IE / L reduziert. Die Dosierungen reichten von 140 mg einmal täglich bis 200 mg dreimal täglich für eine Dauer von 8 bis 24 Wochen. Bei der niedrigsten Dosierung von 140 mg täglich wurden nach 8 Wochen signifikante Verbesserungen des Nüchternblutzuckers (FBG), des Lipidprofils und des Seruminsulinspiegels zusätzlich zu AST- und ALT-Reduktionen von 56 auf 37 beobachtet.77 IE/L und 78,73 bis 53,05 IE / L betragen.
Berberin
Berberin, das orangish-gelbe Alkaloid, das in pflanzlichen Stoffen wie Oregon Traubenwurzel und Rinde, Goldenseal und Berberitze gefunden wird, ist eine weitere botanisch abgeleitete Substanz, die zahlreiche Mechanismen hat, durch die es helfen kann, gegen NAFLD zu schützen und seine Auflösung zu unterstützen.,,
Die antidiabetische und lipidausgleichende Wirkung von Berberin wurde in mehreren klinischen Studien nachgewiesen, und  kann Mittel sein, über die Berberin die Leberfunktion positiv beeinflusst. Es wurde gezeigt, dass Berberin die stoffwechselbedingte Genexpression und den Gallensäurestoffwechsel über Wege verändert, an denen auch FXR beteiligt ist. In Tierversuchen wurde gezeigt, dass Berberin die Wirkung hat, HFD-assoziierte Adipositas und hepatische Triglyceridakkumulation bei Wildtyp-Mäusen (normal) zu verhindern, jedoch nicht bei Mäusen, die die genetische Elimination der intestinalen FXR-Expression aufwiesen. Es wurde auch gezeigt, dass Berberin Adipositas-assoziierte Entzündungen und Lebersteatose bei Mäusen unterdrückt, indem es die Phosphorylierung des als JNK1 bekannten Entzündungskomplexes verringert, einer Proteinkinase, die an der Entwicklung von Steatohepatitis beteiligt ist. JNK1 wird durch Umweltstressoren und entzündungsfördernde Zytokine stark aktiviert.
kann Mittel sein, über die Berberin die Leberfunktion positiv beeinflusst. Es wurde gezeigt, dass Berberin die stoffwechselbedingte Genexpression und den Gallensäurestoffwechsel über Wege verändert, an denen auch FXR beteiligt ist. In Tierversuchen wurde gezeigt, dass Berberin die Wirkung hat, HFD-assoziierte Adipositas und hepatische Triglyceridakkumulation bei Wildtyp-Mäusen (normal) zu verhindern, jedoch nicht bei Mäusen, die die genetische Elimination der intestinalen FXR-Expression aufwiesen. Es wurde auch gezeigt, dass Berberin Adipositas-assoziierte Entzündungen und Lebersteatose bei Mäusen unterdrückt, indem es die Phosphorylierung des als JNK1 bekannten Entzündungskomplexes verringert, einer Proteinkinase, die an der Entwicklung von Steatohepatitis beteiligt ist. JNK1 wird durch Umweltstressoren und entzündungsfördernde Zytokine stark aktiviert.
Berberin wirkt auch im Darm. Es beeinflusst nicht nur das mikrobielle Gleichgewicht im Darm, sondern beeinflusst auch direkt die Darmpermeabilität und verbessert die Integrität der engen Verbindungen bei Tieren, die Endotoxämie oder Zellkulturen ausgesetzt sind, die mit entzündungsfördernden Zytokinen behandelt wurden., Direkte entzündungshemmende Effekte sind auch demonstriert worden.
Die Vorteile von Berberin bei NAFLD wurden auch klinisch in einer randomisierten, parallel kontrollierten, offenen klinischen Studie nachgewiesen. Bei Patienten mit NAFLD wurde gezeigt, dass Berberin die normale Leberarchitektur, den Lipid- und Blutzuckerstoffwechsel wiederherstellt, mit signifikanten Verbesserungen gegenüber der Bevölkerung, die nur Änderungen des Lebensstils durchführte.
Probiotika
Angesichts der Beziehung zwischen den vielen Störungen des Verdauungssystems und der Erhöhung der Leberenzyme ist es nicht verwunderlich, dass Probiotika auch zur Behandlung von NAFLD untersucht wurden. Eine aktuelle Meta-Analyse fasst die kollektiven Ergebnisse gut zusammen.
Einhundertvierunddreißig Patienten, bei denen durch Leberbiopsie NAFL / NASH diagnostiziert wurde, wurden in diese Analyse einbezogen, und jede Intervention, die in den vier randomisierten, kontrollierten Studien verwendet wurde, die für diese Metaanalyse in Frage kamen, war einzigartig (Lactobacillus bulgaricus und Streptococcus thermophilus für drei Monate; Lactobacillus GG für acht Wochen; Bifidobacterium longum und Fructooligosaccharide (FOS) für 24 Wochen; und eine proprietäre Kombination von Lactobacillus plantarum, L. delbrueckii, L. acidophilus, L. rhamnosus und Bifidobacterium bifidum für sechs Monate). Die Dosierung von Probiotika lag zwischen 500 Millionen und 12 Milliarden koloniebildenden Einheiten (KBE) täglich. Es wurde gezeigt, dass die probiotischen Behandlungen die ALT- und AST-Spiegel signifikant um -23,71 UI / L bzw. -19,77 UI / L senken. Signifikante Verbesserungen des Gesamtcholesterins, des Tumornekrosefaktors (TNF) -α-Spiegels und der Insulinresistenz wurden ebenfalls festgestellt.
Zwei weitere klinische Studien untersuchten Probiotika als Behandlung für pädiatrische NAFLD. In einer doppelblinden, placebokontrollierten Pilotstudie wurden zwölf Kinder mit einem Durchschnittsalter von 10 Jahren untersucht.7 Jahre alt, mit Ultraschall-diagnostizierten Fettleberveränderungen und persistierender Transaminase-Erhöhung erhielten 12 Milliarden KBE L. rhamnosus GG oder Placebo täglich für 8 Wochen. Die Behandlung mit dem Probiotikum reduzierte die ALT-Spiegel im Vergleich zu Placebo signifikant, die Echogenität der Leber und die AST-Spiegel änderten sich jedoch nicht. Darüber hinaus nahmen Anti-Peptidoglycan-Polysaccharid-Antikörper, ein Indikator für Bakterien oder bakterielle Membrantranslokation durch die Darmbarriere, bei Kindern, die das Probiotikum erhielten, im Vergleich zu Placebo signifikant ab. Die zweite Studie untersuchte die Behandlung von Kindern mit biopsiebewiesener NAFLD mit VSL # 3, einer hochwirksamen Mischung aus 8 probiotischen Stämmen (einschließlich Streptococcus thermophilus, 3 Bifidobakterien spp., und 4 Lactobacillus spp.), im Vergleich zu Placebo. Bei Kindern, die das Probiotikum erhielten, waren die Fettleberwerte signifikant verbessert, wobei die Wahrscheinlichkeit für keine, leichte, mittelschwere oder schwere Fettleber am Ende der Studie 21%, 70%, 9% und 0% betrug im Vergleich zu 0%, 7%, 76% und 17% in der Placebogruppe.
Fazit
Es gibt eine breite Palette sicherer und wirksamer Optionen, die die Wiederherstellung der Gesundheit von Menschen mit NAFLD unterstützen. Obwohl jeder einzelne unterschiedliche zugrunde liegende Mechanismen haben kann, die zu Leberfunktionsstörungen und entzündlichen Veränderungen beitragen, kann jeder dieser unterstützenden natürlichen Wirkstoffe — und viele andere (siehe Tabelle 2) – die normale Leberfunktion bei Personen mit diesen Herausforderungen unterstützen.
Tabelle 2: Ernährungsphysiologische und botanische Interventionen bei NAFLD. Nährstoffe wie diese sollten unter Anleitung eines qualifizierten und zugelassenen Arztes verwendet werden.
| Nährstoff | Dosierung | Mechanismus |
| Phosphatidylcholin (PC), eine Quelle für diätetisches Cholin | 1,5 g zweimal täglich zu den Mahlzeiten (PC) ODER 200 mg zweimal täglich (Cholin) | Cholin ist ein häufiger Mangel in der Nahrung. PC ist notwendig für die Produktion von Galle und schützende Magen-Darm-Schleimhaut-Barriere. |
| Mariendistelsamen | 140 bis 200 mg ein- bis dreimal täglich | Hepatoprotektiv. Unterstützt den Glutathionspiegel in der Leber, stabilisiert die Gallensalzexportpumpe (BSEP) und aktiviert die FXR-Signalwege. |
| Berberin HCl | 500 mg zwei- bis dreimal täglich | Verbessert die Serumglukose- und Lipidprofile und reduziert auch den Leberfettgehalt. |
| Probiotika, einschließlich Stämme wie B. longum, B. bifidum, S. thermophilus, L. rhamnosus, L. acidophilus und L. plantarum | 12 Milliarden koloniebildende Einheiten (KBE) täglich | Verbesserte Darmepithelbarrierefunktion und reduzierte intestinale und systemische Entzündungen. |
| Acetyl-Glutathion | 300 mg täglich | Verbessert die Entgiftungsfähigkeit von Hepatozyten. |
| N-Acetylcystein (NAC) | 500-600 mg zweimal täglich, am besten auf nüchternen Magen eingenommen | NAC blockiert die Ausbreitung der Lipidperoxidation und unterstützt den Glutathionspiegel in der Leber. |
| Vitamin E (Tocopherole)
ODER Tocotrienole |
400 bis 1200 IE täglich mit Nahrung
200 bis 300 mg zweimal täglich mit Nahrung |
Schützendes Antioxidans.
Tocotrienole dämpfen die Triglyceridakkumulation, indem sie die Enzyme Fettsäuresynthase und Carnitinpalmitoyltransferase regulieren, was zu einer Verringerung der Leberentzündung und des endoplasmatischen Retikulumstresses führt. |
| Essentielle Omega–3-Fettsäuren | 2 – 4 g täglich zu den Mahlzeiten | Es ist bekannt, dass mehrfach ungesättigte Omega-3-Fettsäuren das sterolregulatorische Element-bindende Protein-1c herunterregulieren und den Peroxisomen-Proliferator-aktivierten Rezeptor alpha hochregulieren, wodurch die Fettsäureoxidation begünstigt und die Steatose reduziert wird. |