Einführung
Spannungsgesteuerte Kaliumkanäle bilden eine große und vielfältige Familie, die evolutionär konserviert ist. Es gibt 40 menschliche spannungsgesteuerte Kaliumkanalgene, die zu 12 Unterfamilien gehören. Diese KV-Kanäle weisen eine breite Verteilung im Nervensystem und anderen Geweben auf. Für erregbare Zellen wie Neuronen, Kardiomyozyten und Muskeln regulieren KV-Kanäle die Wellenform und das Zündmuster von Aktionspotentialen. KV-Kanäle können auch das Zellvolumen, die Proliferation und die Migration einer Vielzahl von Zelltypen regulieren.
Spannungsgesteuerte Kalium (KV)-Kanäle gehören zu einer der größten und evolutionär am besten konservierten Ionenkanalfamilien. Jeder KV-Kanal enthält vier ähnliche oder identische porenbildende α-Untereinheiten, und er kann auch zusätzliche β-Untereinheiten enthalten, die die Kanalfunktion und / oder Lokalisierung beeinflussen könnten . Jede porenbildende Untereinheit von KV-Kanälen enthält sechs Transmembransegmente (S1-S6), wobei die ersten vier Transmembransegmente (S1-S4) den Spannungssensor bilden und die letzten beiden Transmembransegmente eine Porenschleife (S5-P-S6) als Porendomäne flankieren. Zusätzlich zur Chromosomenposition jedes Kaliumkanalgens in Mensch, Maus und Ratte wurden die physiologischen und pharmakologischen Eigenschaften des Kanals sowie seine Gewebeverteilung und Pathophysiologie von der Ionenkanaldatenbank des Unterausschusses für spannungsgesteuerte Kaliumkanäle des Nomenklaturausschusses der Internationalen Union für Pharmakologie (NC-IUPHAR) bereitgestellt. Dieser Artikel bietet eine Einführung in die Vielfalt und Funktionen spannungsgesteuerter Kaliumkanäle.
Evolutionäre Konservierung von Kaliumkanälen
Die in Prokaryoten entstandene K + -Selektivität ist in einer großen Anzahl von Kaliumkanälen mit bemerkenswerter Vielfalt erhalten . Wie in Abbildung 1 gezeigt, kann ein evolutionärer Baum der spannungsgesteuerten Kationenkanal-Superfamilie vorgeschlagen werden, basierend auf dem Vergleich von Kanalgenen im menschlichen Genom mit denen in den Genomen anderer Metazoen, einschließlich Maus, Huhn, Kugelfisch, Tunika, Fruchtfliege, Mücke, Nematode und Seeanemone . Dieser Evolutionsbaum sieht einen einzigen Ursprung der K + -Selektivität für nach innen gleichgerichtete Kalium- (Kir-) Kanäle, spannungsgesteuerte Kalium- (KV-) Kanäle und die zweiporigen Kalium- (K2P-) Kanäle vor. Es ist jedoch wichtig zu beachten, dass eine deutliche K + -Selektivität wahrscheinlich mit dem evolutionär konservierten Organellen-K + -Kanal verbunden ist, der sich in Endosomen und Lysosomen befindet .
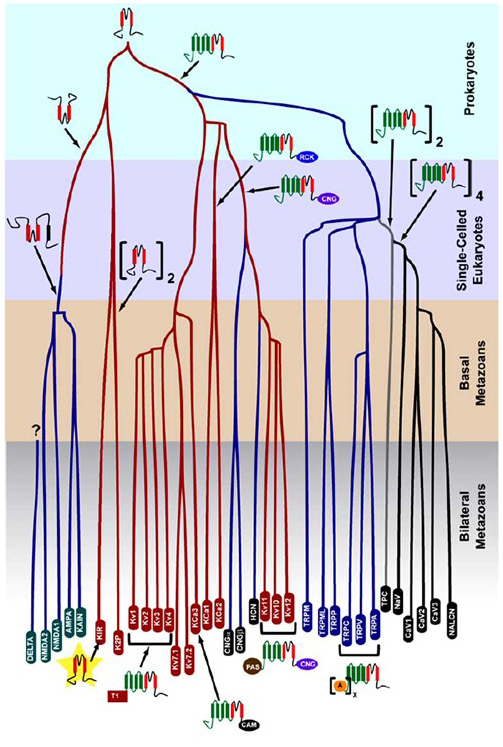
Abbildung 1. Ein evolutionärer Baum für die Entstehung der spannungsgesteuerten Kationenkanal-Superfamilie. Basierend auf genomweiten Analysen von Ionenkanälen von Nesseltieren und bilateralen Metazoen zeigt dieser Evolutionsbaum einen gemeinsamen Ursprung für die K + -Selektivität von Kaliumkanälen (mit Familiennamen in roten Ovalen), die mit tetrameren zyklischen nukleotidgesteuerten Kationenkanälen (CNG), hyperpolarisierungsgesteuerten Kationenkanälen (HCN) und TRP-Kanälen, den dimeren TPC-Kanälen und den monomeren Na + -, Ca2 + – und NALCN-Kanälen verwandt sind. Die Verzweigungslängen spiegeln nicht die Zeit wider. Die Genfamiliennamen am unteren Rand markieren einzelne Zweige. Ionotrope Glutamatrezeptoren sind eingeschlossen, basierend auf der Hypothese, dass sie aus einer Inversion der porenbildenden Domäne des Kaliumkanals mit zwei Transmembransegmenten (rot) stammen. Die Spannungssensordomäne hat vier Transmembransegmente (grün). A: Ankryin-Wiederholungen; CAM: Calmodulin-bindende Domäne; CNG: zyklische Nukleotid-bindende Domäne; PAS: Per-ARNT-Sim-Domäne; RCK: Regler der Leitfähigkeit der K + -Domäne; T1: Tetramerisierungsdomäne.
Vielfalt der spannungsgesteuerten Kaliumkanäle
Das menschliche Genom enthält ~ 80 Kaliumkanalgene, von denen 40 Gene spannungsgesteuerte kaliumkanalporenbildende Untereinheiten kodieren, die in 12 Unterfamilien fallen (Abb. 2). Physiologisch unterteilt in Kaliumkanäle vom A-Typ, die eine schnelle Inaktivierung aufweisen, und Kaliumkanäle vom verzögerten Typ, die keine schnelle Inaktivierung aufweisen, sind diese KV-Kanäle molekular und funktionell vielfältig. In KV1-Kanälen, die KV1 enthalten, ist eine schnelle Inaktivierung erkennbar, die sich auf die Aktionspotentialdauer während des wiederholten Zündens auswirken kann.4 oder KVß1, KV3 kanäle, und KV4 kanäle. Der verzögerte Gleichrichter-Kaliumstrom, der ursprünglich von Hodgkin und Huxley für seine Rolle im Aktionspotential charakterisiert wurde, entspricht wahrscheinlich den Squid-KV1-Kanälen, die sich auf die RNA-Editierung verlassen können, um die flexible funktionelle Vielfalt zu erreichen, da viele kleine Axone der riesigen Faserlappen-Neuronen verschmelzen, um das Squid-Riesenaxon mit größerer Aktionspotential-Leitungsrate zu bilden .
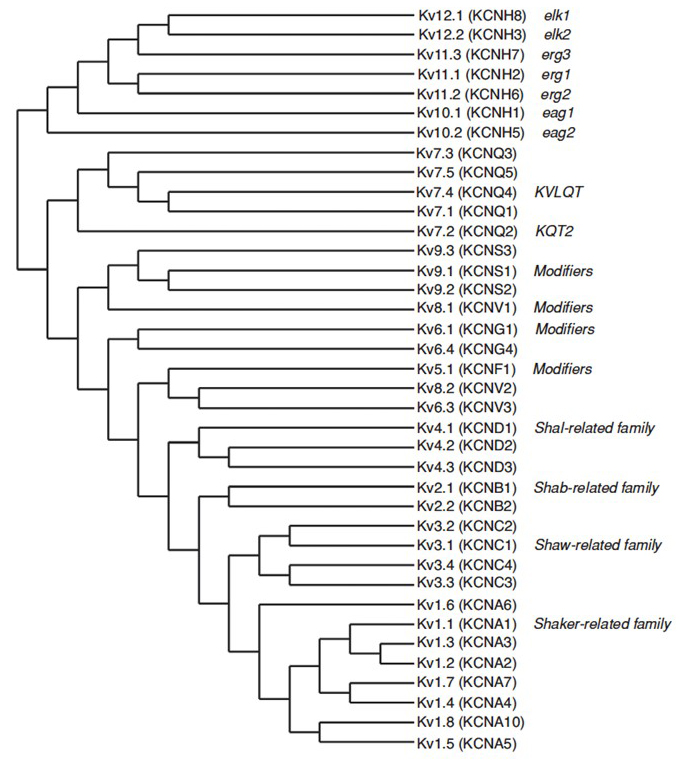
Abbildung 2. Stammbaum für die KV1-12 Familien. Dieser phylogenetische Baum basiert auf Analysen der hydrophoben Domäne, die die sechs Transmembransegmente (S1-S6) enthält. Sowohl die IUPHAR- als auch die HGNC-Namen (in Klammern) werden zusammen mit anderen häufig verwendeten Namen für diese spannungsgesteuerten Kaliumkanäle angezeigt.
Eine bemerkenswerte Vielfalt an KV-Kanälen kann durch das Mischen und Anpassen von KV-Kanaluntereinheiten erreicht werden. Innerhalb jeder der Familien KV1, KV2, KV3, KV4 und KV7 können sich homomere und heteromere Kanäle mit einer Reihe von funktionellen Eigenschaften bilden. KV2-Familienmitglieder können sich auch mit KV5-, KV6-, KV8- oder KV9-Familienmitgliedern mit eingeschränkteren Expressionsmustern im Nervensystem und in der glatten Muskulatur zusammensetzen , wie schematisch in Fig. 3.

Abbildung 3. KV-Kanalvielfalt durch Mischen und Anpassen von porenbildenden Kanaluntereinheiten. (A) Die tetrameren KV-Kanäle mit unterschiedlichen Eigenschaften und Verteilung umfassen homomere KV1-, KV2-, KV3-, KV4- und KV7-Kanäle, heteromere Kanäle, die von verschiedenen Mitgliedern innerhalb jeder dieser KV-Kanalfamilien gebildet werden, und heteromere Kanäle, die durch Zusammenfügen von KV2-Familienmitgliedern mit KV5-, KV6-, KV8- oder KV9-Familienmitgliedern gebildet werden. Die Familien KV5, KV6, KV8 und KV9 führen zu homomeren Kanälen, die aufgrund ihrer Retention im endoplasmatischen Retikulum wahrscheinlich elektrisch stumm sind , daher werden sie als KVS bezeichnet. (B) Die Assemblierung von KV2- und KVS-Familienmitgliedern umfasst ihre zytoplasmatischen N- und C-terminalen Domänen. (C, D) Die Anordnung von KV2- und KVS-Familienmitgliedern führt zu heteromeren Kanälen mit unterschiedlicher Spannungsabhängigkeit (C) und unterschiedlichen Angussmechanismen (D) im Vergleich zu homomeren Kanälen, die von KV2-Familienmitgliedern gebildet werden .
Funktionelle Unterschiede in der Spannungsabhängigkeit und Kinetik von KV-Kanälen liegen ihren differentiellen Beiträgen zur Aktionspotentialmodulation zugrunde (Abb. 4). Während KV1-, KV4- und KV7-Kanäle für ihre Aktivierung eine geringe Membrandepolarisation erfordern, werden KV2- und KV3-Kanäle durch eine stärkere Depolarisation aktiviert. Die ersteren, niederspannungsaktivierten KV-Kanäle können die Schwelle für die Aktionspotentialerzeugung und die Anzahl der während der Depolarisation erzeugten Aktionspotentiale oder exzitatorischen synaptischen Potentiale beeinflussen. Im Gegensatz dazu können die hochspannungsaktivierten KV-Kanäle die Aktionspotentialdauer und das Zündmuster modulieren. Die Kinetik von KV-Kanälen beeinflusst auch die Art und Weise, wie sie zur Erzeugung von Aktionspotentialen beitragen. Während die niederspannungsaktivierten KV1-Kanäle mit schneller Aktivierung den Aktionspotentialschwellenwert und die Wellenform beeinflussen können, können die hochspannungsaktivierten KV3-Kanäle und KV2-Kanäle aufgrund des Unterschieds in ihrer Aktivierungskinetik sequentiell während eines Aktionspotentials aktiviert werden, und KV2-Kanäle können aufgrund ihrer langsamen Inaktivierungskinetik länger anhaltende Effekte haben. Darüber hinaus könnten KV4-Kanäle mit schneller Inaktivierung aufgrund der Unterdrückung der KV4-Kanalaktivität durch Depolarisation zu dem Unterschied in der Aktionspotentialwellenform während des wiederholten Zündens beitragen .
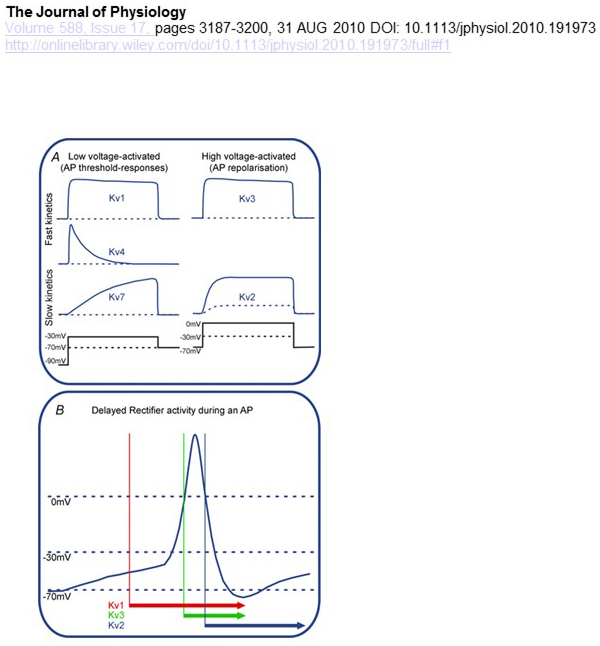
Abbildung 4. Funktionelle Unterschiede von KV-Kanälen und ihre Beiträge zum Aktionspotential. (A) Verschiedene KV-Kanäle haben unterschiedliche Spannungsabhängigkeit für die Aktivierung und unterschiedliche Kinetik . (B) Die niederspannungsaktivierten KV1-Kanäle mit schneller Kinetik öffnen sich, wenn die Zelle in Richtung der Schwelle für die Aktionspotentialerzeugung depolarisiert wird. Während sowohl KV2- als auch KV3-Kanäle hochspannungsaktiviert sind, öffnen sich KV3-Kanäle während eines Aktionspotentials früher als KV2-Kanäle. Es kann auch länger dauern, bis KV2-Kanäle nach einem Aktionspotential geschlossen werden .
Mögliche therapeutische Anwendungen von Kaliumkanalmodulatoren
Die Fähigkeit von Kaliumkanalmodulatoren, Aktionspotential-Zündmuster zu verändern, hat die Frage aufgeworfen, ob sie von therapeutischem Wert sein könnten . Wie in Fig. 5 können verschiedene neurologische und psychische Störungen Veränderungen in den Aktionspotential-Zündmustern beinhalten, die durch KV-Kanalaktivatoren und -blocker moduliert werden könnten . Spannungsgesteuerte Kaliumkanäle können auch eine Rolle bei der Zellproliferation und -migration spielen; KV-Kanalmodulatoren wurden daher für mögliche Behandlungen des Krebswachstums und der Metastasierung in Betracht gezogen . In Fig. 6 wird die KV1.2-Kanalstruktur schematisch verwendet, um zu veranschaulichen, dass KV-Kanalmodulatoren die Kanalaktivität hemmen können, indem sie entweder den Kanalpermeationspfad verschließen, wie im Fall von Toxinen mit äußerer Porenblockierung und inneren Porenblockern, oder über ihre Wechselwirkung mit dem Spannungssensor, um den geschlossenen Zustand des Kanals zu stabilisieren, wie im Fall von Gating-Modifikator-Toxinen. Alternativ wirken einige kleine Moleküle durch Bindung an die Gating-Maschinerie als Gating-Modifikatoren oder durch Wechselwirkung mit der Grenzfläche zwischen den α- und β-Untereinheiten, um die Kanalaktivität zu verändern .
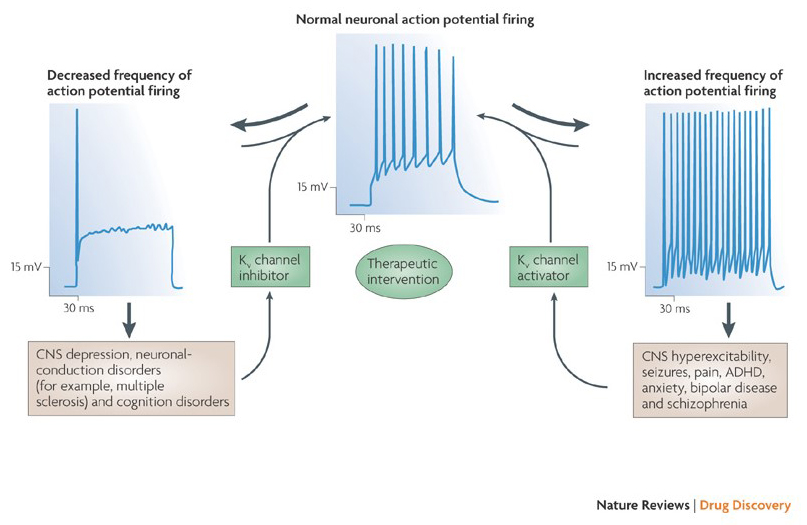
Abbildung 5. Mögliche Anwendungen von KV-Kanalmodulatoren. Da abnormale Aktionspotential-Zündmuster mit Krankheiten wie Epilepsie und Multipler Sklerose in Verbindung gebracht wurden, wurden KV-Kanalaktivatoren und -inhibitoren für potenzielle therapeutische Behandlungen von Krankheiten in Betracht gezogen, die eine Veränderung der neuronalen Erregbarkeit beinhalten .
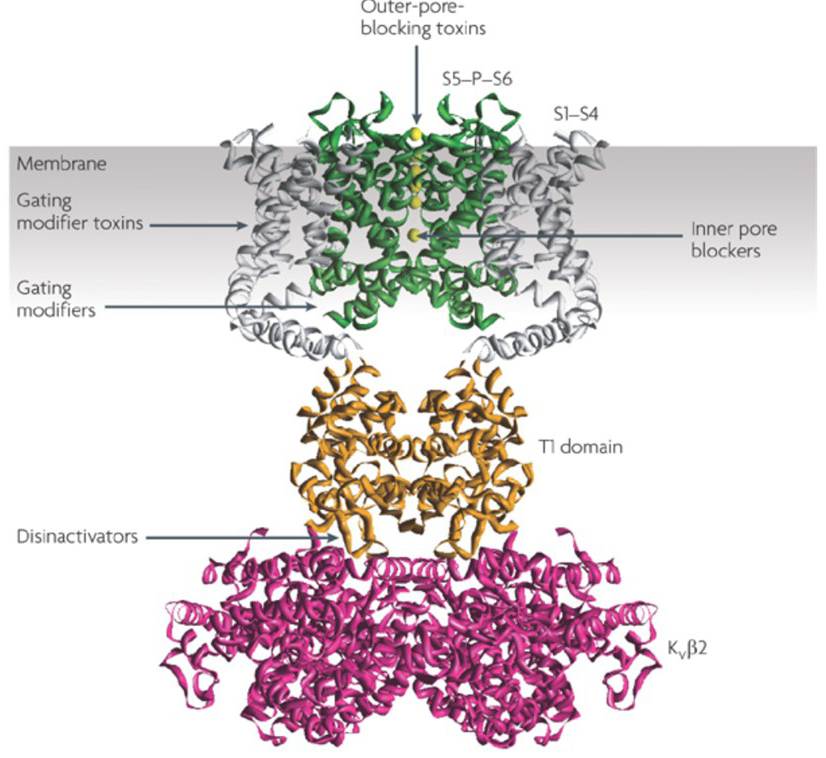
Abbildung 6. Beispiele für Wirkungsweisen von KV-Kanalmodulatoren. Es gibt verschiedene Möglichkeiten für Peptidtoxine und kleine Moleküle, die KV-Kanalaktivität zu modulieren. Die KV1.2-Struktur ist mit den Porendomänen (S5-P-S6) in Grün, den Spannungssensordomänen (S1-S4) in Grau, den T1-Tetramerisationsdomänen in Orange und den KVß2-Hilfsuntereinheiten in Magenta dargestellt. Außenporenblockierende Toxine von Skorpionen, Seeanemonen, Schlangen und Kegelschnecken können sich an das äußere Vestibül binden und die Ionenpermeation blockieren. Gating-Modifikator Toxine aus Spinnen wie Hanatoxin können mit dem Spannungssensor interagieren, um die Stabilität des geschlossenen Zustands zu erhöhen, was zu einer Verschiebung der Spannungsabhängigkeitskurve nach rechts für die Kanalaktivierung führt. Es gibt auch niedermolekulare Kanalmodulatoren, die an die innere Pore binden (innere Porenblocker), die Gating-Scharniere (Gating-Modifikatoren) oder die Grenzfläche zwischen den α- und β-Untereinheiten (Disinaktivatoren) .
Spannungsgesteuerte Kaliumkanalstruktur
Die bemerkenswerte Selektivität von Kaliumkanälen, die es K + -Ionen ermöglicht, die Kanalpore mit um Größenordnungen größerer Leichtigkeit als die kleineren Na + -Ionen und mit nahezu diffusionslimitierter Geschwindigkeit zu passieren, wird durch die Fähigkeit der Rückgratcarbonyle des Selektivitätsfilters erklärt, K + -Ionen zu koordinieren, die weitgehend von ihren Hydratationsschalen befreit sind , so dass sich mehr als ein K + -Ion durch dieses engste Segment der Pore im Tandem mit den kleineren Na + -Ionen (Abb. 7) – eine lange Pore für einzelne Datei K + Ionenpermeation als ausgesagt.
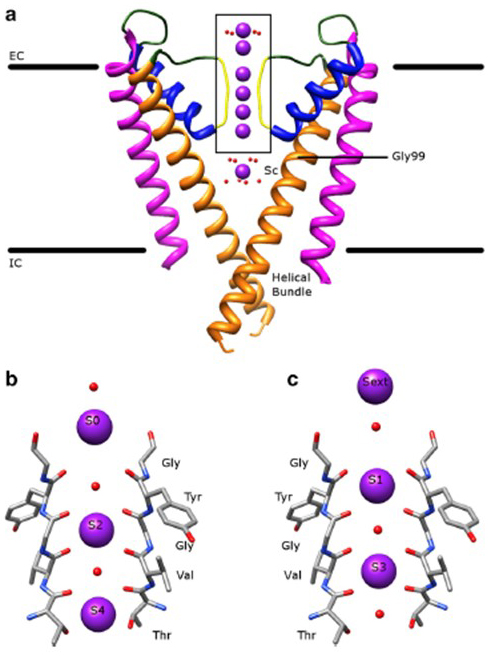
Abbildung 7. Die Porendomäne von Kaliumkanälen. (a) Struktur von KcsA im leitfähigen Zustand (PDB: 1K4C), mit den äußeren Helices in Magenta, inneren Helices in Orange, Porenhelices in Blau und dem Selektivitätsfilter in Gelb. K + -Ionen sind violett, während die umgebenden Wassermoleküle rot sind. EC: extrazellulär; IC: intrazellulär. (b, c) Der Selektivitätsfilter im Kastenbereich der KcsA-Struktur ist mit K + -Ionen dargestellt, die entweder die Positionen S2 und S4 (b) oder die Positionen S1 und S3 (c) einnehmen, um die K + -Ionenpermeation in einer einzigen Datei zu veranschaulichen.
Die Spannungsabhängigkeit der KV-Kanalaktivierung ergibt sich aus ihren Spannungssensordomänen . Wie in Fig. 8 haben KV-Kanäle und verwandte Kanäle wie spannungsgesteuerte Natriumkanäle und TRPV1-Kanäle in derselben Superfamilie ähnliche Anordnungen ihrer Porendomänen und Spannungssensordomänen. Die Spannungssensordomäne einer Untereinheit interagiert mit der Porendomäne einer benachbarten Untereinheit in einer Domänentauschkonfiguration, und innerhalb eines Spannungssensors können die positiv geladenen Argininreste auf S4 mit negativ geladenen sauren Resten in benachbarten Helices interagieren (Fig. 9).
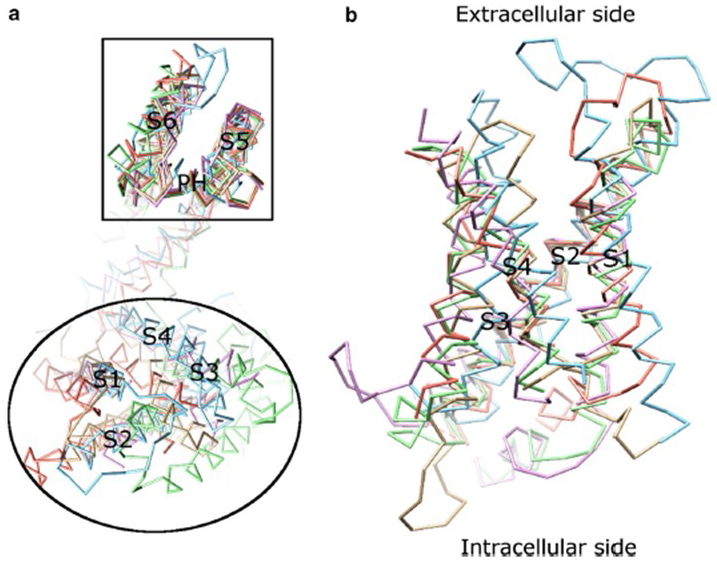
Abbildung 8. Der Spannungssensor besteht aus spannungsgesteuerten Kaliumkanälen. (a) Die Ausrichtung der Porendomäne (S5-P-S6) verschiedener Ionenkanäle zeigt, dass ihre Spannungssensordomänen (S1-S4) eine Vielzahl von Orientierungen annehmen können (von der extrazellulären Seite aus gesehen). (b) Überlagerung der Spannungssensordomäne von KV1.2 (PDB: 3LUT, hell magenta) mit den Spannungssensordomänen von MlotiK1 (PDB: 3BEH, hellbraun), NaVAb (PDB: 3RVY, hellgrün), NaVRh (PDB: 4DXW, hellorange) und TRPV1 (PDB: 3J5P, hellblau) (von der Membran aus gesehen).
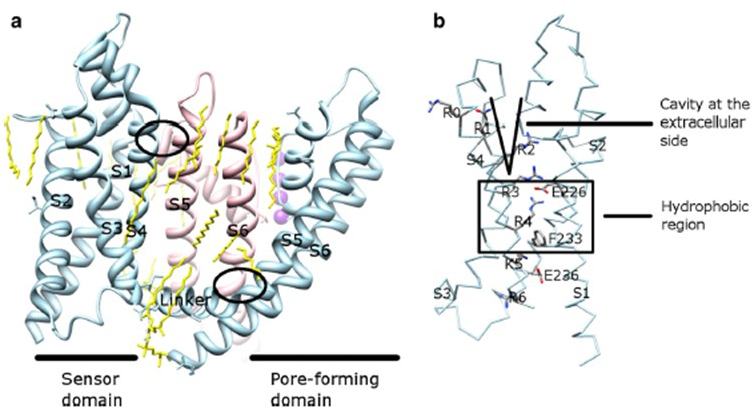
Abbildung 9. Kontakte zwischen der Porendomäne und der Spannungssensordomäne von KV-Kanälen. (a) Die KV1.2-KV2.1-Chimäre (PDB: 2R9R) mit der Spannungssensordomäne einer Untereinheit (hellblau), die die Porendomäne einer benachbarten Untereinheit (pink) kontaktiert. Die Kontakte auf der intrazellulären Seite beinhalten die Wechselwirkung des S4-S5-Linkers mit S6, und die Kontakte auf der extrazellulären Seite beinhalten die Wechselwirkung zwischen S1 und der Porenhelix . Lipide (gelb), die den Kanal umgeben und zwischen der Porendomäne und der Spannungssensordomäne liegen, sind in der Kristallstruktur nachweisbar. (b) Basische Reste von S4 und saure Reste in ihrer Nähe im Bereich des Spannungssensors .
Kanalopathien im Zusammenhang mit spannungsgesteuerten Kaliumkanälen
Spannungsgesteuerte Kaliumkanäle werden in einer Vielzahl von Geweben breit exprimiert. In Neuronen zielen sie auf verschiedene subzelluläre Kompartimente ab (Abb. 10), und Kanäle unterschiedlicher Untereinheitszusammensetzungen können in verschiedenen Subpopulationen von Neuronen vorhanden sein. Mutationen von KV-Kanalgenen können neurologische Erkrankungen wie episodische Ataxie und Epilepsien, Herzerkrankungen und Taubheit verursachen . Die evolutionäre Erhaltung der KV1-Funktion zeigt sich beispielsweise an ähnlichen Bewegungsstörungen, die durch Mutation von KV1-Orthologen bei Mensch, Maus und Fruchtfliege verursacht werden .
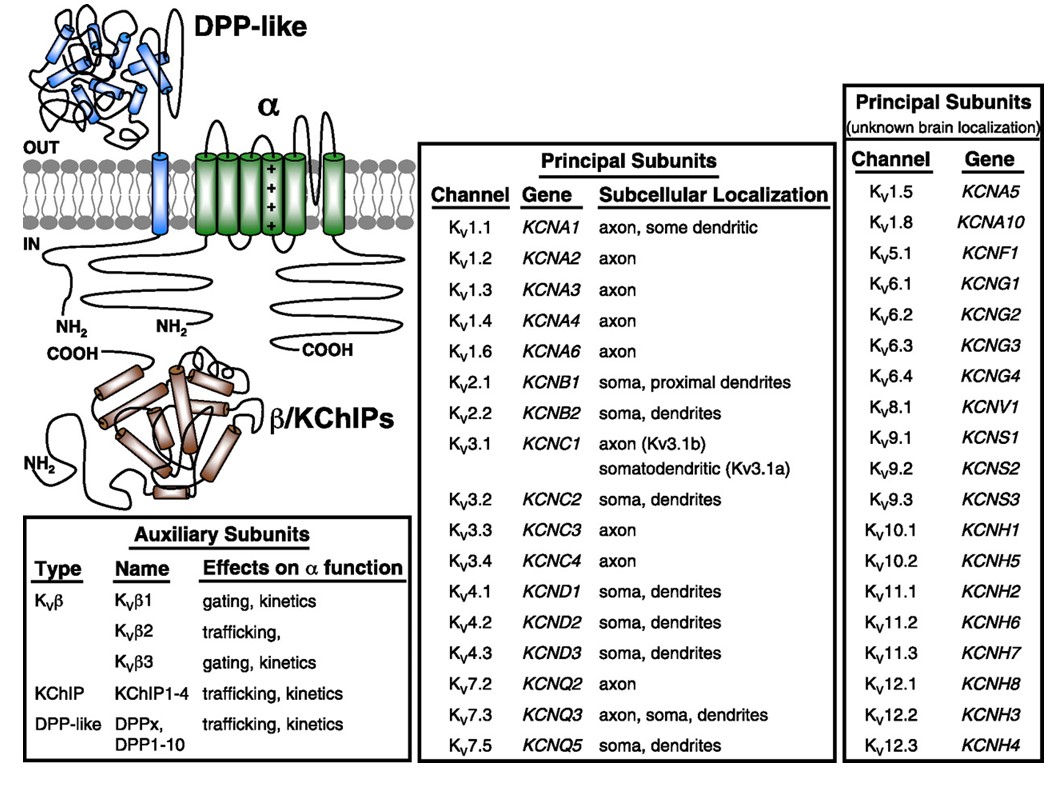
Abbildung 10. Subzelluläre Verteilung von spannungsgesteuerten Kaliumkanälen. Das Schema oben links zeigt einen KV4-Kanal mit zwei verschiedenen Hilfseinheiten. Die subzelluläre Lokalisation verschiedener KV-Kanäle in zentralen Neuronen von Säugetieren ist im mittleren Feld angegeben .
Referenzen und Anmerkungen
1.Hille, B., Ionenkanäle erregbarer Membranen, 3., Ed. 2001: Sinauer Associates Inc.
2.In: Gonzalez, C., et al., K(+) Kanäle: Funktions-Strukturübersicht. Compr Physiol, 2012. 2(3): S. 2087-149.
3.Vacher, H., D.P. Mohapatra und J.S. Identifizierung, Lokalisierung und Targeting spannungsabhängiger Ionenkanäle in zentralen Neuronen von Säugetieren. Physiol Rev, 2008. 88(4): S. 1407-47.
4.Schreiber, J., et al., Evolution des menschlichen Ionenkanalsatzes. Comb Chem Hochdurchsatzsieb, 2009. 12(1): S. 2-23.
5.Cang, C., et al., TMEM175 ist ein Organelle K(+) Kanal, der lysosomale Funktion reguliert. Zelle, 2015. 162(5): S. 1101-12.
6.Hodgkin, A.L. und A. F. Huxley, Ströme, die von Natrium- und Kaliumionen durch die Membran des Riesenaxons von Loligo getragen werden. J Physiol, 1952. 116(4): S. 449-72.
7.Rosenthal, J.J., T.I. Liu und W.F. Gilly, Eine Familie von verzögerten KV1-cDNAs, die eine zelltypspezifische Expression im Squid-Sternganglion / Riesenfaserlappenkomplex zeigen. J Neurosci, 1997. 17(13): S. 5070-9.
8.Young, J.Z. Fusionierte Neuronen und synaptische Kontakte in den riesigen Nervenfasern von Kopffüßern. Phil Trans R Soc Lond B, 1939. 229: S. 465-503.
9.Rosenthal, J.J. und F. Bezanilla, Umfangreiche Bearbeitung von mRNAs für den Squid-verzögerten Gleichrichter K + Kanal reguliert die Tetramerisierung von Untereinheiten. Neuron, 2002. 34(5): S. 743-57.
10.Jan, L.Y. und Y.N. Jan, spannungsgesteuerte Kaliumkanäle und die Vielfalt der elektrischen Signalisierung. J Physiol, 2012. 590(11): S. 2591-9.
11.Johnston, J., I.D. Forsythe und C. Kopp-Scheinpflug, Going native: Spannungsgesteuerte Kaliumkanäle, die die neuronale Erregbarkeit steuern. J Physiol, 2010. 588(Pt 17): S. 3187-200.
12.Bocksteins, E., KV5-, KV6-, KV8- und KV9-Untereinheiten: Keine einfachen stillen Zuschauer. In: J Gen Physiol, 2016. 147(2): S. 105-25.
13.Wulff, H., N.A. Castle und L.A. Pardo, Spannungsgesteuerte Kaliumkanäle als therapeutische Ziele. Nat Rev. Discov, 2009. 8(12): S. 982-1001.
14.Bates, E. Ionenkanäle in der Entwicklung und Krebs. Annu Rev Cell Dev Biol, 2015. 31: S. 231-47.
15.Huang, X. und L.Y. Jan, Targeting Kaliumkanäle bei Krebs. J Cell Biol, 2014. 206(2): S. 151-62.
16.Huang, X., et al., EAG2 Kaliumkanal mit evolutionär konservierter Funktion als Hirntumorziel. Nat Neurosci, 2015. 18(9): S. 1236-46.
17.Kunzelmann, K., Ionenkanäle und Krebs. In: J Membr Biol, 2005. 205(3): S. 159-73.
18.Li , M. und ZG Xiong, Ionenkanäle als Ziele für die Krebstherapie. Int J Physiol Pathophysiol Pharmacol, 2011. 3(2): S. 156-66.
19.In: Pardo, L.A., Spannungsgesteuerte Kaliumkanäle in der Zellproliferation. Physiologie (Bethesda), 2004. 19: S. 285-92.
20.Urrego, D., et al., Kaliumkanäle im Zellzyklus und in der Zellproliferation. Philos Trans R Soc Lond B Biol Sci, 2014. 369(1638): S. 20130094.
21.Zhou, Y., et al., Chemie der Ionenkoordination und Hydratation durch einen K + -Kanal-Fab-Komplex bei 2,0 A Auflösung. Natur, 2001. 414(6859): S. 43-8.
22.MacKinnon, R., Kaliumkanäle. FEBS Lett, 2003. 555(1): S. 62-5.
23.Kuang, Q., P. Purhonen und H. Hebert, Struktur von Kaliumkanälen. Zelle Mol Life Sci, 2015. 72(19): S. 3677-93.
24.Isacoff, E.Y., L.Y. Jan und D.L. Minor, Jr., Leitungen des Lebensfunkens: eine Perspektive auf die Ionenkanalforschung seit der Geburt des Neurons. Neuron, 2013. 80(3): S. 658-74.
25.Swartz, KJ Sensing Spannung über Lipidmembranen. Natur, 2008. 456(7224): S. 891-7.
26.Nusser, Z., Differentielle subzelluläre Verteilung von Ionenkanälen und die Vielfalt der neuronalen Funktion. Curr Opin Neurobiol, 2012. 22(3): S. 366-71.
27.Lujan, R., Organisation von Kaliumkanälen auf der neuronalen Oberfläche. In: J Chem Neuroanat, 2010. 40(1): S. 1-20.
28.Abriel, H. und E.V. Zaklyazminskaya, Kardiale Kanalopathien: genetische und molekulare Mechanismen. Gen, 2013. 517(1): S. 1-11.
29.Kullmann, D.M. und M.G. Hanna, Neurologische Störungen durch vererbte Ionenkanalmutationen. Lancet Neurol, 2002. 1(3): S. 157-66.
30.Lehmann-Horn, F. und K. Jurkat-Rott, Spannungsgesteuerte Ionenkanäle und Erbkrankheiten. Physiol Rev, 1999. 79(4): S. 1317-72.
31.Villa, C. und R. Combi, Kaliumkanäle und menschliche epileptische Phänotypen: Ein aktualisierter Überblick. Front Cell Neurosci, 2016. 10: S. 81.
32.Lange, S.B., E.B. Campbell, und R. Mackinnon, Kristallstruktur eines säugetierspannungsabhängigen K + -Kanals der Schüttlerfamilie. Wissenschaft, 2005. 309(5736): S. 897-903.
33.Chen, X., et al., Struktur des Kaliumkanals KV1.2 in voller Länge durch normalmodenbasierte röntgenkristallographische Verfeinerung. In: Proc Natl Acad Sci U S A, 2010. 107(25): S. 11352-7.
34.In: Clayton, G.M., et al., Struktur der Transmembranregionen eines bakteriellen zyklischen Nukleotid-regulierten Kanals. In: Proc Natl Acad Sci U S A, 2008. 105(5): S. 1511-5.
35.In: Payandeh, J., et al., Die Kristallstruktur eines spannungsgesteuerten Natriumkanals. Natur, 2011. 475(7356): S. 353-8.
36.Zhang, X., et al., Kristallstruktur eines Orthologen des NaChBac-spannungsgesteuerten Natriumkanals. Natur, 2012. 486(7401): S. 130-4.
37.Liao, M., et al., Struktur des TRPV1-Ionenkanals bestimmt durch Elektronenkryo-Mikroskopie. Natur, 2013. 504(7478): S. 107-12.
38.Lange, S.B., et al., Atomare Struktur eines spannungsabhängigen K + -Kanals in einer lipidmembranartigen Umgebung. Natur, 2007. 450(7168): S. 376-82.