Es ist nicht offensichtlich. Valenzelektronen sind diejenigen, die für die chemische Bindung wichtig sind. Bei Übergangsmetallen variiert das Wort „wichtig“ je nach Kontext.
Es ist einfacher und praktischer zu beschreiben, welche Orbitale Valenzorbitale sind, wenn es um Übergangsmetalle geht (obwohl es bei Lanthaniden und Aktiniden schwierig wird).
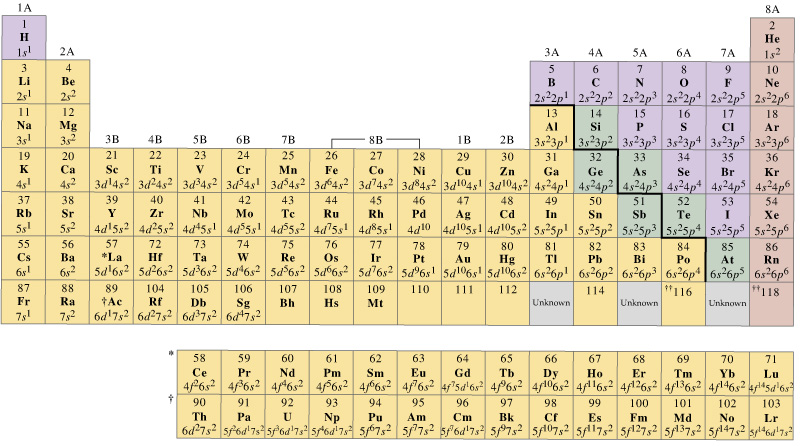
Im Allgemeinen haben die Übergangsmetalle der ersten Reihe eine Reihe von Valenzorbitalen, die ihre # 4s # und # 3d # enthalten, aber die Anzahl der Valenzelektronen variiert.
Zum Beispiel…

- Scandium ist sinnvoll, bis zu drei Valenzelektronen zu haben, da eine Oxidationsstufe #“Sc“ ^ (+3) # vorliegt (z. B. #“ScCl“_3 #), aber nicht #“Sc“ ^ (+4) # oder höher. Eine Oxidationsstufe #+3 # hätte die Übertragung von drei Valenzelektronen erforderlich gemacht, wenn sie ein reines Kation bilden würde.
- Chrom könnte bis zu sechs Valenzelektronen haben, was seine #3d # Elektronen einschließen würde, da es eine Oxidationsstufe #+ 6 # erreichen kann (dh in #“Cr“ _2″O“_7 ^ (2-) # oder in #“CrO“_4^(2-)#).
- Kupfer hat tendenziell eine Oxidationsstufe #+ 1 # (z. B. #“CuCl“ #), daher ist es sinnvoll, dass es sein ein # 4s # -Elektron am häufigsten als Valenzelektron (e) verwendet. Es ist aber auch eine Oxidationsstufe #+2 # bekannt (z. B. #“CuCl“ _2 #), und so ist es in der Lage, von seinen #bb (3d) # Elektronen auch für seine Valenzelektronen zu nehmen.
Andererseits könnten wir leicht sagen, dass die Valenzorbitale der Übergangsmetalle der ersten Reihe die Orbitale #4s # und #3d # sind.
Im Allgemeinen würde ich also sagen, dass die Anzahl der Valenzelektronen für Übergangsmetalle (und Lanthanide und Aktinide) auf unvorhersehbare Weise variiert, aber die Valenzorbitale könnten manchmal mit genügend chemischer Intuition vorhergesagt werden.
DISCLAIMER: Es ist jedoch im Allgemeinen schwierig für die Lanthaniden und Aktiniden vorherzusagen, welche Orbitale valent sind.
Zum Beispiel haben die Aktiniden #5f # und # 6d # Orbitale, die sehr nahe an ihrem #7s # Orbital liegen, so dass wir die #7s #, # 6d # UND # 5f # im Valenzraum (auch wenn die # 6d # Orbitale leer sind) bei der Durchführung von Atomenergieberechnungen erraten und einschließen können.