Patrones de unión comunes en estructuras orgánicas
Los métodos revisados anteriormente para dibujar estructuras de Lewis y determinar cargas formales en átomos son un punto de partida esencial para un químico orgánico novato, y funcionan muy bien cuando se trata de estructuras pequeñas y simples. Pero como puede imaginar, estos métodos se vuelven irrazonablemente tediosos y consumen mucho tiempo cuando comienza a tratar con estructuras más grandes. Sería poco realista, por ejemplo, pedirle que dibuje la estructura de Lewis a continuación (de uno de los cuatro bloques de construcción de nucleósidos que componen el ADN) y determine todas las cargas formales sumando, átomo por átomo, los electrones de valencia.
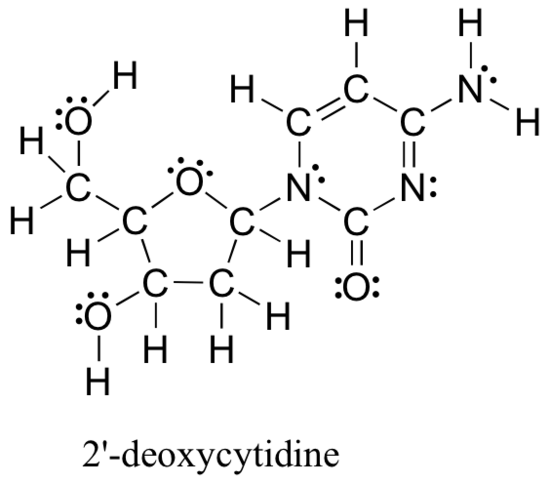
Y, sin embargo, como químicos orgánicos, y especialmente como químicos orgánicos que se ocupan de moléculas biológicas, se espera que pronto dibuje la estructura de moléculas grandes como esta de forma regular. Claramente, necesita desarrollar la capacidad de dibujar estructuras grandes de manera rápida y eficiente y determinar cargos formales. Afortunadamente, esta habilidad no es terriblemente difícil de conseguir, todo lo que se necesita son algunos atajos y algo de práctica para reconocer patrones de unión comunes.
Comencemos con el carbono, el elemento más importante para los químicos orgánicos. Se dice que el carbono es tetravalente, lo que significa que tiende a formar cuatro enlaces. Si nos fijamos en las estructuras simples de metano, metanol, etano, eteno y etino en las figuras de la sección anterior, deberíamos reconocer rápidamente que en cada molécula, el átomo de carbono tiene cuatro enlaces y una carga formal de cero.
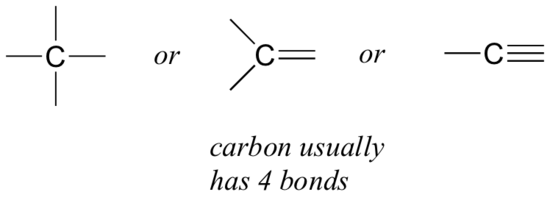
Este es un patrón que se mantiene en la mayoría de las moléculas orgánicas que veremos, pero también hay excepciones.
En el dióxido de carbono, el átomo de carbono tiene enlaces dobles con el oxígeno en ambos lados (O=C=O). Más adelante, en este capítulo y a lo largo de este libro, veremos ejemplos de iones orgánicos llamados ‘carbocaciones’ y carbaniones’, en los que un átomo de carbono tiene una carga formal positiva o negativa, respectivamente. Si un carbono tiene solo tres enlaces y una cáscara de valencia sin llenar (en otras palabras, si no cumple con la regla del octeto), tendrá una carga formal positiva.
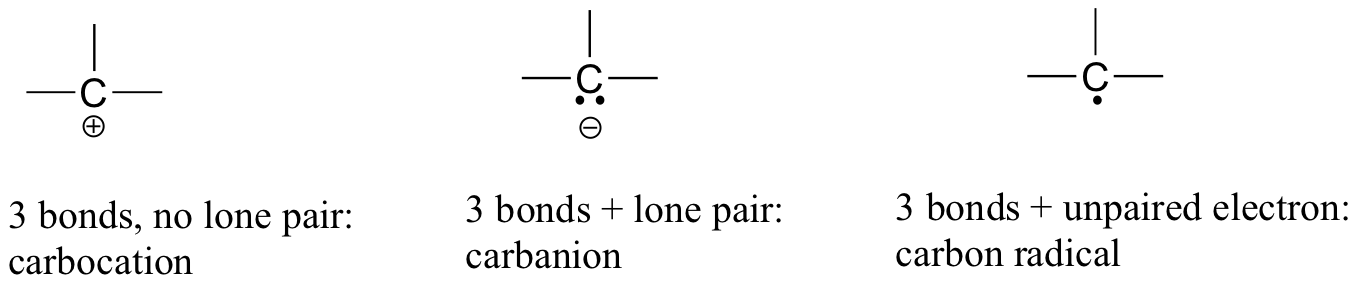
Si, por otro lado, tiene tres enlaces más un par solitario de electrones, tendrá una carga formal de -1. Otra posibilidad es un carbono con tres enlaces y un solo electrón no emparejado (radical libre): en este caso, el carbono tiene una carga formal de cero. (Una última posibilidad es una especie altamente reactiva llamada ‘carbeno’, en la que un carbono tiene dos enlaces y un par solitario de electrones, dándole una carga formal de cero. Puede encontrar carbenos en cursos de química más avanzados, pero no se discutirán más en este libro).
Sin duda, debe utilizar los métodos que ha aprendido para comprobar que estos cargos formales son correctos para los ejemplos mencionados anteriormente. Más importante aún, antes de progresar mucho más en su estudio de la química orgánica, necesitará simplemente reconocer estos patrones (y los patrones descritos a continuación para otros átomos) y ser capaz de identificar carbonos que soportan cargas formales positivas y negativas mediante una inspección rápida.
El patrón para los hidrógenos es fácil: los átomos de hidrógeno tienen un solo enlace y no tienen carga formal. Las excepciones a esta regla son el protón, H+, y el ion hidruro, H-, que es un protón más dos electrones. Debido a que nos estamos concentrando en este libro en la química orgánica aplicada a los seres vivos, sin embargo, no veremos protones e hidruros ‘desnudos’ como tales, porque son demasiado reactivos para estar presentes en esa forma en solución acuosa. Sin embargo, la idea de un protón será muy importante cuando discutamos la química ácido-base, y la idea de un ion hidruro se volverá muy importante mucho más adelante en el libro cuando discutamos las reacciones de oxidación y reducción orgánicas. Como regla general, sin embargo, todos los átomos de hidrógeno en moléculas orgánicas tienen un enlace, y no tienen carga formal.
Pasemos ahora a los átomos de oxígeno. Por lo general, verá una unión de oxígeno de tres maneras, todas las cuales cumplen con la regla del octeto.
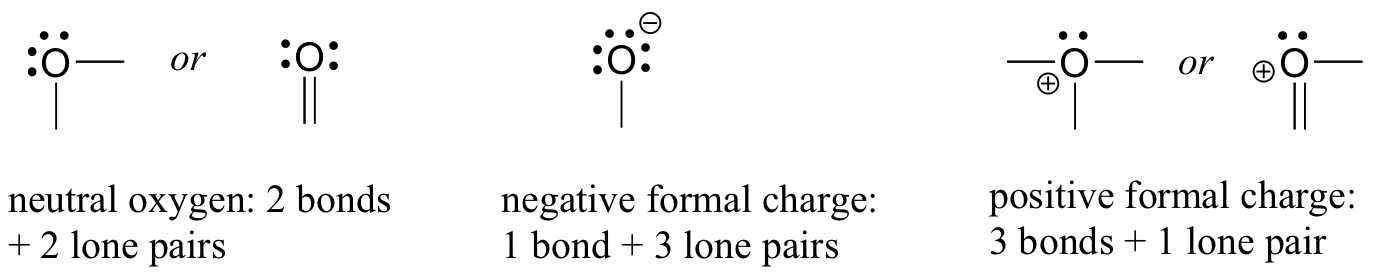
Si tiene dos enlaces y dos pares solitarios, como en el agua, tendrá una carga formal de cero. Si tiene un enlace y tres pares solitarios, como en el ion hidróxido, tendrá una carga formal de-1. Si tiene tres enlaces y un par solitario, como en el ion hidronio, tendrá una carga formal de +1.
Cuando lleguemos a nuestra discusión de la química de los radicales libres en el capítulo 17, veremos otras posibilidades, como donde un átomo de oxígeno tiene un enlace, un par solitario y un electrón no emparejado (de radicales libres), dándole una carga formal de cero. Por ahora, sin embargo, concéntrese en los tres ejemplos principales no radicales, ya que estos explicarán prácticamente todo lo que vemos hasta el capítulo 17.
El nitrógeno tiene dos patrones de unión principales, los cuales cumplen con la regla del octeto:
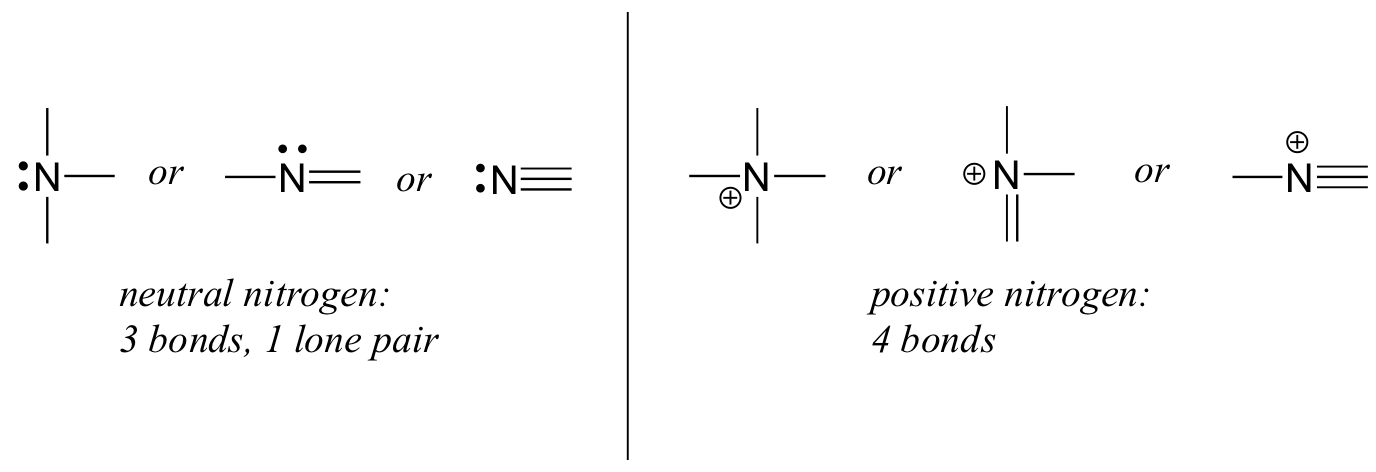
Si un nitrógeno tiene tres enlaces y un par solitario, tiene una carga formal de cero. Si tiene cuatro bonos (y no un par solitario), tiene una carga formal de +1. En un patrón de unión bastante poco común, el nitrógeno cargado negativamente tiene dos enlaces y dos pares solitarios.
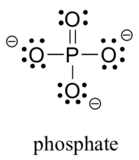
Los elementos de dos terceras filas se encuentran comúnmente en moléculas orgánicas biológicas: azufre y fósforo. Aunque ambos elementos tienen otros patrones de enlace que son relevantes en la química de laboratorio, en un contexto biológico, el azufre casi siempre sigue el mismo patrón de enlace / carga formal que el oxígeno, mientras que el fósforo está presente en forma de ion fosfato (PO43 -), donde tiene cinco enlaces (casi siempre al oxígeno), sin pares solitarios y una carga formal de cero. Recuerde que los elementos de la tercera fila de la tabla periódica tienen orbitales d en su envoltura de valencia, así como orbitales s y p, y por lo tanto no están vinculados por la regla de octetos.
Finalmente, los halógenos (flúor, cloro, bromo y yodo) son muy importantes en la química orgánica medicinal y de laboratorio, pero menos comunes en moléculas orgánicas de origen natural. Los halógenos en los compuestos orgánicos generalmente se ven con un enlace, tres pares solitarios y una carga formal de cero. A veces, especialmente en el caso del bromo, encontraremos especies reactivas en las que el halógeno tiene dos enlaces (generalmente en un anillo de tres miembros), dos pares solitarios y una carga formal de +1.

Estas reglas, si se aprenden e internalizan para que ni siquiera tenga que pensar en ellas, le permitirán dibujar estructuras orgánicas grandes, completas con cargos formales, con bastante rapidez.
Una vez que haya aprendido a dibujar estructuras de Lewis, no siempre es necesario dibujar pares solitarios en heteroátomos, ya que puede suponer que el número adecuado de electrones está presente alrededor de cada átomo para que coincida con la carga formal indicada (o la falta de ella). De vez en cuando, sin embargo, las parejas solitarias se dibujan si hacerlo ayuda a hacer una explicación más clara.