- Introducción
- Conservación evolutiva de canales de potasio
- Diversidad de canales de potasio dependientes de voltaje
- Posibles aplicaciones terapéuticas de los moduladores de canales de potasio
- Estructura de canal de potasio dependiente de voltaje
- Las canalopatías vinculadas a canales de potasio dependientes de voltaje
- Referencias y notas
Introducción
Los canales de potasio controlados por voltaje forman una familia grande y diversa que se conserva evolutivamente. Hay 40 genes de canales de potasio dependientes del voltaje humano que pertenecen a 12 subfamilias. Estos canales KV muestran distribuciones amplias en el sistema nervioso y otros tejidos. Para las células excitables, como las neuronas, los cardiomiocitos y los músculos, los canales KV regulan la forma de onda y el patrón de disparo de los potenciales de acción. Los canales KV también pueden regular el volumen celular, la proliferación y la migración de una amplia gama de tipos de células.
Los canales de potasio dependientes de voltaje (KV) pertenecen a una de las familias de canales iónicos más grandes y altamente conservadas evolutivamente . Cada canal KV contiene cuatro subunidades α formadoras de poros similares o idénticas, y también puede contener subunidades β auxiliares que podrían afectar la función y/o localización del canal . Cada subunidad formadora de poros de los canales KV contiene seis segmentos de transmembrana (S1-S6), con los primeros cuatro segmentos de transmembrana (S1-S4) constituyendo el sensor de voltaje y los últimos dos segmentos de transmembrana flanqueando un bucle de poros (S5-P-S6) como el dominio de poros. Además de la ubicación cromosómica de cada gen del canal KV en humanos, ratones y ratas, la Base de Datos de Canales Iónicos del Subcomité de canales de potasio controlados por Voltaje del Comité de Nomenclatura de la Unión Internacional de Farmacología (NC-IUPHAR) ha proporcionado las propiedades fisiológicas y farmacológicas del canal, su distribución tisular y su fisiopatología. Este artículo presenta una introducción a la diversidad y funciones de los canales de potasio dependientes de voltaje.
Conservación evolutiva de canales de potasio
La selectividad K+que surgió en procariotas se conserva en un gran número de canales de potasio con notable diversidad . Como se muestra en la Figura 1, se puede proponer un árbol evolutivo de la superfamilia de canales catiónicos dependientes de voltaje basado en la comparación de genes de canales en el genoma humano con los de los genomas de otros metazoos, incluidos el ratón, el pollo, el pez globo, el tunicado, la mosca de la fruta, el mosquito, el nematodo y la anémona de mar . Este árbol evolutivo prevé un único origen de la selectividad K+para los canales de potasio rectificador interno (Kir), los canales de potasio dependientes de voltaje (KV) y los canales de potasio de dos poros (K2P). Es importante tener en cuenta, sin embargo, que una selectividad distinta de K+está probablemente asociada con el canal de orgánulos K+ conservados evolutivamente que reside en los endosomas y lisosomas .
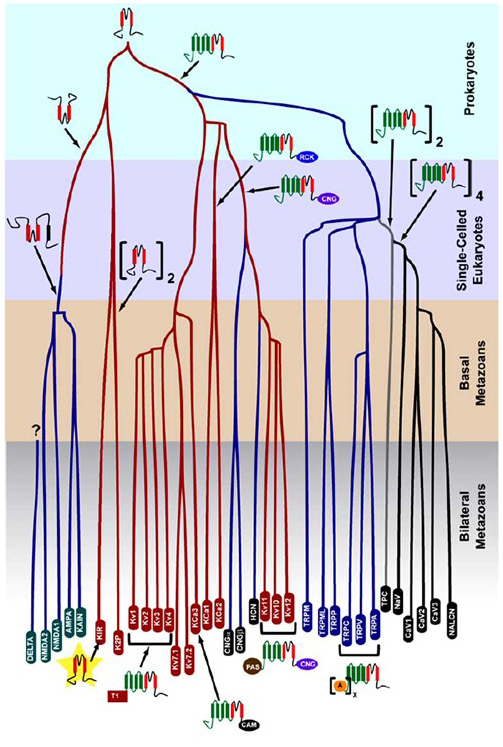
Figura 1. Un árbol evolutivo para la génesis de la superfamilia de canales catiónicos controlados por voltaje. Basado en análisis de todo el genoma de canales iónicos de cnidarios y metazoos bilaterales , este árbol evolutivo representa un origen común para la selectividad K+de los canales de potasio (con nombres de familia en óvalos rojos), que están relacionados con los canales catiónicos controlados por nucleótidos cíclicos tetrámeros (CNG), los canales catiónicos controlados por hiperpolarización (HCN) y los canales TRP, los canales diméricos TPC y los canales monoméricos Na+, Ca2+ y NALCN. Las longitudes de rama no reflejan el tiempo. Los apellidos genéticos en la parte inferior marcan ramas individuales. Los receptores ionotrópicos de glutamato se incluyen en base a la hipótesis de que se originaron a partir de una inversión del dominio formador de poros del canal de potasio con dos segmentos transmembranarios (rojo). El dominio sensor de voltaje tiene cuatro segmentos transmembrana (verde). A: repeticiones de ankryina; CAM: dominio de unión a calmodulina; CNG: dominio de unión a nucleótidos cíclicos; PAS: dominio Per-ARNT-Sim; RCK: regulador de conductancia del dominio K+; T1: dominio de tetramerización.
Diversidad de canales de potasio dependientes de voltaje
El genoma humano contiene ~80 genes de canales de potasio, de los cuales 40 genes codifican subunidades formadoras de poros de canales de potasio dependientes de voltaje que caen en 12 subfamilias (Fig. 2). Fisiológicamente subdivididos en canales de potasio de tipo A que muestran una inactivación rápida y canales de potasio rectificadores retardados sin inactivación rápida, estos canales KV son moleculares y funcionalmente diversos. La inactivación rápida, que puede afectar a la duración del potencial de acción durante la cocción repetitiva, es evidente en los canales KV1 que contienen KV1.4 o canales KVß1, KV3 y canales KV4 . La corriente de potasio rectificadora retardada originalmente caracterizada por Hodgkin y Huxley por su papel en el potencial de acción probablemente corresponde a los canales KV1 de calamar que pueden depender de la edición de ARN para lograr la diversidad funcional flexible, ya que muchos axones pequeños de las neuronas del lóbulo de fibra gigante se fusionan para formar el axón gigante de calamar con mayor velocidad de conducción de potencial de acción .
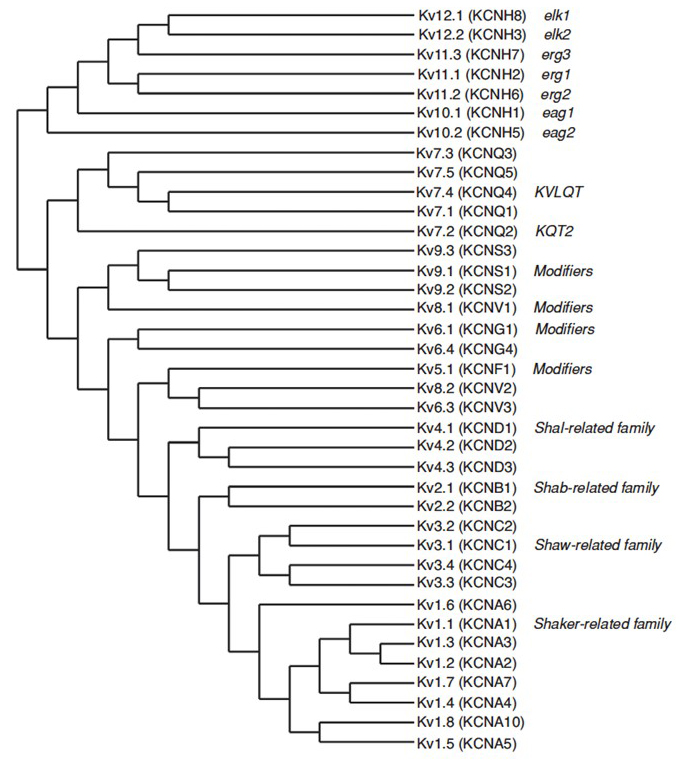
Figura 2. Árbol filogenético para las familias KV1-12. Este árbol filogenético se genera a partir de análisis del dominio hidrofóbico que contiene los seis segmentos de transmembrana (S1-S6) . Se muestran los nombres IUPHAR y HGNC (entre paréntesis), junto con otros nombres comúnmente utilizados para estos canales de potasio dependientes de voltaje.
Se puede lograr una notable diversidad de canales KV debido a la combinación de subunidades de canal KV. Dentro de cada una de las familias KV1, KV2, KV3, KV4 y KV7, se pueden formar canales homoméricos y heteroméricos con una gama de propiedades funcionales . Los miembros de la familia KV2 también pueden ensamblarse con miembros de la familia KV5, KV6, KV8 o KV9 con patrones de expresión más restringidos en el sistema nervioso y los músculos lisos , como se ilustra esquemáticamente en la Fig. 3.

Figura 3. Diversidad de canales de KV a través de la mezcla y combinación de subunidades de canal formadoras de poros. A) Los canales tetraméricos KV con diferentes propiedades y distribución abarcan los canales homoméricos KV1, KV2, KV3, KV4 y KV7, los canales heteroméricos formados por diferentes miembros dentro de cada una de estas familias de canales KV, y los canales heteroméricos formados por el ensamblaje de miembros de la familia KV2 con miembros de la familia KV5, KV6, KV8 o KV9 . Las familias KV5, KV6, KV8 y KV9 dan lugar a canales homómeros que son eléctricamente silenciosos, probablemente debido a su retención en el retículo endoplásmico , por lo que se les conoce como KVS. (B)El ensamblaje de los miembros de la familia KV2 y KVS involucra sus dominios citoplasmáticos terminales N y C. (C, D) El ensamblaje de los miembros de la familia KV2 y KVS da lugar a canales heteroméricos con diferente dependencia de voltaje (C) y mecanismos de compuerta (D) en comparación con los canales homoméricos formados por miembros de la familia KV2 .
Las diferencias funcionales en la dependencia de voltaje y la cinética de los canales KV subyacen a sus contribuciones diferenciales a la modulación del potencial de acción (Fig. 4). Mientras que los canales KV1, KV4 y KV7 requieren niveles bajos de despolarización de membrana para su activación, los canales KV2 y KV3 se activan mediante una mayor despolarización. Los primeros canales de KV activados por baja tensión pueden afectar el umbral de generación de potencial de acción y el número de potenciales de acción generados durante la despolarización o potenciales sinápticos excitatorios. Por el contrario, los canales de KV activados de alto voltaje pueden modular la duración del potencial de acción y el patrón de disparo . La cinética de los canales KV también influye en las formas en que contribuyen a la generación de potencial de acción. Mientras que los canales KV1 activados de baja tensión con activación rápida pueden afectar el umbral de potencial de acción y la forma de onda, los canales KV3 y canales KV2 activados de alta tensión pueden activarse secuencialmente durante un potencial de acción debido a la diferencia en su cinética de activación, y los canales KV2 pueden tener efectos más duraderos debido a su cinética de inactivación lenta. Además, los canales KV4 con inactivación rápida podrían contribuir a la diferencia en la forma de onda del potencial de acción durante la cocción repetitiva, debido a la supresión de la actividad del canal KV4 por despolarización .
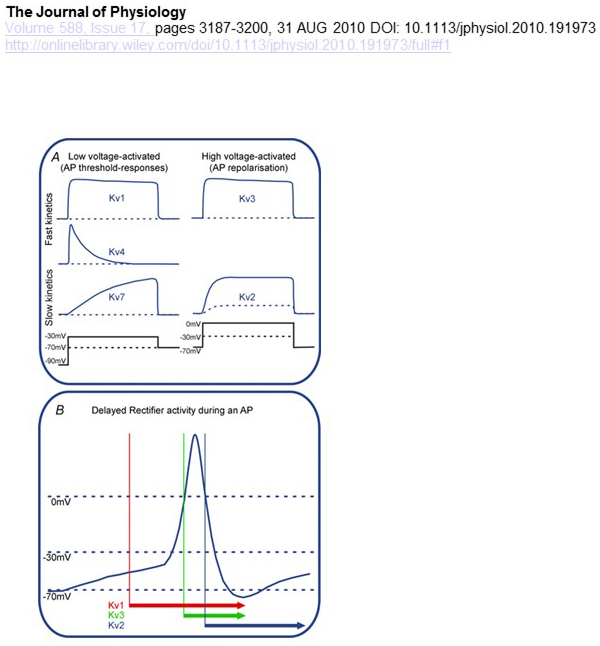
Figura 4. Diferencias funcionales de los canales KV y sus contribuciones al potencial de acción. (A) Los diferentes canales de KV tienen una dependencia de voltaje diferente para la activación y una cinética diferente . B) Los canales KV1 activados a baja tensión con cinética rápida abierta a medida que la célula se despolariza hacia el umbral de generación de potencial de acción. Mientras que los canales KV2 y KV3 están activados de alto voltaje, los canales KV3 se abren antes que los canales KV2 durante un potencial de acción. Los canales KV2 también pueden tardar más en cerrarse después de un potencial de acción .
Posibles aplicaciones terapéuticas de los moduladores de canales de potasio
La capacidad de los moduladores de canales de potasio para alterar los patrones de disparo del potencial de acción ha planteado la cuestión de si podrían tener valor terapéutico . Como se indica en la Fig. 5, diversos trastornos neurológicos y psicológicos pueden implicar alteraciones en los patrones de disparo del potencial de acción, que podrían ser modulados por activadores y bloqueadores del canal KV . Los canales de potasio controlados por voltaje también pueden desempeñar un papel en la proliferación y migración celular; Por lo tanto, se han considerado moduladores del canal KV para posibles tratamientos del crecimiento y metástasis del cáncer . En la Fig. 6, la estructura de canal KV1.2 se utiliza esquemáticamente para ilustrar que los moduladores de canal KV pueden inhibir la actividad del canal ocluyendo la vía de permeación del canal, como en el caso de las toxinas que bloquean los poros externos y los bloqueadores de los poros internos, o a través de su interacción con el sensor de voltaje para estabilizar el estado cerrado del canal, como en el caso de las toxinas modificadoras de la compuerta. Alternativamente, algunas moléculas pequeñas actúan uniéndose a la maquinaria de compuerta como modificadores de compuerta, o interactuando con la interfaz entre las subunidades α y β para alterar la actividad del canal .
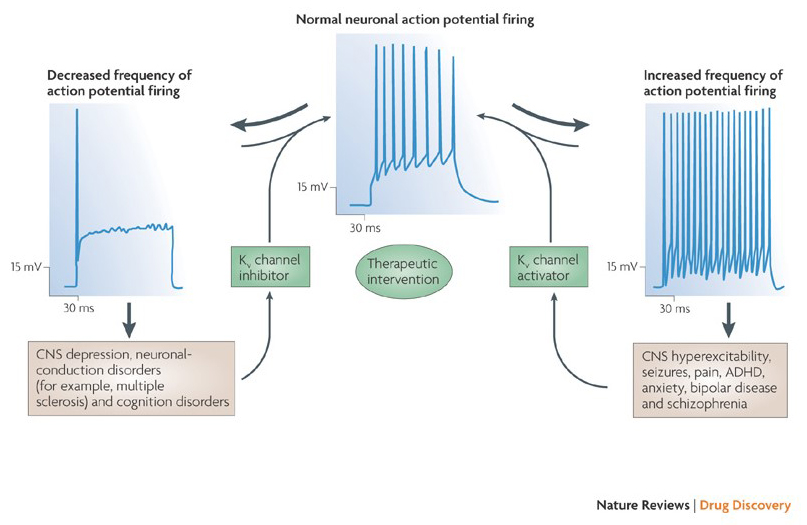
Figura 5. Aplicaciones potenciales de moduladores de canal KV. Debido a que los patrones de activación del potencial de acción anormal se han asociado con enfermedades como la epilepsia y la esclerosis múltiple, se han considerado activadores e inhibidores del canal KV para tratamientos terapéuticos potenciales de enfermedades que implican alteración de la excitabilidad neuronal .
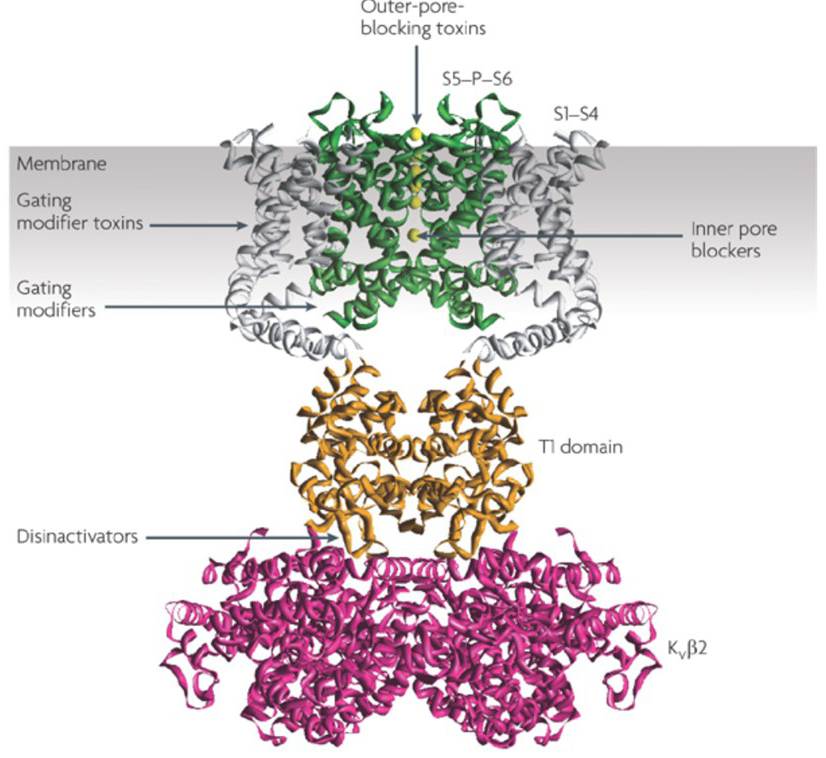
Figura 6. Ejemplos de modos de acción de moduladores de canal KV. Hay varias formas diferentes para que las toxinas peptídicas y las moléculas pequeñas modulen la actividad del canal KV. La estructura KV1. 2 se muestra con los dominios de poros (S5-P-S6) en verde, los dominios de sensores de voltaje (S1-S4) en gris, los dominios de tetramerización T1 en naranja y las subunidades auxiliares KVß2 en magenta . Las toxinas que bloquean los poros externos de escorpiones, anémonas de mar, serpientes y caracoles cónicos pueden unirse al vestíbulo exterior y bloquear la permeación de iones. Las toxinas modificadoras de compuerta de arañas como la hanatoxina pueden interactuar con el sensor de voltaje para aumentar la estabilidad del estado cerrado, causando un desplazamiento hacia la derecha de la curva de dependencia de voltaje para la activación del canal. También hay moduladores de canales de moléculas pequeñas que se unen al poro interno (bloqueadores de poro interno), las bisagras de compuerta (modificadores de compuerta) o la interfaz entre las subunidades α y β (desinactivadores) .
Estructura de canal de potasio dependiente de voltaje
La notable selectividad de los canales de potasio, que permite que los iones K+ pasen a través del poro del canal con órdenes de magnitud mayor facilidad que los iones Na+ más pequeños y con una velocidad casi limitada a la difusión , se explica por la capacidad de los carbonilos troncales del filtro de selectividad para coordinar iones K+ que están en gran parte despojados de sus capas de hidratación , de modo que más de un ion K+ se moverá a través de este segmento más estrecho del poro tándem (Fig. 7) – un poro largo para la permeación de iones K+ de una sola lima como predicado .
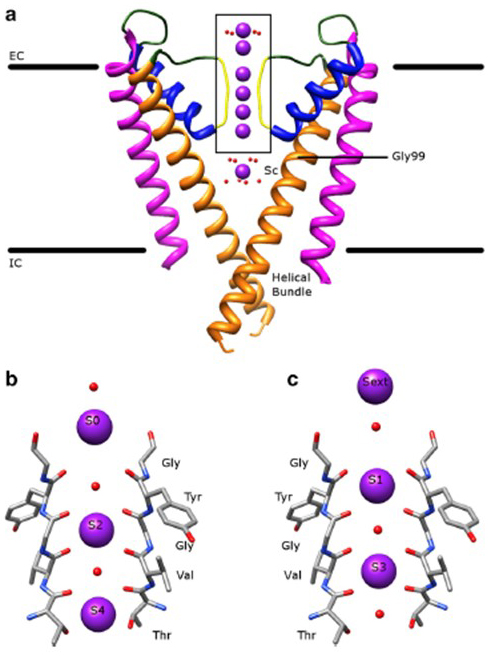
Figura 7. El dominio de poros de los canales de potasio. (a) Estructura de KcsA en el estado conductor (PDB: 1K4C), con las hélices externas en magenta, las hélices internas en naranja, las hélices de poros en azul y el filtro de selectividad en amarillo. Los iones K + están en púrpura, mientras que las moléculas de agua circundantes están en rojo. EC: extracelular; IC: intracelular. (b, c) El filtro de selectividad en la región encajonada de la estructura KcsA se muestra con iones K+ que ocupan las posiciones S2 y S4 (b) o las posiciones S1 y S3 (c), para ilustrar la permeación de iones K+ en una sola fila .
La dependencia de voltaje de la activación del canal KV deriva de sus dominios de sensores de voltaje . Como se muestra en la Fig. 8, Los canales KV y canales relacionados, como los canales de sodio dependientes de voltaje y los canales TRPV1 en la misma superfamilia, tienen arreglos similares de sus dominios de poros y dominios de sensores de voltaje. El dominio del sensor de voltaje de una subunidad interactúa con el dominio de poros de una subunidad vecina en una configuración de intercambio de dominio, y dentro de un sensor de voltaje, los residuos de arginina cargados positivamente en S4 pueden interactuar con residuos ácidos cargados negativamente en hélices vecinas (Fig. 9).
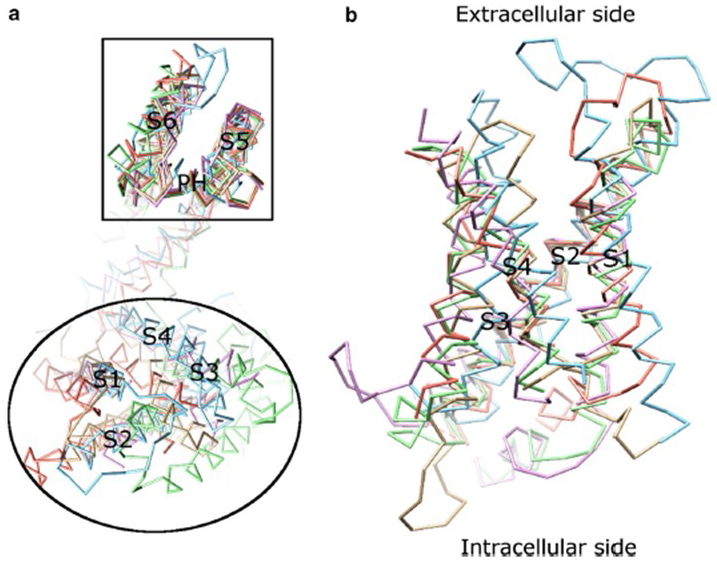
Figura 8. El dominio del sensor de voltaje de los canales de potasio dependientes de voltaje. (a) Alinear el dominio de poros (S5-P-S6) de diferentes canales iónicos revela que sus dominios de sensores de voltaje (S1-S4) pueden tomar una variedad de orientaciones (vistas desde el lado extracelular). b) Superposición del dominio del sensor de tensión de KV1.2 (PDB: 3LUT, magenta claro) con los dominios del sensor de tensión de MlotiK1 (PDB: 3BEH, marrón claro), NaVAb (PDB: 3RVY, verde claro), NaVRh (PDB: 4DXW, naranja claro) y TRPV1 (PDB: 3J5P, azul claro) (visto desde la membrana).
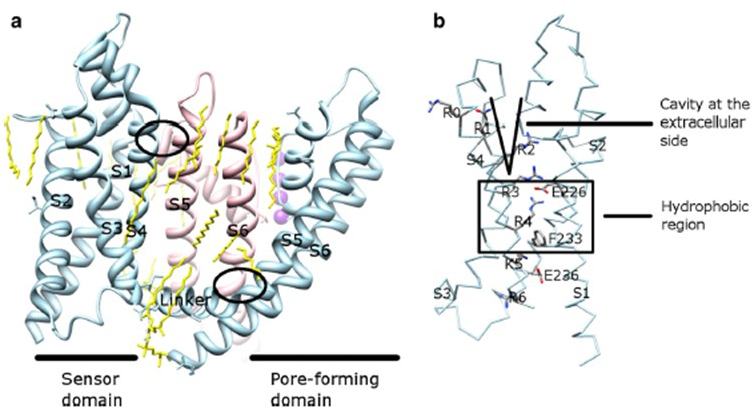
Figura 9. Contactos entre el dominio de poros y el dominio del sensor de tensión de los canales KV. a) La quimera KV1.2-KV2.1 (PDB: 2R9R) con el dominio del sensor de tensión de una subunidad (azul claro) en contacto con el dominio de poros de una subunidad vecina (rosa). Los contactos en el lado intracelular implican la interacción del enlazador S4-S5 con S6, y los contactos en el lado extracelular implican la interacción entre S1 y la hélice de poros . Los lípidos (amarillos) que rodean el canal y entre el dominio de poros y el dominio del sensor de voltaje son detectables en la estructura cristalina. b) Residuos básicos de S4 y residuos ácidos en su proximidad en el ámbito de los sensores de tensión .
Las canalopatías vinculadas a canales de potasio dependientes de voltaje
Los canales de potasio dependientes de voltaje se expresan ampliamente en una variedad de tejidos. En las neuronas, se dirigen a varios compartimentos subcelulares (Fig. 10), y canales de diferentes composiciones de subunidades pueden estar presentes en diferentes subpoblaciones de neuronas . Las mutaciones de los genes del canal KV pueden causar enfermedades neurológicas como ataxia episódica y epilepsias, enfermedades cardíacas y sordera . La conservación evolutiva de la función del canal KV es evidente, por ejemplo, por los trastornos de movimiento similares causados por la mutación de ortólogos KV1 en humanos, ratones y moscas de la fruta .
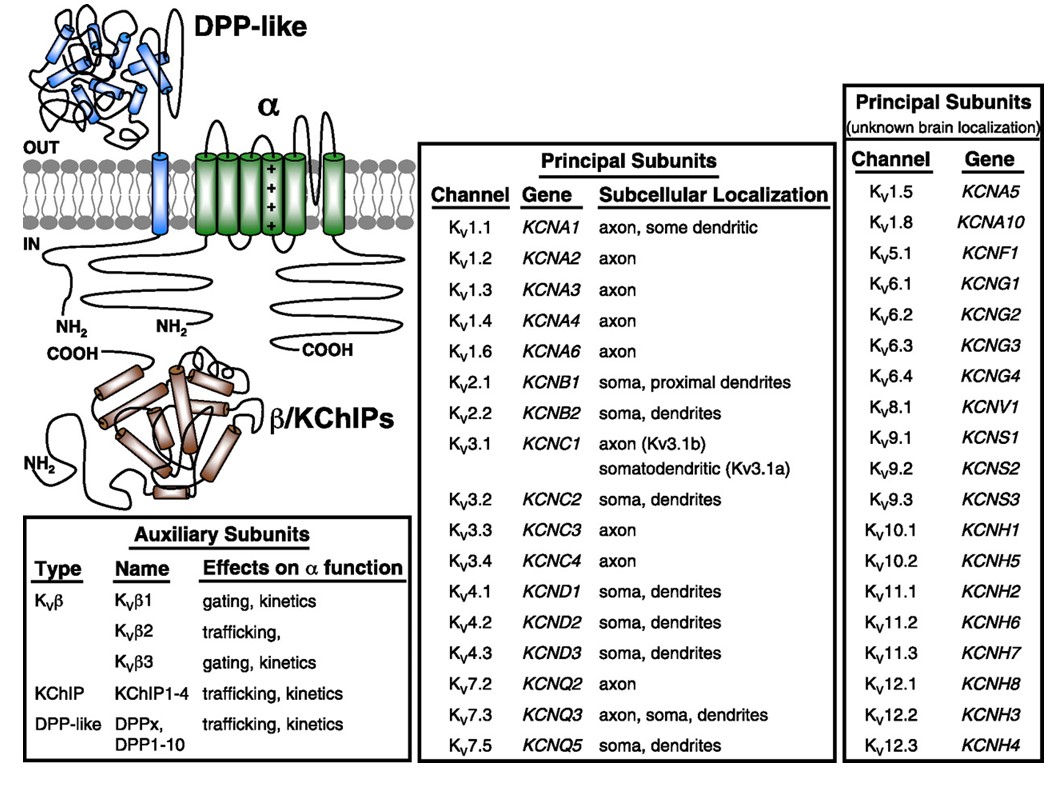
Figura 10. Distribución subcelular de canales de potasio dependientes de voltaje. El esquema en la parte superior izquierda representa un canal KV4 con dos subunidades auxiliares diferentes. La localización subcelular de varios canales KV en neuronas centrales de mamíferos se indica en la caja central .
Referencias y notas
1.Hille, B., Ionic Channels of Excitable Membranes, 3rd, Ed. 2001: Sinauer Associates Inc.
2.Gonzalez, C., et al., canales K (+): descripción general de la función y la estructura. Compre Physiol, 2012. 2 (3): p. 2087-149.
3.Vacher, H., D. P. Mohapatra, and J. S. Recortador, Localización y orientación de canales iónicos dependientes de voltaje en neuronas centrales de mamíferos. Physiol Rev, 2008. 88 (4): p. 1407-47.
4.Jegla, T. J., et al., Evolución del conjunto de canales iónicos humanos. Pantalla de Alto Rendimiento Comb Chem, 2009. 12 (1): págs. 2-23.
5.Cang, C., et al., TMEM175 Es un Canal Orgánulo K(+) Que Regula la Función Lisosómica. Cell, 2015. 162 (5): págs. 1101-12.
6.Hodgkin, A. L. y A. F. Huxley, Corrientes transportadas por iones de sodio y potasio a través de la membrana del axón gigante de Loligo. J Physiol, 1952. 116 (4): p. 449-72.
7.Rosenthal, J. J., T. I. Liu, and W. F. Gilly, Una familia de ADNC KV1 rectificadores retardados que muestran una expresión específica de tipo celular en el complejo ganglio estrellado calamar/lóbulo de fibra gigante. J Neurosci, 1997. 17 (13): p. 5070-9.
8.Young, J. Z., fusionó neuronas y contactos sinápticos en las fibras nerviosas gigantes de los cefalópodos. Phil Trans R Soc Lond B, 1939. 229: p. 465-503.
9.Rosenthal, J. J. y F. Bezanilla, Edición extensa de ARNm para el canal K + rectificador retardado de calamar regula la tetramerización de subunidades. Neuron, 2002. 34 (5): págs. 743 a 57.
10.Jan, L. Y. and Y. N. Jan, Canales de potasio dependientes de voltaje y la diversidad de señalización eléctrica. J Physiol, 2012. 590( 11): p. 2591-9.
11.Johnston, J., I. D. Forsythe, y C. Kopp-Scheinpflug, Going native: voltage-gated potassium channels controlling neuronal excitability. J Physiol, 2010. 588 (Pt 17): p. 3187-200.
12.Subunidades Bockstein, E., KV5, KV6, KV8 y KV9: No hay simples espectadores silenciosos. J Gen Physiol, 2016. 147 (2): págs. 105-25.
13.Wulff, H., N. A. Castle, y L. A. Pardo, Canales de potasio controlados por voltaje como dianas terapéuticas. Nat Rev Drug Discov, 2009. 8 (12): p. 982-1001.
14.Bates, E., Canales iónicos en desarrollo y cáncer. Annu Rev Cell Dev Biol, 2015. 31: p. 231-47.
15.Huang, X. y L. Y. Jan, Targeting potassium channels in cancer. J Cell Biol, 2014. 206( 2): p. 151-62.
16.Huang, X., et al., canal de potasio EAG2 con función evolutivamente conservada como diana de tumor cerebral. Nat Neurosci, 2015. 18 (9): págs. 1236-46.
17.Kunzelmann, K., Canales iónicos y cáncer. J Membr Biol, 2005. 205 (3): p. 159-73.
18.Li, M. y Z. G. Xiong, Canales iónicos como objetivos para la terapia del cáncer. Int J Physiol Pathophysiol Pharmacol, 2011. 3 (2): p. 156-66.
19.Pardo, L. A., Canales de potasio controlados por voltaje en la proliferación celular. Fisiología (Bethesda), 2004. 19: p. 285-92.
20.Urrego, D., et al., Canales de potasio en el ciclo celular y proliferación celular. Philos Trans R Soc Lond B Biol Sci, 2014. 369( 1638): p. 20130094.
21.Zhou, Y., et al., Química de la coordinación iónica y la hidratación revelada por un complejo Fab de canal K + a una resolución de 2,0 A. Nature, 2001. 414 (6859): p. 43-8.
22.MacKinnon, R., Canales de potasio. FEBS Lett, 2003. 555 (1): p. 62-5.
23.Kuang, Q., P. Purhonen, y H. Hebert, Estructura de los canales de potasio. Cell Mol Life Sci, 2015. 72( 19): p. 3677-93.
24.Isacoff, E. Y., L. Y. Jan, y D. L. Minor, Jr., Conduits of life’s spark: a perspective on ion channel research since the birth of neuron. Neuron, 2013. 80 (3): p. 658-74.
25.Swartz, K. J., Detectando voltaje a través de membranas lipídicas. Nature, 2008. 456 (7224): p. 891-7.
26.Nusser, Z., Distribución subcelular diferencial de los canales iónicos y la diversidad de la función neuronal. Curr Opin Neurobiol, 2012. 22 (3): p. 366-71.
27.Lujan, R., Organización de los canales de potasio en la superficie neuronal. J Chem Neuroanat, 2010. 40 (1): págs. 1-20.
28.Abriel, H. y E. V. Zaklyazminskaya, Canalopatías cardíacas: mecanismos genéticos y moleculares. Gene, 2013. 517 (1): p. 1-11.
29.Kullmann, D. M. y M. G. Hanna, Trastornos neurológicos causados por mutaciones hereditarias del canal iónico. Lancet Neurol, 2002. 1 (3): p. 157-66.
30.Lehmann-Horn, F. y K. Jurkat-Rott, Voltage-gated ion channels and hereditary disease. Physiol Rev, 1999. 79 (4): p. 1317-72.
31.Villa, C. y R. Combi, Canales de Potasio y Fenotipos Epilépticos Humanos: Una visión General Actualizada. Neurociencia de Células Delanteras, 2016. 10: p. 81.
32.Long, S. B., E. B. Campbell, and R. Mackinnon, Estructura cristalina de un canal K + de la familia de agitadores dependientes de voltaje de mamíferos. Science, 2005. 309 (5736): p. 897-903.
33.Chen, X., et al., Estructura del canal de potasio del agitador de longitud completa KV1. 2 por refinamiento cristalográfico de rayos X basado en modo normal. Proc Natl Acad Sci U S A, 2010. 107 (25): p. 11352-7.
34.Clayton, G. M., et al., Estructura de las regiones transmembranas de un canal regulado por nucleótidos cíclicos bacterianos. Proc Natl Acad Sci U S A, 2008. 105 (5): p. 1511-5.
35.Payandeh, J., et al. La estructura cristalina de un canal de sodio voltaje. Naturaleza, 2011. 475 (7356): p. 353-8.
36.Zhang, X., et al., Estructura cristalina de un ortólogo del canal de sodio controlado por voltaje de NaChBac. Naturaleza, 2012. 486 (7401): p. 130-4.
37.Liao, M., et al., Estructura del canal iónico TRPV1 determinada por criomicroscopia de electrones. Naturaleza, 2013. 504 (7478): p. 107-12.
38.Long, S. B., et al., Estructura atómica de un canal K+ dependiente de voltaje en un entorno similar a una membrana lipídica. Nature, 2007. 450 (7168): p. 376-82.