El ciclo de glucosa – alanina, o ciclo de Cahill, propuesto por primera vez por Mallette, Exton y Park, y Felig et al. entre 1969 y 1970, consiste en una serie de pasos a través de los cuales los tejidos extrahepáticos, por ejemplo el músculo esquelético, exportan piruvato y grupos amino como alanina al hígado, y reciben glucosa del hígado a través del torrente sanguíneo.
Los pasos principales del ciclo de glucosa-alanina se resumen a continuación.
- Cuando en tejidos extrahepáticos se utilizan aminoácidos para obtener energía, el piruvato, derivado de la glucólisis, se utiliza como aceptor de grupos aminos, formando alanina, un aminoácido no esencial.
- La alanina se difunde en el torrente sanguíneo y llega al hígado.
- En el hígado, el grupo amino de la alanina se transfiere a α-cetoglutarato para formar piruvato y glutamato, respectivamente.
- El grupo amino del glutamato entra principalmente en el ciclo de la urea, y en parte actúa como donante de nitrógeno en muchas vías biosintéticas.
El piruvato entra en la gluconeogénesis y se utiliza para la síntesis de glucosa. - La glucosa recién formada se difunde en el torrente sanguíneo y llega a los tejidos periféricos donde, debido a la glucólisis, se convierte en piruvato que puede aceptar grupos aminos de los aminoácidos libres, cerrando así el ciclo.
Por lo tanto, el ciclo de glucosa-alanina proporciona un vínculo entre el metabolismo de carbohidratos y aminoácidos, como se describe esquemáticamente a continuación.
Glucosa → Piruvato → Alanina → Piruvato → Glucosa
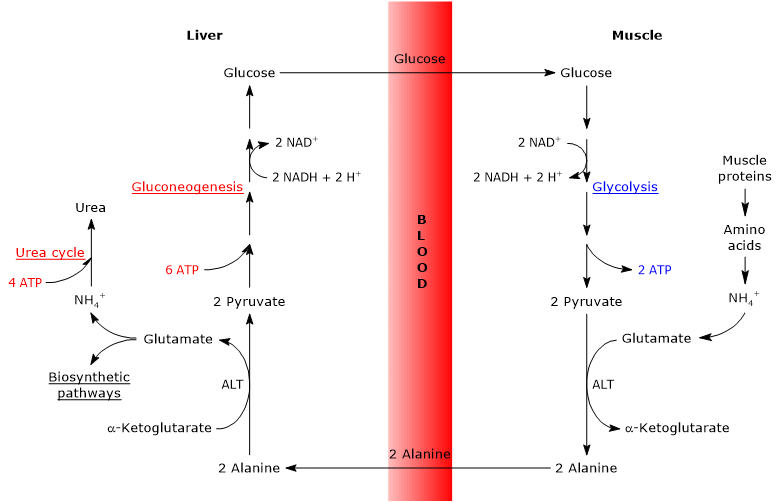
El ciclo de glucosa-alanina se produce no solo entre el músculo esquelético, el primer tejido en el que se observó, y el hígado, sino que involucra a otras células y tejidos extrahepáticos, incluidas las células del sistema inmunitario, como los órganos linfoides.
CONTENIDO
- Los pasos del ciclo de glucosa-alanina
- Cahill ciclo en el músculo esquelético
- Cahill ciclo en el hígado
- Transaminasas
- Funciones del ciclo de glucosa-alanina
- costo de Energía de ciclo de glucosa-alanina
- Similitudes y diferencias entre Cahill ciclo y ciclo de Cori
Los pasos del ciclo de glucosa-alanina
El análisis de los pasos del ciclo de glucosa-alanina se realiza considerando el ciclo entre el músculo esquelético y el hígado.
Tanto las proteínas intracelulares como extracelulares se hidrolizan continuamente a los aminoácidos constituyentes y se resintetizan, y la velocidad a la que se producen estos procesos se equilibra con precisión, evitando así la pérdida de masa libre de grasa.
Sin embargo, en condiciones catabólicas, como el ejercicio intenso y prolongado o el ayuno, la tasa de descomposición de las proteínas musculares excede la síntesis. Esto conduce a la liberación de aminoácidos, algunos de los cuales se utilizan para la energía y otros para la gluconeogénesis. Y la oxidación de los esqueletos de carbono de los aminoácidos, en particular los aminoácidos de cadena ramificada o BCAA (leucina, isoleucina y valina), puede ser una fuente importante de energía para el músculo. Por ejemplo, después de unos 90 minutos de ejercicio extenuante, la oxidación de aminoácidos en el músculo proporciona del 10 al 15% de la energía necesaria para la contracción.
La utilización de los esqueletos de carbono de aminoácidos para obtener energía implica la eliminación del grupo amino y, a continuación, la excreción de nitrógeno amino en una forma no tóxica.
La eliminación del grupo α-amino se produce por transaminación, que se puede resumir de la siguiente manera:
ácido α-Ceto + aminoácido New Nuevo aminoácido + Nuevo ácido α-ceto
Tales reacciones, catalizadas por enzimas llamadas aminotransferasas o transaminasas (EC 2.6.1) son libremente reversibles.
Los aminoácidos de cadena ramificada, por ejemplo, transfieren el grupo amino a α-cetoglutarato o ácido 2-oxoglutárico, para formar glutamato y el ácido α-ceto derivado del aminoácido original, en una reacción catalizada por la aminotransferasa de cadena ramificada o BCAT (EC 2.6 .1.42).
El ciclo de Cahill en el músculo esquelético
En el músculo esquelético, el glutamato recién formado puede reaccionar con el amoníaco para formar glutamina, para muchos tejidos y órganos, como el cerebro, el principal vehículo para el transporte interorgánico de nitrógeno. La reacción es catalizada por la enzima citosólica glutamina sintetasa (EC 6.3.1.2), y consume un ATP.
Glutamato + NH4 + + ATP → Glutamina + ADP + Pi
En este caso, el glutamato abandona el ciclo de Cahill.
Alternativamente, y en contraste con lo que sucede en la mayoría de los otros tejidos, el glutamato recién formado puede transferir el grupo amino al piruvato, derivado de la glucólisis, para formar alanina y α-cetoglutarato. Esta transaminación es catalizada por la alanina aminotransferasa o ALT (EC 2.6.1.2), una enzima que se encuentra en la mayoría de los tejidos animales y vegetales.
Glutamato + Piruvato Al Alanina + α-Cetoglutarato
La alanina producida y derivada directamente de la degradación de proteínas, y las proteínas musculares son ricas en alanina, pueden salir de la célula y ser transportadas por el torrente sanguíneo al hígado; de esta manera el grupo amino llega al hígado. Y la velocidad a la que la alanina formada por transaminación de piruvato se transfiere a la circulación es proporcional a la producción de piruvato intracelular.
Nota: La alanina y la glutamina son las principales fuentes de nitrógeno y carbono en el metabolismo de aminoácidos interorgánicos.
El ciclo de Cahill en el hígado
Una vez en el hígado, una alanina aminotransferasa hepática cataliza una transaminación en la que la alanina, el principal aminoácido gluconeogénico, actúa como donante de grupo amino y α-cetoglutarato como receptor de α-cetoácido. Los productos de la reacción son el piruvato, es decir, el esqueleto de carbono de la alanina, y el glutamato.
Alanina + α-Cetoglutarato Glut Glutamato + Piruvato
Glutamato, en la reacción catalizada por la glutamato deshidrogenasa (EC 1.4.1.2), una enzima presente en la matriz mitocondrial, forma ion amónico, que entra en el ciclo de la urea, y α-cetoglutarato, que puede entrar en el ciclo de Krebs. Esta reacción es una reacción anaplerótica que vincula el metabolismo de los aminoácidos con el ciclo de Krebs.
Glutamato + H2O + NAD + α α-Cetoglutarato + NH4 + + NADH + H +
Sin embargo, el glutamato también puede reaccionar con el oxaloacetato para formar aspartato y α-cetoglutarato, en una reacción catalizada por la aspartato aminotransferasa (EC 2.6.1.1). El aspartato participa en la formación de urea, así como en la síntesis de purinas y pirimidinas.
Glutamato + Oxaloacetato Aspar Aspartato + α-Cetoglutarato
También el piruvato producido puede tener diferentes destinos metabólicos: puede ser oxidado para la producción de ATP, y luego abandonar el ciclo de glucosa-alanina, o entrar en la vía de la gluconeogénesis, y así continuar en el ciclo.
La glucosa producida se libera del hígado al torrente sanguíneo y se entrega a varios tejidos que la requieren, como el músculo esquelético, en el que se utiliza para la síntesis de piruvato. A su vez, el piruvato recién formado puede reaccionar con el glutamato, cerrando así el ciclo.
Transaminasas
Como se mencionó anteriormente, la eliminación del grupo amino de los aminoácidos se produce a través de la transaminación (consulte la reacción general anterior). Estas reacciones son catalizadas por enzimas llamadas aminotransferasas o transaminasas.
Son enzimas citosólicas, presentes en todas las células y particularmente abundantes en el hígado, riñón, intestino y músculo; requieren fosfato de piridoxal o PLP, la forma activa de vitamina B6 o piridoxina, como coenzima, que está estrechamente unida al sitio activo.
En las reacciones de transaminación, el grupo amino de aminoácidos libres, excepto de treonina y lisina, se canaliza hacia un pequeño número de α-cetoácidos, en particular piruvato, oxaloacetato y α-cetoglutarato.
Las células contienen diferentes tipos de aminotransferasas: muchas son específicas para α-cetoglutarato como aceptor de α-ceto ácido, pero difieren en especificidad para el aminoácido, del que se denominan. Ejemplos son la alanina aminotransferasa, también llamada alanina transaminasa y glutámico pirúvico transferasa o GPT, y aspartato aminotransferasa o AST, también llamada glutámico-oxaloacético transaminasa o GOT.
Debe subrayarse que no hay desaminación neta en estas reacciones, ni pérdida de grupos amino, ya que el aceptor de ácido α-ceto está aminado y el aminoácido desaminado.
Funciones del ciclo de glucosa-alanina
Este ciclo tiene varias funciones.
- Transporta nitrógeno en forma no tóxica desde los tejidos periféricos hasta el hígado.
- Transporta piruvato, un sustrato gluconeogénico, al hígado.
- Elimina el piruvato de los tejidos periféricos. Esto conduce a una mayor producción de ATP a partir de la glucosa en estos tejidos. De hecho, el NADH producido durante la glucólisis puede entrar en las mitocondrias y oxidarse a través de la fosforilación oxidativa.
- Permite mantener una concentración relativamente alta de alanina en hepatocitos, suficiente para inhibir la degradación de proteínas.
- Puede desempeñar un papel en la defensa del huésped contra enfermedades infecciosas.
Finalmente, es importante subrayar que no hay síntesis neta de glucosa en el ciclo de glucosa-alanina.
Costo de energía del ciclo de glucosa-alanina
Al igual que el ciclo de Cori, también el ciclo de glucosa-alanina tiene un costo de energía, igual a 3-5 ATP.
La parte del ciclo que tiene lugar en tejidos periféricos implica la producción de 5-7 ATP por molécula de glucosa:
- 2 El ATP se produce por glucólisis;
- 3-5 ATP se derivan de NADH / FADH2 (ver a continuación).
En su lugar en el hígado, la gluconeogénesis y el ciclo de la urea cuestan 10 ATP:
- 6 El ATP se consume durante la gluconeogénesis por molécula de glucosa sintetizada;
- 4 ATP se consumen en el ciclo de la urea por molécula de urea sintetizada.
El ciclo de glucosa-alanina, al igual que el ciclo Cori, desplaza parte de la carga metabólica de los tejidos extrahepáticos al hígado. Sin embargo, el costo energético pagado por el hígado se justifica por las ventajas que el ciclo aporta a todo el cuerpo, ya que permite, en condiciones particulares, una descomposición eficiente de las proteínas en los tejidos extrahepáticos (especialmente el músculo esquelético), lo que a su vez permite obtener sustratos gluconeogénicos, así como el uso de aminoácidos para obtener energía en los tejidos extrahepáticos.
Similitudes y diferencias entre el ciclo de Cahill y el ciclo de Cori
Hay algunas analogías entre los dos ciclos, que se enumeran a continuación.
- El ciclo de Cahill se solapa parcialmente con el ciclo de Cori cuando el piruvato se convierte en glucosa y el monosacárido se transporta a tejidos extrahepáticos, en los que se convierte de nuevo en piruvato a través de la vía glucolítica.
- La entrada en la vía de la gluconeogénesis es similar para los dos ciclos: tanto la alanina como el lactato se convierten en piruvato.
- Al igual que el ciclo de Cori, el ciclo de glucosa-alanina se produce entre diferentes tipos de células, a diferencia de las vías metabólicas como la glucólisis, el ciclo de Krebs o la gluconeogénesis que se producen dentro de las células individuales
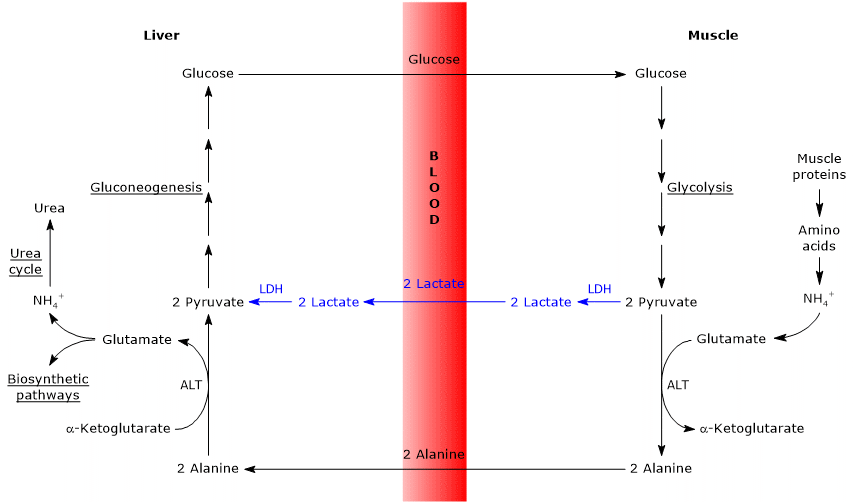
A continuación, algunas diferencias entre los dos ciclos.
- La principal diferencia se refiere a los tres intermedios de carbono que desde los tejidos periféricos llegan al hígado: lactato en el ciclo Cori, y alanina en el ciclo glucosa-alanina.
- Otra diferencia se refiere al destino del NADH producido por glucólisis en tejidos periféricos.
En el ciclo Cori, la coenzima actúa como agente reductor para reducir el piruvato a lactato, en la reacción catalizada por la lactato deshidrogenasa (EC 1.1.1.27).
En el ciclo de glucosa-alanina, esta reducción no ocurre y los electrones de NADH pueden ser transportados a las mitocondrias a través de los transbordadores de malato-aspartato y glicerol 3-fosfato, generando NADH, el primer transbordador, y FADH2, el otro transbordador. Y el rendimiento de ATP de NADH y FADH2 es de 2,5 y 1,5, respectivamente. - Finalmente, del punto anterior, está claro que, a diferencia del ciclo Cori, el ciclo de Cahill requiere la presencia de oxígeno y mitocondrias en los tejidos periféricos.
Berg J. M., Tymoczko J. L., and Stryer L. Biochemistry. 5ª Edición. W. H. Freeman and Company, 2002
Felig P., Pozefsk T., Marlis E., Cahill G. F. Alanina: papel clave en la gluconeogénesis. Science 1970; 167 (3920): 1003-4. doi: 10.1126 / ciencia.167.3920.1003
Gropper S. S., Smith J. L., Groff J. L. Nutrición avanzada y metabolismo humano. Cengage Learning, 2009
Lecker S. H., Goldberg A. L. y Mitch W. E. Degradación de proteínas por la vía ubiquitina-proteasoma en estados normales y de enfermedad. J Am Soc Nephrol 2006; 17(7): 1807-19. doi: 10.1681 / ASN.2006010083
Mallette L. E., Exton J. H. y Park C. R. Control de la gluconeogénesis a partir de aminoácidos en el hígado de rata perfundido. J Biol Chem 1969; 244(20): 5713-23.
Nelson D. L., Cox M. M. Lehninger. Principios de bioquímica. 6ª Edición. W. H. Freeman and Company, 2012
Raju S. M., Madala B. Bioquímica médica ilustrada. Jaypee Brothers Publishers, 2005
Wu G. Aminoácidos: bioquímica y nutrición. CRC Press, 2013