La Evidencia Detrás de las Intervenciones Naturales para la Enfermedad del Hígado Graso No alcohólico: Productos botánicos, Nutrientes y Probióticos para Tratar esta Dolencia Común
Dado el aumento de la enfermedad del hígado graso no alcohólico (NAFLD) tanto en adultos como en pediatría y la falta de un tratamiento farmacéutico indicado, las estrategias naturales para el tratamiento de esta afección están bien posicionadas como la «mejor opción siguiente».»Varios suplementos nutricionales y productos botánicos han sido estudiados clínicamente y son prometedores para el tratamiento de la EHGNA y su contraparte inflamatoria, la esteatohepatitis no alcohólica (EHNA). Teniendo en cuenta cuántas de estas terapias abordan los factores que contribuyen al desarrollo de NAFLD, no se necesita mucho razonamiento para comprender cómo pueden abordar de manera efectiva algunas de las causas fundamentales de la enfermedad, en lugar de solo abordar un síntoma.
Cinco intervenciones suplementarias con evidencia clínica o epidemiológica para su uso en el entorno de EHGNA son fosfatidil colina, que proporciona fosfolípidos y colina, vitamina E, ambos como tocoferoles alfa y una mezcla de tocotrienoles delta y gamma, extracto de semilla de cardo mariano, berberina y probióticos.
- Cambios en el Hígado Graso: ¿Correlacionados con una Deficiencia de Fosfatidil Colina?
- Vitamina E
- Cardo mariano
- Berberina
- Probióticos
- Conclusión
- La Dra. Carrie Decker, ND, se graduó con honores de la Facultad Nacional de Medicina Natural (ahora la Universidad Nacional de Medicina Natural) en Portland, Oregón. Dr. Decker atiende a los pacientes de forma remota, con un enfoque en las enfermedades gastrointestinales, los desequilibrios del estado de ánimo, los trastornos alimentarios, las enfermedades autoinmunes y la fatiga crónica. Antes de convertirse en médico naturópata, el Dr. Decker era ingeniero y obtuvo títulos de posgrado en ingeniería biomédica y mecánica de la Universidad de Wisconsin-Madison y la Universidad de Illinois en Urbana-Champaign, respectivamente. El Dr. Decker continúa disfrutando de la investigación académica y la escritura y utiliza estas habilidades para apoyar la educación en medicina integrativa como escritor y colaborador de varios recursos. Dr. Decker apoya a Allergy Research Group como miembro de su equipo de educación y desarrollo de productos.
- Fuentes:
- Spengler EK, Loomba R. Recomendaciones para el diagnóstico, derivación para biopsia hepática y tratamiento de la enfermedad hepática grasa no alcohólica y la esteatohepatitis no alcohólica. Actas de Mayo Clinic. 2015;90(9):1233–1246.
- Berardis S, Sokal E. Enfermedad hepática grasa no alcohólica pediátrica: un problema de salud pública en aumento. Eur J Pediatr. 2014 Feb;173 (2): 131-9.
- Jadeja R, et al. Medicamentos a base de plantas para el tratamiento de la esteatohepatitis no alcohólica: escenario actual y perspectivas de futuro. Complemento Basado en Evid Alternat Med. 2014:648308.
- Pomorski T, et al. Distribución y transporte de lípidos a través de las membranas celulares. Semin Cell Dev Biol. 2001 Apr; 12 (2): 139-48.
- Yamaji-Hasegawa A, et al. Distribución asimétrica de fosfolípidos en biomembranas. Toro Biol Pharm. 2006 Aug; 29 (8): 1547-53.
- Hişmioğullari AA, et al. Secreción de lípidos biliares. Turk J Gastroenterol. Junio de 2007;18 (2): 65-70.
- Fischer LM, et al. El sexo y el estado menopáusico influyen en los requisitos dietéticos humanos para el nutriente colina. Am J Clin Nutr. 2007 May; 85 (5): 1275-85.
- Wallace TC, et al. La Ingesta Habitual de Colina Se Asocia con el Consumo de Alimentos con Huevo y Proteínas en los Estados Unidos. Nutriente. 5 de agosto de 2017; 9(8).
- Zeisel SH. Los elementos de respuesta génica, los polimorfismos genéticos y la epigenética influyen en las necesidades alimentarias humanas de colina. IUBMB Life. Junio de 2007; 59(6): 380-7.
- Zeisel SH. Los elementos de respuesta génica, los polimorfismos genéticos y la epigenética influyen en las necesidades alimentarias humanas de colina. IUBMB Life. Junio de 2007; 59(6): 380-7.
- Guerrerio AL, et al. Ingesta de colina en una gran cohorte de pacientes con enfermedad hepática grasa no alcohólica. Am J Clin Nutr. Abril de 2012; 95 (4): 892-900.
- Ma X, et al. La polienilfosfatidilcolina atenúa la fibrosis hepática no alcohólica y acelera su regresión. J Hepatol. 1996 May;24 (5): 604-13.
- Lieber CS, et al. La fosfatidilcolina protege contra la fibrosis y la cirrosis en el babuino. Gastroenterología. 1994 Jan;106 (1): 152-9.
- Chanussot F, et al. Prevención por fosfatidilcolinas poliinsaturadas dietéticas (n-6) de colestasis intrahepática inducida por ciclosporina A en animales. Ciencias de la Vida. 2003 Jun 13; 73 (4): 381-92.
- Karaman A, et al. Efecto protector de la fosfatidilcolina poliinsaturada sobre el daño hepático inducido por obstrucción biliar en ratas. J Pediatr Surg. 2003 Sep; 38(9): 1341-7.
- Karaman A, et al. Efecto protector de la fosfatidilcolina poliinsaturada sobre el daño hepático inducido por obstrucción biliar en ratas. J Pediatr Surg. 2003 Sep; 38(9): 1341-7.
- Stremmel W, et al. Protección de la mucosa por fosfatidilcolina. Dig Dis. 2012; 30 Suppl 3: 85-91.
- Parlesak A, et al. Las sales biliares primarias conjugadas reducen la permeabilidad de la endotoxina a través de las células epiteliales intestinales y se sinergizan con la fosfatidilcolina en la supresión de la producción de citoquinas inflamatorias. Medicina de Hematocrito. 2007 Oct;35(10): 2367-74.
- Mitzscherling K, et al. La fosfatidilcolina revierte el aumento inducido por etanol en la permeabilidad de las endotoxinas transepiteliales y elimina la activación de los leucocitos transepiteliales. Alcohol Clin Exp Res. 2009 Mar;33 (3): 557-62.
- Buzzetti E, et al. The multiple-hit pathogenesis of non-alcoholic fatty liver disease (NAFLD) (en inglés). Metabolismo. Agosto de 2016;65 (8):1038-48.
- El Hadi H, et al. Vitamina E como Tratamiento para la Enfermedad del Hígado Graso No Alcohólico: ¿Realidad o Mito? Antioxidantes (Basilea). 16 de enero de 2018; 7(1).
- Bugianesi E, et al. Un ensayo controlado aleatorizado de metformina versus vitamina E o dieta prescriptiva en la enfermedad del hígado graso no alcohólico. Am J Gastroenterol. 2005 May;100 (5): 1082-90.
- Sanyal AJ, et al. Pioglitazona, vitamina E o placebo para la esteatohepatitis no alcohólica. N Engl J Med. 2010 May 6; 362 (18): 1675-85.
- Lavine JE. Tratamiento con vitamina E de la esteatohepatitis no alcohólica en niños: un estudio piloto. J Pediatr. 2000 Jun;136 (6): 734-8.
- Peh HY, et al. Terapia con vitamina E más allá del cáncer: tocoferol versus tocotrienol. Pharmacol Ther. 2016 Jun;162: 152-69.
- Qureshi AA, et al. Modulación dosis-dependiente de los parámetros lipídicos, citocinas y ARN por delta-tocotrienol en sujetos hipercolesterolémicos restringidos a la dieta de AHA Paso 1. Brit J of Med & Med Res. 2015;6 (4): 351-66.
- Qureshi AA, et al. Impacto del delta-tocotrienol en biomarcadores inflamatorios y estrés oxidativo en sujetos hipercolesterolémicos. Cardiología Clin Exp. 2015;6(4):1000367.
- Zaiden N, et al. Los tocotrienoles gamma delta reducen la síntesis de triglicéridos hepáticos y la secreción de VLDL. Trombos de Ateroscler. 2010 Oct 27;17 (10): 1019-32.
- Magosso E, et al. Tocotrienoles para la normalización de la respuesta ecogénica hepática en hígado graso no alcohólico: un ensayo clínico aleatorizado controlado con placebo. Nutr J. 2013 Dec 27; 12 (1): 166.
- Pervez MA, et al. Efectos de la Suplementación con Delta-tocotrienol en Enzimas Hepáticas, Inflamación, Estrés Oxidativo y Esteatosis Hepática en Pacientes con Enfermedad Hepática Grasa No Alcohólica. Turk J Gastroenterol. 2018 Mar; 29 (2):170-176.
- Abenavoli L, et al. Cardo mariano en enfermedades hepáticas: pasado, presente, futuro. Phytother Res. 2010 Oct; 24 (10): 1423-32.
- Valenzuela A, et al. Selectividad de la silimarina en el aumento del contenido de GSH en diferentes tejidos de la rata. Planta Med. 1989 Oct; 55 (5): 420-2.
- Rui YC. Avances en los estudios farmacológicos de la silimarina. Mem Inst Oswaldo Cruz. 1991; 86 Suppl 2: 79-85.
- Gu M, et al. La Silimarina Mejora la Disfunción Metabólica Asociada con la Obesidad Inducida por la Dieta a través de la Activación del Receptor Farnesil X. Farmacol frontal. 28 de septiembre de 2016; 7:345.
- Ali AH, et al. Los recientes avances en el desarrollo de farnesoid X agonistas de los receptores. Ann Transl Med. Enero de 2015; 3 (1):5.
- Traussnigg S, et al. Eficacia y seguridad del agonista del receptor farnesoide X no esteroidal PX-104 en pacientes con enfermedad del hígado graso no alcohólico (EHGNA). Zeitschrift für Gastroenterologie. Mayo de 2017; 55(05): A71.
- Zhong S, et al. El efecto terapéutico de la silimarina en el tratamiento de la enfermedad grasa no alcohólica: Un metanálisis (PRISMA) de ensayos controlados aleatorios. Medicina (Baltimore). Diciembre de 2017; 96(49): e9061.
- Hajiaghamohammadi AA, et al. Efectos del tratamiento con metformina, pioglitazona y silimarina en la enfermedad del hígado graso no alcohólico: un estudio piloto controlado aleatorizado. Hepat Mon. Agosto de 2012; 12 (8): e6099.
- Birdsall TC, et al. Berberina: potencial terapéutico de un alcaloide que se encuentra en varias plantas medicinales. Altern Med Rev. 1997; 2:94-103.
- Imanshahidi M, et al. Efectos farmacológicos y terapéuticos de Berberis vulgaris y su componente activo, la berberina. Phytother Res. 2008 Aug; 22 (8): 999-1012.
- Zhu X, et al. Los Mecanismos Potenciales de la Berberina en el Tratamiento de la Enfermedad Hepática Grasa No Alcohólica. Moléculas. 2016 Oct 14; 21 (10).
- Lan J, et al. Metaanálisis del efecto y la seguridad de la berberina en el tratamiento de la diabetes mellitus tipo 2, la hiperlipemia y la hipertensión. J Ethnopharmacol. 23 de febrero de 2015; 161: 69-81.
- Sun R, et al. La Berberina Administrada por Vía Oral Modula el Metabolismo Lipídico Hepático al Alterar el Metabolismo Microbiano de los Ácidos Biliares y la Vía de Señalización Intestinal FXR. Mol Pharmacol. 2017 Feb; 91 (2): 110-122.
- Guo T, et al. La Berberina Mejora la Esteatosis Hepática y Suprime la Inflamación del Hígado y del Tejido Adiposo en Ratones con Obesidad inducida por la Dieta. Sci Rep. 2016 Mar 3; 6: 22612.
- Schattenberg JM, et al. JNK1 pero no JNK2 promueve el desarrollo de esteatohepatitis en ratones. Hepatología. 2006 Jan; 43 (1): 163-72.
- Han J, et al. Modulación de la microbiota intestinal como mecanismo antidiabético de la berberina. Med Sci Monit. 2011; 17: RA164-7.
- Gu L, et al. La berberina mejora el daño de la unión estrecha del epitelio intestinal y reduce la regulación de las vías de la cinasa de cadena ligera de miosina en un modelo de endotoxinemia en ratones. J Infectar Dis. 2011 Jun 1; 203 (11): 1602-12.
- Li N, et al. La berberina atenúa la alteración de la unión estrecha inducida por citoquinas proinflamatorias en un modelo in vitro de células epiteliales intestinales. Eur J Pharm Sci. 2010 Apr 16; 40 (1): 1-8.
- Ma X, et al. La Patogénesis de la Diabetes Mellitus por Estrés Oxidativo e Inflamación: Su Inhibición por la Berberina. Farmacol frontal. 27 de julio de 2018; 9:782.
- Yan HM, et al. Eficacia de la Berberina en Pacientes con Enfermedad Hepática Grasa No Alcohólica. PLoS Uno. 7 de agosto de 2015; 10 (8): e0134172.
- Ma YY, et al. Effects of probiotics on nonalcoholic fatty liver disease: a meta-analysis (en inglés). World J Gastroenterol. 2013 Oct 28;19(40): 6911-8.
- Vajro P, et al. Efectos de la cepa GG de Lactobacillus rhamnosus en la enfermedad hepática relacionada con la obesidad infantil. J Pediatr Gastroenterol Nutr. Junio de 2011; 52 (6): 740-3.
- Alisi A, et al. Ensayo clínico aleatorizado: Los efectos beneficiosos de la VSL#3 en niños obesos con esteatohepatitis no alcohólica. Aliment Pharmacol Ther. 2014 Jun;39 (11): 1276-85.
- Pérez-Rubio KG, et al. Efecto de la administración de berberina sobre el síndrome metabólico, la sensibilidad a la insulina y la secreción de insulina. Metab Syndr Relat Disord. 2013 Oct;11 (5): 366-9.
- Iacono A, et al. Los probióticos como estrategia terapéutica emergente para tratar la EHGNA: enfoque en los mecanismos moleculares y bioquímicos. J Nutr Biochem. Agosto de 2011; 22 (8): 699-711.
- Honda Y, et al. Eficacia del glutatión para el tratamiento de la enfermedad del hígado graso no alcohólico: estudio piloto abierto, multicéntrico, de un solo brazo. Gastroenterol BMC. 8 de agosto de 2017; 17 (1): 96.
- Dentico P, et al. . Recenti Prog Med. 1995 Jul-Aug; 86 (7-8): 290-3.
- Khoshbaten M, et al. La N-acetil-cisteína mejora la función hepática en pacientes con enfermedad hepática grasa no alcohólica. Hepatitis Mon. 2010;10(1):12-16.
- Muto C, et al. El gamma-tocotrienol reduce el nivel de triacilglicerol en los hepatocitos primarios de rata a través de la regulación del metabolismo de los ácidos grasos. J Clin Biochem Nutr. 2013;52(1):32-37.
- Parker HM, et al. Suplementación con Omega-3 y enfermedad del hígado graso no alcohólico: una revisión sistemática y meta-análisis. J Hepatol. 2012;56(4):944-51.
Cambios en el Hígado Graso: ¿Correlacionados con una Deficiencia de Fosfatidil Colina?
La fosfatidil colina (PC) es esencial para la salud de todas las células del cuerpo y es uno de los principales fosfolípidos que componen las membranas celulares., el PC comprende más del 90% del contenido total de fosfolípidos biliares y facilita la emulsificación, absorción y transporte de grasas. Los estudios han demostrado que la ingesta adecuada recomendada (IA) de colina (ver Tabla 1) puede no ser suficiente para prevenir síntomas de deficiencia, como cambios en el hígado graso o daño muscular. Además, un estudio reciente encontró que solo el 8% de los adultos estadounidenses cumplen con la IA recomendada de colina, con vegetarianos, mujeres posmenopáusicas y hombres con mayor riesgo de insuficiencia., Los polimorfismos genéticos también pueden aumentar la necesidad de colina, que también es una fuente de grupos metilo en el cuerpo.
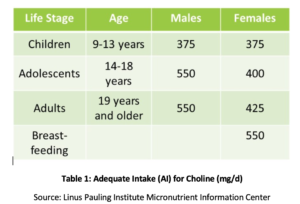
En mujeres posmenopáusicas con EHGNA, se ha demostrado que la disminución de la ingesta de colina está significativamente asociada con un mayor riesgo de fibrosis. En animales, se ha demostrado que la PC protege frente a la fibrosis asociada a la inflamación hepática., Se ha demostrado que el aumento de la ingesta de PC mejora la secreción de lípidos biliares, previniendo así la colestasis y el daño hepático subsiguiente a través de numerosos mecanismos, incluida la supresión del factor nuclear kappa B (NF-kB), un desencadenante molecular bien conocido de la inflamación., En un modelo animal de obstrucción biliar, se ha demostrado que el CP suplementario reduce el daño hepático, la proliferación ductal y la fibrosis.
El PC también es esencial para la salud del intestino y es un componente primario de la capa protectora de moco intestinal. En cultivos celulares, se ha demostrado que el tratamiento con PC reduce la migración de la endotoxina a través de las células epiteliales intestinales, suprimiendo aún más la respuesta inflamatoria de citoquinas asociada. La PC también reduce la translocación de endotoxinas en el contexto de aumentos inducidos por el alcohol en la permeabilidad intestinal. Este efecto beneficioso se ha propuesto como uno de los mecanismos por los cuales la PC puede considerarse terapéutica en la enfermedad hepática alcohólica.
Vitamina E
Como un golpe de estrés oxidativo y defensas antioxidantes disminuidas se ha propuesto como un factor que lidera el desarrollo de NAFLD, no debería sorprender que los antioxidantes se hayan investigado como un tratamiento potencial para la afección.
 La vitamina E se ha estudiado en varios ensayos clínicos para el tratamiento de la EHGNA, tanto como terapia independiente como complementaria. En una revisión de estos estudios, la dosis de vitamina E osciló entre 400 y 1200 UI/día y la duración del estudio fue de 24 semanas a más de dos años. Los hallazgos fueron generalmente positivos, mostrando que cuando se incluyó vitamina E, se observaron mejoras en la histología, esteatosis y/o niveles de transaminasas., En pediatría con EHGNA, la vitamina E también se ha estudiado como terapia. En un estudio piloto abierto que incluyó a 11 niños con EHGNA, se encontró que la suplementación de entre 400 y 1200 UI de vitamina E durante cuatro a diez meses normalizaba los niveles de transaminasas y fosfatasas alcalinas durante el tratamiento, sin embargo, volvieron a ser anormales una vez que se interrumpió el tratamiento. La ecogenicidad hepática no cambió durante el curso del tratamiento.
La vitamina E se ha estudiado en varios ensayos clínicos para el tratamiento de la EHGNA, tanto como terapia independiente como complementaria. En una revisión de estos estudios, la dosis de vitamina E osciló entre 400 y 1200 UI/día y la duración del estudio fue de 24 semanas a más de dos años. Los hallazgos fueron generalmente positivos, mostrando que cuando se incluyó vitamina E, se observaron mejoras en la histología, esteatosis y/o niveles de transaminasas., En pediatría con EHGNA, la vitamina E también se ha estudiado como terapia. En un estudio piloto abierto que incluyó a 11 niños con EHGNA, se encontró que la suplementación de entre 400 y 1200 UI de vitamina E durante cuatro a diez meses normalizaba los niveles de transaminasas y fosfatasas alcalinas durante el tratamiento, sin embargo, volvieron a ser anormales una vez que se interrumpió el tratamiento. La ecogenicidad hepática no cambió durante el curso del tratamiento.
Los tocotrienoles son la familia menos estudiada de las formas naturales de vitamina E, con los tocoferoles, más a menudo encontrados en la naturaleza, dominando la investigación científica. Sin embargo, los tocotrienoles son potentes antioxidantes, citados en algunas investigaciones por tener de 40 a 60 veces el potencial antioxidante de los tocoferoles. Se ha demostrado que los tocotrienoles mejoran el colesterol total y sus fracciones, reduciendo el colesterol total y el colesterol LDL entre un 15 y un 20%, y los triglicéridos hasta casi un 30%. También se ha demostrado que los tocotrienoles tienen efectos antiinflamatorios y antioxidantes in vivo, reduciendo los niveles de proteína C reactiva de alta sensibilidad (PCR-hs) y reduciendo la oxidación de LDL.
Los tocotrienoles también se han estudiado como tratamiento para la EHGNA. En pacientes con EHGNA diagnosticado por ultrasonido, se demostró que 200 mg de tocotrienoles mixtos (procedentes del aceite de palma, con una fracción gamma alta y 61 mg adicionales de tocoferoles alfa) tomados dos veces al día durante un año normalizaban significativamente la respuesta ecogénica hepática y la tasa de remisión en comparación con el placebo. En un segundo estudio, en el que se incluyeron pacientes con EHGNA diagnosticado por ultrasonido y elevación de transaminasas, 300 mg de tocotrienoles (una mezcla delta:gamma de 90:10) tomados dos veces al día durante 12 semanas disminuyeron significativamente los niveles de aspartato aminotransferasa (AST), alanina aminotransferasa (ALT), PCR-HS y malondialdehído (un marcador de estrés oxidativo), así como la puntuación del índice de hígado graso en comparación con placebo.
Cardo mariano
El cardo mariano (Silybum marianum) es posiblemente el botánico protector hepático más conocido. La silimarina, una mezcla de los componentes activos del cardo mariano, y la silibinina, el compuesto más activo que se encuentra dentro de ella, han demostrado en estudios con animales que reducen las lesiones hepáticas causadas por acetaminofén, alcohol, sobrecarga de hierro y radiación, entre otras sustancias tóxicas conocidas para el hígado. Se ha demostrado que la silimarina aumenta los niveles de glutatión, un poderoso antioxidante, tanto en el hígado como en los intestinos. También reduce la peroxidación lipídica, que daña las membranas celulares, alterando su función y posiblemente causando la muerte celular.
Se ha demostrado que la silibinina y la silimarina activan un receptor nuclear de ácidos biliares conocido como receptor farnesoide X (FXR) en el hígado, regulando las vías inflamatorias y corrigiendo la resistencia a la insulina y la dislipidemia inducida por la alimentación con dieta alta en grasas (HFD). FXR es un regulador clave del equilibrio de ácidos biliares, glucosa y lípidos en el cuerpo. Los medicamentos que interactúan con la FXR de manera similar a estos compuestos derivados del cardo mariano también se están investigando para el tratamiento de la EHGNA y los desafíos metabólicos relacionados.
Los estudios clínicos también han demostrado que el cardo mariano mejora varios parámetros asociados con la EHGNA. Un metanálisis de 2017 encontró que el tratamiento con cardo mariano reduce significativamente la ALT y la AST en -5,08 UI/L y -5,44 UI/L, respectivamente, en pacientes con EHGNA. Las dosis oscilaron entre 140 mg una vez al día y 200 mg tres veces al día, durante 8 a 24 semanas. A la dosis más baja de 140 mg diarios, después de 8 semanas, se observaron mejoras significativas en los niveles de glucosa en sangre en ayunas (FBG), perfil lipídico y insulina sérica, además de reducciones de AST y ALT de 56 a 37.77 UI/L y 78,73 a 53,05 UI/L, respectivamente.
Berberina
La berberina, el alcaloide amarillo anaranjado que se encuentra en productos botánicos como la raíz y corteza de uva de Oregón, el sello de oro y el agracejo, es otra sustancia derivada de la botánica que tiene numerosos mecanismos por los que puede ayudar a proteger contra la EHGNA y apoyar su resolución.,,
Los efectos antidiabéticos y de equilibrio lipídico de la berberina se han demostrado en varios ensayos clínicos, y  puede ser el medio a través del cual la berberina afecta positivamente a la función hepática. Se ha demostrado que la berberina altera la expresión génica relacionada con el metabolismo y el metabolismo de los ácidos biliares a través de vías que también involucran la FXR. En estudios en animales, se ha demostrado que la berberina tiene el efecto de prevenir la obesidad asociada a HFD y la acumulación de triglicéridos hepáticos en ratones de tipo salvaje (normales), pero no en aquellos que tuvieron la eliminación genética de la expresión intestinal de FXR. La berberina también ha demostrado suprimir la inflamación asociada a la obesidad y la esteatosis hepática en ratones al disminuir la fosforilación del complejo inflamatorio conocido como JNK1, una proteína quinasa implicada en el desarrollo de esteatohepatitis. La JNK1 se activa fuertemente por factores estresantes ambientales y citoquinas proinflamatorias.
puede ser el medio a través del cual la berberina afecta positivamente a la función hepática. Se ha demostrado que la berberina altera la expresión génica relacionada con el metabolismo y el metabolismo de los ácidos biliares a través de vías que también involucran la FXR. En estudios en animales, se ha demostrado que la berberina tiene el efecto de prevenir la obesidad asociada a HFD y la acumulación de triglicéridos hepáticos en ratones de tipo salvaje (normales), pero no en aquellos que tuvieron la eliminación genética de la expresión intestinal de FXR. La berberina también ha demostrado suprimir la inflamación asociada a la obesidad y la esteatosis hepática en ratones al disminuir la fosforilación del complejo inflamatorio conocido como JNK1, una proteína quinasa implicada en el desarrollo de esteatohepatitis. La JNK1 se activa fuertemente por factores estresantes ambientales y citoquinas proinflamatorias.
La berberina también actúa en el intestino. No solo afecta al equilibrio microbiano intestinal, sino que también influye directamente en la permeabilidad intestinal, mejorando la integridad de las uniones estrechas en animales sujetos a endotoxemia o cultivos celulares tratados con citoquinas proinflamatorias.También se han demostrado efectos antiinflamatorios directos.
Los beneficios de la berberina en la EHGNA también se han demostrado clínicamente en un ensayo clínico aleatorizado, controlado en paralelo y abierto. En pacientes con EHGNA, se demostró que la berberina restablece la arquitectura hepática normal, los lípidos y el metabolismo del azúcar en la sangre, con mejoras significativas observadas en la población que solo implementó cambios en el estilo de vida.
Probióticos
Dada la relación entre las muchas alteraciones del sistema digestivo y la elevación de las enzimas hepáticas, no es de extrañar que los probióticos también se hayan estudiado como tratamiento para la EHGNA. Un metaanálisis reciente resume bien los hallazgos colectivos.
Ciento treinta y cuatro pacientes diagnosticados de NAFL/NASH por biopsia hepática se incluyeron en este análisis, y cada intervención utilizada en los cuatro ensayos controlados aleatorios elegibles para este metanálisis fue única (Lactobacillus bulgaricus y Streptococcus thermophilus durante tres meses; Lactobacillus GG durante ocho semanas; Bifidobacterium longum y fructooligosacáridos (FOS) durante 24 semanas; y una combinación patentada de Lactobacillus plantarum, L. delbrueckii, L. acidophilus, L. rhamnosus y Bifidobacterium bifidum durante seis meses). La dosis de probióticos osciló entre 500 millones y 12 mil millones de unidades formadoras de colonias (UFC) diarias. Los tratamientos probióticos mostraron una disminución significativa de los niveles de ALT y AST en -23,71 UI/L y -19,77 UI / L, respectivamente. También se observaron mejoras significativas en los niveles de colesterol total, factor de necrosis tumoral (TNF)-α y resistencia a la insulina.
En dos ensayos clínicos adicionales se investigaron probióticos como tratamiento para la EHGNA infantil. En un estudio piloto doble ciego, controlado con placebo, doce niños, con una edad promedio de 10 años.a los 7 años de edad, con cambios en el hígado graso diagnosticados con ultrasonido y elevación persistente de las transaminasas, se les administraron 12 mil millones de UFC de GG de L. rhamnosus o placebo diariamente durante 8 semanas. El tratamiento con el probiótico redujo significativamente los niveles de ALT en comparación con el placebo, sin embargo, la ecogenicidad hepática y los niveles de AST no cambiaron. Además, los anticuerpos anti-peptidoglicano-polisacáridos, un indicador de la translocación de bacterias o membranas bacterianas a través de la barrera intestinal, disminuyeron significativamente en los niños que recibieron el probiótico en comparación con el placebo. El segundo estudio investigó el tratamiento de niños con EHGNA probado mediante biopsia con VSL #3, una mezcla de alta potencia de 8 cepas probióticas (incluyendo Streptococcus thermophilus, 3 Bifidobacterias spp., y 4 Lactobacillus spp.), comparado con placebo. En los niños que recibieron el probiótico, las puntuaciones de hígado graso mejoraron significativamente, con una probabilidad de hígado graso nulo, leve, moderado o severo al final del estudio de 21%, 70%, 9% y 0% en comparación con 0%, 7%, 76% y 17% en el grupo de placebo.
Conclusión
Existe una amplia gama de opciones seguras y efectivas disponibles que apoyan la restauración de la salud en las personas con EHGNA. Aunque cada individuo puede tener diferentes mecanismos subyacentes que contribuyen a la disfunción hepática y a los cambios inflamatorios, cada uno de estos agentes naturales de apoyo, y muchos otros (ver Tabla 2), pueden apoyar la función hepática normal en individuos con estos desafíos.
Tabla 2: Intervenciones nutricionales y botánicas para la EHGNA. Los nutrientes como estos deben usarse bajo la guía de un profesional de la salud calificado y con licencia.
| Nutriente | Dosificación | Mecanismo |
| Fosfatidilcolina (PC), una fuente de colina dietética | 1,5 g dos veces al día con las comidas (PC) O 200 mg dos veces al día (colina) | La colina es una deficiencia dietética común. PC es necesario para la producción de bilis y barrera protectora de la mucosa gastrointestinal. |
| Semillas de cardo mariano | 140 a 200 mg de una a tres veces al día | Hepatoprotector. Apoya los niveles de glutatión hepático, estabiliza la bomba de exportación de sales biliares (BSEP) y activa las vías de FXR. |
| Berberina HCl | 500 mg dos o tres veces al día | Mejora los perfiles séricos de glucosa y lípidos, reduciendo también el contenido de grasa hepática. |
| Probióticos, incluyendo cepas como B. longum, B. bifidum, S. thermophilus, L. rhamnosus, L. acidophilus y L. plantarum | 12 mil millones de unidades formadoras de colonias (UFC) diarias | Mejoró la función de barrera epitelial intestinal y redujo la inflamación intestinal y sistémica. |
| Acetil-glutatión | 300 mg diarios | Mejora la capacidad desintoxicante de los hepatocitos. |
| N-acetilcisteína (NAC) | 500-600 mg dos veces al día, mejor tomado con el estómago vacío | NAC bloquea la propagación de la peroxidación lipídica y apoya los niveles de glutatión hepático. |
| Vitamina E (tocoferoles)
O Tocotrienoles |
400 a 1200 UI diarias con alimentos
200 a 300 mg dos veces al día con alimentos |
Antioxidante protector.
Los tocotrienoles atenúan la acumulación de triglicéridos mediante la regulación de las enzimas sintasa de ácidos grasos y palmitoiltransferasa de carnitina, lo que conduce a una reducción de la inflamación hepática y el estrés del retículo endoplásmico. |
| Ácidos grasos esenciales Omega-3 | 2-4 g diarios, con las comidas | Se sabe que los ácidos grasos poliinsaturados Omega – 3 regulan a la baja la proteína 1c de unión a elementos reguladores de los esteroles y regulan al alza el receptor alfa activado por proliferadores de peroxisomas, favoreciendo así la oxidación de ácidos grasos y reduciendo la esteatosis. |