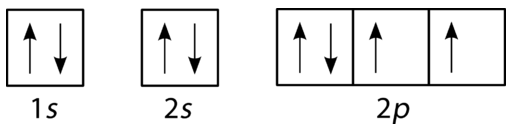
Diagrammes de remplissage Orbital
Un diagramme de remplissage orbital est la manière la plus visuelle de représenter la disposition de tous les électrons dans un atome particulier. Dans un diagramme de remplissage orbital, les orbitales individuelles sont représentées sous forme de cercles (ou de carrés) et les orbitales d’un sous-niveau sont dessinées horizontalement les unes à côté des autres. Chaque sous-niveau est étiqueté par son niveau d’énergie principal et son sous-niveau. Les électrons sont indiqués par des flèches à l’intérieur des cercles. Une flèche pointant vers le haut indique une direction de rotation, tandis qu’une flèche pointant vers le bas indique l’autre direction. Les diagrammes de remplissage orbital de l’hydrogène, de l’hélium et du lithium sont illustrés dans la figure ci-dessous.
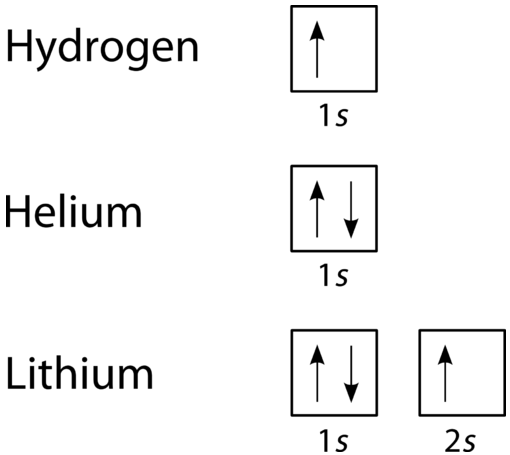
Selon le processus d’Aufbau, les sous-niveaux et les orbitales sont remplis d’électrons par ordre d’énergie croissante. Puisque le sous-niveau \(s\) est constitué d’une seule orbitale, le deuxième électron se couple simplement avec le premier électron comme dans l’hélium. L’élément suivant est le lithium et nécessite l’utilisation du sous-niveau suivant disponible, le \(2s\).
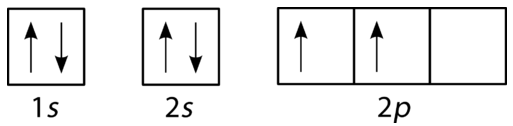
Le diagramme de remplissage pour le carbone est illustré dans la figure ci-dessous. Il y a deux électrons \(2p\) pour le carbone et chacun occupe sa propre orbitale \(2p\).
L’oxygène a quatre électrons \(2p\). Après que chaque orbitale \(2p\) a un électron dedans, le quatrième électron peut être placé dans la première orbitale \(2p\) avec un spin opposé à celui de l’autre électron dans cette orbitale.