Retour à l’écriture des Structures de Lewis pour les Molécules
La structure de squelette d’une molécule covalente peut souvent être déterminée en considérant les valences des atomes constitutifs. Habituellement, l’atome qui forme le plus grand nombre de liaisons se trouve au centre du squelette, où il peut se connecter au nombre maximum d’autres atomes.
Exemple 1 : L’acide hypochloreux a la formule moléculaire HOCl. Dessinez une formule structurelle
.
Solution Il existe plusieurs façons possibles de relier les atomes entre eux
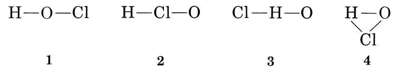
La valence habituelle de H est 1, et donc les structures 3 et 4, qui ont deux liaisons avec H, peuvent être éliminées. La valence habituelle de Cl est également 1, et donc la structure 2 peut également être exclue. La structure 1 montre H formant une liaison, Cl en formant une, et O en formant deux, en accord avec les valences usuelles, et elle est donc choisie.
Le nombre total d’électrons de valence disponibles est 1 de H plus 6 de O plus 7 de Cl, ou 14. Les remplir dans le squelette que nous avons
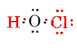
Notez que O, qui avait la plus grande valence, est au centre du squelette.
Exemple 2:
Dessinez une formule structurale pour l’hydroxylamine, NH3O.
Solution Dans ce cas, N a la plus grande valence (3), suivie de O(2) et H(1). N et O peuvent tous deux former des « ponts » entre d’autres atomes, mais H ne le peut pas. Par conséquent, nous plaçons N et O au centre du squelette pour donner
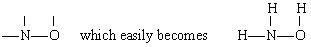
par addition des trois atomes de H.
Il y a un total de 5 + 3 + 6 = 14 électrons de valence de N, 3H et O. Ceux-ci peuvent être placés comme suit:
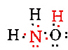
Une fois le diagramme de Lewis déterminé, la formule moléculaire est souvent réécrite pour nous rappeler ce qu’est la formule structurelle. Par exemple, la formule moléculaire de l’hydroxylamine est généralement écrite NH2OH au lieu de NH3O pour nous rappeler que deux H sont liés à N et un à O. On suppose que la personne lisant la formule se rendra compte que N et O ont chacun un électron de valence à partager l’un avec l’autre, reliant —NH2 à —OH. Dans certains cas, plus d’une structure de squelette satisfera la valence de chaque atome et la règle de l’octet. Par exemple, vous pouvez vérifier que la formule moléculaire C2H6O correspond aux deux éléments suivants:
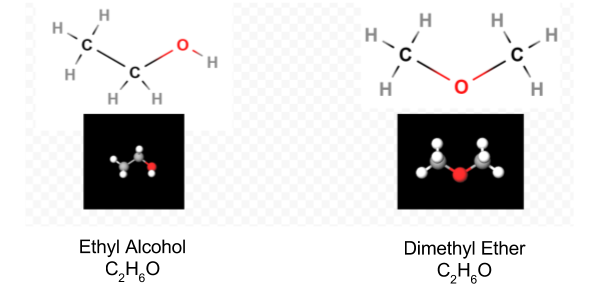
Dans un tel cas, nous ne pouvons décider de la structure moléculaire que nous avons par expérience. Les propriétés de l’alcool éthylique lorsqu’il est dilué avec de l’eau et consommé sont bien connues. L’éther diméthylique est un gaz. Comme l’éther diéthylique utilisé dans les salles d’opération, il est très explosif et peut vous endormir. Deux molécules, telles que l’éther diméthylique et l’alcool éthylique, qui ont la même formule moléculaire mais des formules structurelles différentes sont dites isomères.
Retour à l’écriture des Structures de Lewis pour les molécules
Remerciements:
Les molécules C2H6O et leurs structures squelettiques ont été créées à l’aide de MolView.