Vitesses de réaction
Variation des vitesses lorsque vous changez l’halogène
Les vitesses de réaction augmentent de l’ordre HF-HCl-HBr-HI. Le fluorure d’hydrogène réagit beaucoup plus lentement que les trois autres et est normalement ignoré lorsqu’on parle de ces réactions.
Lorsque les halogénures d’hydrogène réagissent avec les alcènes, la liaison hydrogène-halogène doit être rompue. La force de liaison diminue au fur et à mesure que vous passez de HF à HI, et la liaison hydrogène-fluor est particulièrement forte. Comme il est difficile de rompre la liaison entre l’hydrogène et le fluor, l’addition d’HF est forcément lente.
Variation des taux lorsque vous modifiez l’alcène
Cela s’applique aussi bien aux alcènes asymétriques qu’aux alcènes symétriques. Pour plus de simplicité, les exemples donnés ci-dessous sont tous symétriques – mais ils ne doivent pas nécessairement l’être.
Les vitesses de réaction augmentent à mesure que l’alcène se complique – dans le sens du nombre de groupes alkyle (tels que les groupes méthyle) attachés aux atomes de carbone à chaque extrémité de la double liaison. Par exemple:
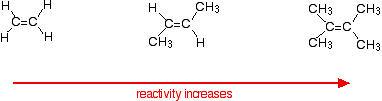
Il y a deux façons d’examiner les raisons de cela – qui ont toutes deux besoin que vous connaissiez le mécanisme des réactions.
Les alcènes réagissent parce que les électrons de la liaison pi attirent les choses avec n’importe quel degré de charge positive. Tout ce qui augmente la densité électronique autour de la double liaison aidera cela.
Les groupes alkyles ont tendance à « pousser » les électrons loin d’eux-mêmes vers la double liaison. Plus vous avez de groupes alkyles, plus la zone autour des doubles liaisons devient négative.
Plus cette région est chargée négativement, plus elle attirera des molécules comme le chlorure d’hydrogène.
La raison la plus importante réside cependant dans la stabilité de l’ion intermédiaire formé au cours de la réaction. Les trois exemples donnés ci-dessus produisent ces carbocations (ions carbonium) à mi-parcours de la réaction:
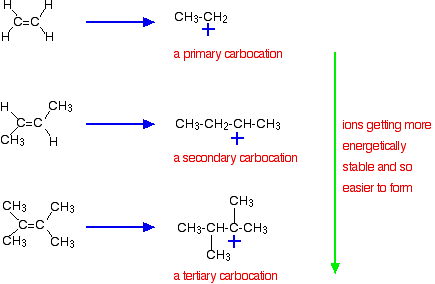
La stabilité des ions intermédiaires régit l’énergie d’activation de la réaction. Au fur et à mesure que vous vous dirigez vers les alcènes plus compliqués, l’énergie d’activation de la réaction diminue. Cela signifie que les réactions deviennent plus rapides.