- Introduction
- Conservation évolutive des canaux potassiques
- Diversité des canaux potassiques à déclenchement en tension
- Applications thérapeutiques potentielles des modulateurs des canaux potassiques
- Structure des canaux potassiques à régulation de tension
- Les channelopathies liées aux canaux potassiques à déclenchement en tension
- Références et notes
Introduction
Les canaux potassiques à déclenchement en tension forment une famille vaste et diversifiée qui est conservée de manière évolutive. Il y a 40 gènes de canaux potassiques à tension contrôlée humains appartenant à 12 sous-familles. Ces canaux KV présentent de larges distributions dans le système nerveux et d’autres tissus. Pour les cellules excitables telles que les neurones, les cardiomyocytes et les muscles, les canaux KV régulent la forme d’onde et le schéma de déclenchement des potentiels d’action. Les canaux KV peuvent également réguler le volume cellulaire, la prolifération et la migration d’un large éventail de types cellulaires.
Les canaux potassiques à régulation de tension (KV) appartiennent à l’une des familles de canaux ioniques les plus grandes et les plus conservées au cours de l’évolution. Chaque canal KV contient quatre sous-unités α formant des pores similaires ou identiques, et il peut également contenir des sous-unités β auxiliaires qui pourraient affecter la fonction et / ou la localisation du canal. Chaque sous-unité de formation de pores de canaux KV contient six segments transmembranaires (S1-S6), les quatre premiers segments transmembranaires (S1-S4) constituant le capteur de tension et les deux derniers segments transmembranaires flanquant une boucle de pores (S5-P-S6) comme domaine de pores. En plus de la localisation chromosomique de chaque gène de canal KV chez l’homme, la souris et le rat, les propriétés physiologiques et pharmacologiques du canal, ainsi que sa distribution tissulaire et sa physiopathologie ont été fournies par la Base de données des canaux ioniques du Sous-Comité des canaux potassiques à déclenchement en tension du Comité de nomenclature de l’Union Internationale de pharmacologie (NC-IUPHAR). Cet article présente une introduction à la diversité et aux fonctions des canaux potassiques à régulation de tension.
Conservation évolutive des canaux potassiques
La sélectivité K+- apparue chez les procaryotes est conservée dans un grand nombre de canaux potassiques d’une diversité remarquable. Comme le montre la figure 1, on peut proposer un arbre évolutif de la superfamille des canaux cationiques à circuit fermé en se basant sur la comparaison des gènes des canaux dans le génome humain avec ceux des génomes d’autres métazoaires, notamment la souris, le poulet, le poisson-globe, le tunicier, la mouche des fruits, le moustique, le nématode et l’anémone de mer. Cet arbre évolutif envisage une origine unique de la sélectivité K+ pour rectifier vers l’intérieur les canaux potassiques (Kir), les canaux potassiques à régulation de tension (KV) et les canaux potassiques à deux pores (K2P). Il est important de noter, cependant, qu’une sélectivité K+ distincte est probablement associée au canal K+ de l’organite conservé au cours de l’évolution qui réside dans les endosomes et les lysosomes.
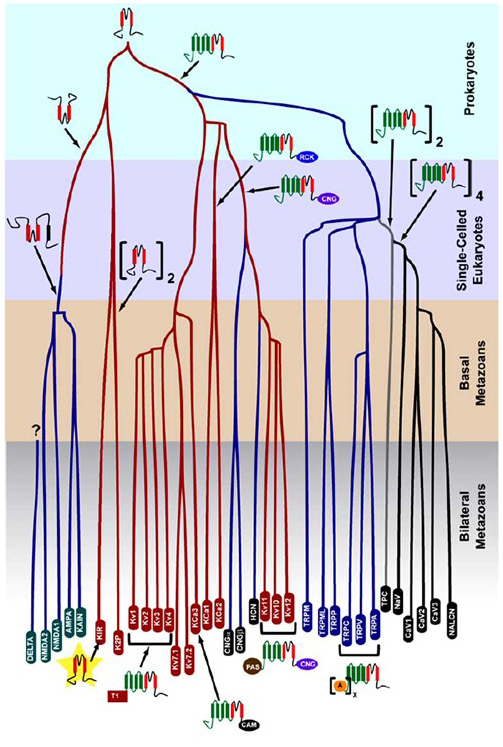
Figure 1. Un arbre évolutif pour la genèse de la superfamille des canaux cationiques à régulation de tension. Basé sur des analyses à l’échelle du génome de canaux ioniques provenant de cnidaires et de métazoaires bilatéraux, cet arbre évolutif décrit une origine commune pour la sélectivité K+ des canaux potassiques (avec des noms de famille en ovales rouges), qui sont liés aux canaux cation cyclique tétramérique à nucléotides (CNG), aux canaux cation à hyperpolarisation (HCN) et aux canaux TRP, aux canaux TPC dimériques et aux canaux monomères Na +, Ca2 + et NALCN. Les longueurs des branches ne reflètent pas le temps. Les noms de famille de gènes en bas marquent les branches individuelles. Les récepteurs ionotropes du glutamate sont inclus sur la base de l’hypothèse qu’ils proviennent d’une inversion du domaine porogène du canal potassique avec deux segments transmembranaires (rouges). Le domaine du capteur de tension comporte quatre segments transmembranaires (vert). A : répétitions d’ankryine ; CAM : domaine de liaison à la calmoduline ; CNG : domaine de liaison aux nucléotides cycliques ; PAS : domaine Per-ARNT-Sim ; RCK : régulateur de conductance du domaine K+ ; T1 : domaine de tétramérisation.
Diversité des canaux potassiques à déclenchement en tension
Le génome humain contient ~80 gènes des canaux potassiques dont 40 gènes codent pour des sous-unités formant des pores des canaux potassiques à déclenchement en tension qui se divisent en 12 sous-familles (Fig. 2). Physiologiquement subdivisés en canaux potassiques de type A qui présentent une inactivation rapide et des canaux potassiques redresseurs retardés sans inactivation rapide, ces canaux KV sont divers sur le plan moléculaire et fonctionnel. Une inactivation rapide, qui peut avoir un impact sur la durée du potentiel d’action lors de tirs répétitifs, est évidente dans les canaux KV1 contenant KV1.4 ou canaux KVß1, KV3 et KV4. Le courant potassique redresseur retardé caractérisé à l’origine par Hodgkin et Huxley pour son rôle dans le potentiel d’action correspond probablement aux canaux KV1 de squid qui peuvent compter sur l’édition d’ARN pour atteindre la diversité fonctionnelle flexible car de nombreux petits axones des neurones à lobes de fibres géantes fusionnent pour former l’axone géant de squid avec un taux de conduction de potentiel d’action plus élevé.
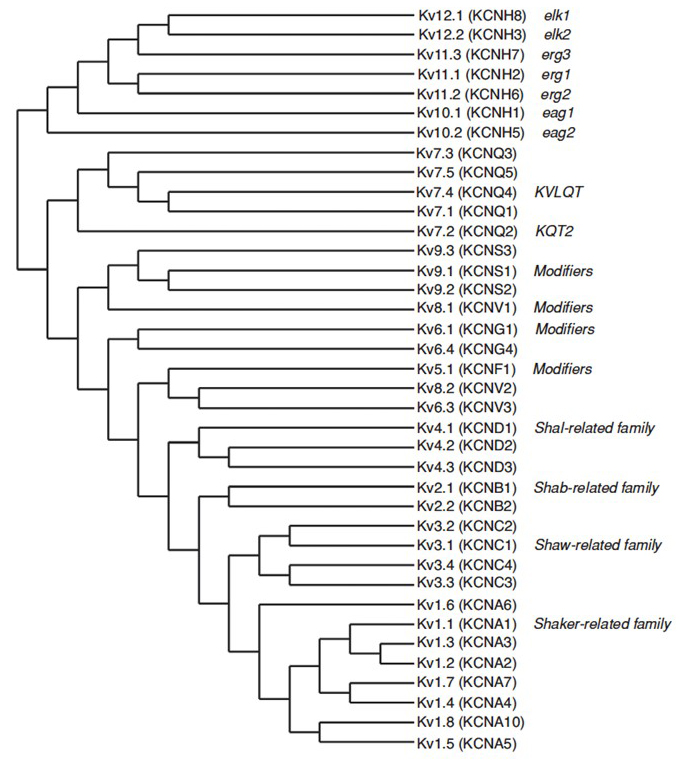
Figure 2. Arbre phylogénétique pour les familles KV1-12. Cet arbre phylogénétique est généré à partir d’analyses du domaine hydrophobe contenant les six segments transmembranaires (S1-S6). Les noms IUPHAR et HGNC (entre parenthèses) sont indiqués, ainsi que d’autres noms couramment utilisés pour ces canaux potassiques à régulation de tension.
Une diversité remarquable de canaux KV peut être obtenue grâce au mélange et à la correspondance des sous-unités de canaux KV. Au sein de chacune des familles KV1, KV2, KV3, KV4 et KV7, des canaux homomères et hétéromères peuvent se former avec une gamme de propriétés fonctionnelles. Les membres de la famille KV2 peuvent également s’assembler avec des membres de la famille KV5, KV6, KV8 ou KV9 ayant des schémas d’expression plus restreints dans le système nerveux et les muscles lisses, comme illustré schématiquement à la Fig. 3.

Figure 3. Diversité des canaux KV par mélange et correspondance de sous-unités de canaux formant des pores. (A) Les canaux KV tétramériques ayant des propriétés et une distribution différentes englobent les canaux homomères KV1, KV2, KV3, KV4 et KV7, les canaux hétéromères formés par différents membres au sein de chacune de ces familles de canaux KV, et les canaux hétéromères formés par assemblage de membres de la famille KV2 avec des membres de la famille KV5, KV6, KV8 ou KV9. Les familles KV5, KV6, KV8 et KV9 donnent naissance à des canaux homomères silencieux électriquement probablement en raison de leur rétention dans le réticulum endoplasmique, ils sont donc appelés KVS. (B) L’assemblage des membres de la famille KV2 et KVS implique leurs domaines cytoplasmiques N et C terminaux. (C, D) L’assemblage des membres de la famille KV2 et KVS donne naissance à des canaux hétéromères avec une dépendance en tension (C) et des mécanismes de déclenchement (D) différents par rapport aux canaux homomères formés par les membres de la famille KV2.
Les différences fonctionnelles dans la dépendance en tension et la cinétique des canaux KV sous-tendent leurs contributions différentielles à la modulation du potentiel d’action (Fig. 4). Alors que les canaux KV1, KV4 et KV7 nécessitent de faibles niveaux de dépolarisation membranaire pour leur activation, les canaux KV2 et KV3 sont activés par une plus grande dépolarisation. Les premiers canaux KV activés à basse tension peuvent affecter le seuil de génération de potentiel d’action et le nombre de potentiels d’action générés lors de la dépolarisation ou des potentiels synaptiques excitateurs. En revanche, les canaux KV activés à haute tension peuvent moduler la durée du potentiel d’action et le schéma de tir. La cinétique des canaux KV influence également la manière dont ils contribuent à la génération de potentiel d’action. Alors que les canaux KV1 activés à basse tension avec activation rapide peuvent affecter le seuil de potentiel d’action et la forme d’onde, les canaux KV3 activés à haute tension et les canaux KV2 peuvent être activés séquentiellement pendant un potentiel d’action en raison de la différence de leur cinétique d’activation, et les canaux KV2 peuvent avoir des effets plus durables en raison de leur cinétique d’inactivation lente. De plus, les canaux KV4 à inactivation rapide pourraient contribuer à la différence de forme d’onde de potentiel d’action lors de tirs répétitifs, en raison de la suppression de l’activité du canal KV4 par dépolarisation.
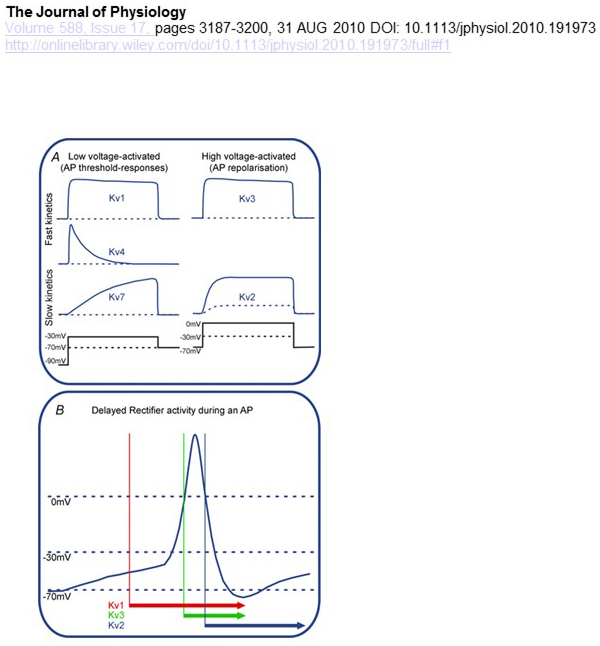
Figure 4. Différences fonctionnelles des canaux KV et leurs contributions au potentiel d’action. (A) Différents canaux KV ont une dépendance de tension différente pour l’activation et une cinétique différente. (B) Les canaux KV1 activés à basse tension avec une cinétique rapide s’ouvrent lorsque la cellule est dépolarisée vers le seuil de génération de potentiel d’action. Alors que les canaux KV2 et KV3 sont activés à haute tension, les canaux KV3 s’ouvrent plus tôt que les canaux KV2 pendant un potentiel d’action. Les canaux KV2 peuvent également prendre plus de temps à se fermer suite à un potentiel d’action.
Applications thérapeutiques potentielles des modulateurs des canaux potassiques
La capacité des modulateurs des canaux potassiques à modifier les schémas de mise à feu potentiels d’action a soulevé la question de savoir s’ils pourraient avoir une valeur thérapeutique. Comme indiqué à la Fig. 5, divers troubles neurologiques et psychologiques peuvent impliquer des altérations des schémas de tir potentiels d’action, qui pourraient être modulés par des activateurs et des bloqueurs de canaux KV. Les canaux potassiques à régulation de tension peuvent également jouer un rôle dans la prolifération et la migration des cellules; Des modulateurs de canaux KV ont donc été envisagés pour des traitements potentiels de la croissance du cancer et des métastases. Sur la Fig. 6, la structure de canal KV1.2 est utilisée schématiquement pour illustrer que les modulateurs de canal KV peuvent inhiber l’activité du canal soit en occultant la voie de perméation du canal, comme dans le cas des toxines bloquant les pores externes et des bloqueurs des pores internes, soit par leur interaction avec le capteur de tension pour stabiliser l’état fermé du canal, comme dans le cas des toxines modificatrices de déclenchement. Alternativement, certaines petites molécules agissent en se liant à la machinerie de déclenchement en tant que modificateurs de déclenchement, ou en interagissant avec l’interface entre les sous-unités α et β pour modifier l’activité du canal.
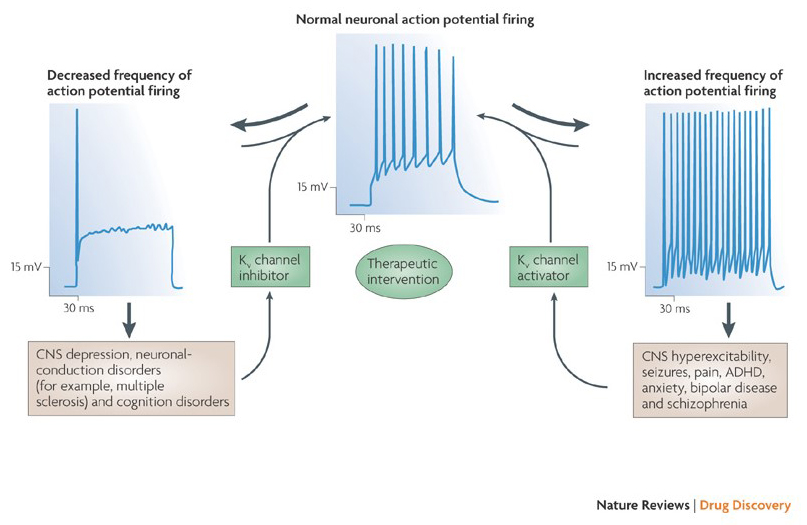
Figure 5. Applications potentielles des modulateurs de canaux KV. Étant donné que des schémas de déclenchement potentiels d’action anormaux ont été associés à des maladies telles que l’épilepsie et la sclérose en plaques, des activateurs et des inhibiteurs du canal KV ont été envisagés pour des traitements thérapeutiques potentiels de maladies impliquant une altération de l’excitabilité neuronale.
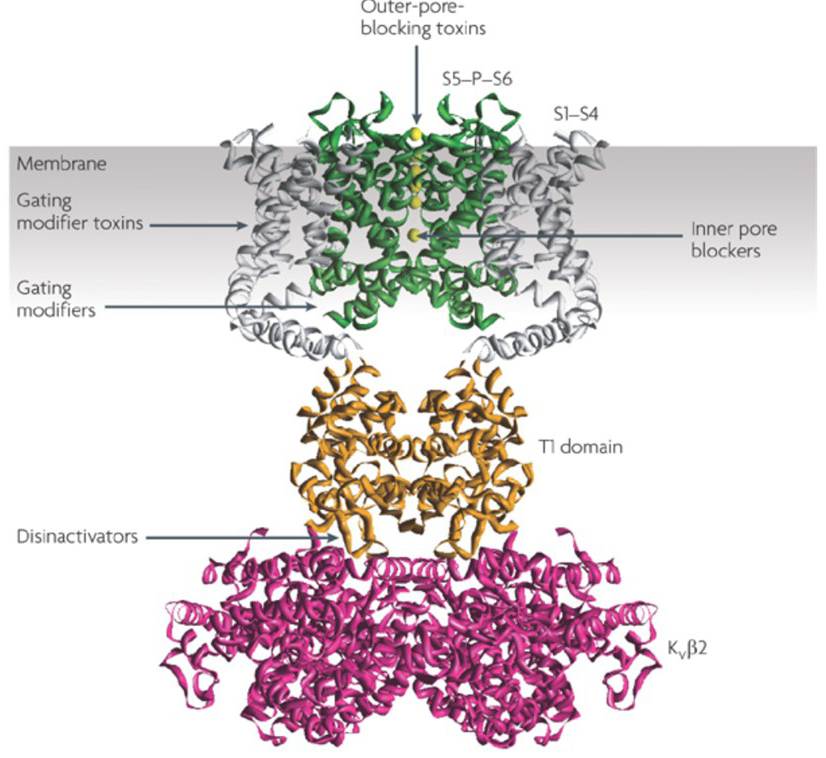
Figure 6. Exemples de modes d’action des modulateurs de canaux KV. Il existe plusieurs façons différentes pour les toxines peptidiques et les petites molécules de moduler l’activité du canal KV. La structure KV1.2 est représentée avec les domaines des pores (S5-P-S6) en vert, les domaines des capteurs de tension (S1-S4) en gris, les domaines de tétramérisation T1 en orange et les sous-unités auxiliaires KVß2 en magenta. Les toxines bloquant les pores externes des scorpions, des anémones de mer, des serpents et des escargots coniques peuvent se lier au vestibule externe et bloquer la perméation ionique. Les toxines modificatrices de déclenchement provenant d’araignées telles que l’hanatoxine peuvent interagir avec le capteur de tension pour augmenter la stabilité de l’état fermé, provoquant un décalage vers la droite de la courbe de dépendance de tension pour l’activation du canal. Il existe également de petits modulateurs de canaux moléculaires qui se lient au pore interne (bloqueurs des pores internes), aux charnières de déclenchement (modificateurs de déclenchement) ou à l’interface entre les sous-unités α et β (désactivateurs).
Structure des canaux potassiques à régulation de tension
La sélectivité remarquable des canaux potassiques, qui permet aux ions K+ de traverser le pore du canal avec des ordres de grandeur plus faciles que les ions Na+ plus petits et avec un taux de diffusion presque limité, est expliquée par la capacité des carbonyles dorsaux du filtre à sélectivité à coordonner les ions K+ qui sont en grande partie dépourvus de leur enveloppe d’hydratation, de sorte que plus d’un ion K + se déplacera à travers ce segment le plus étroit du pore en tandem (Fig. 7) – un long pore pour une perméation d’ions K+ à un seul fichier comme prévu.
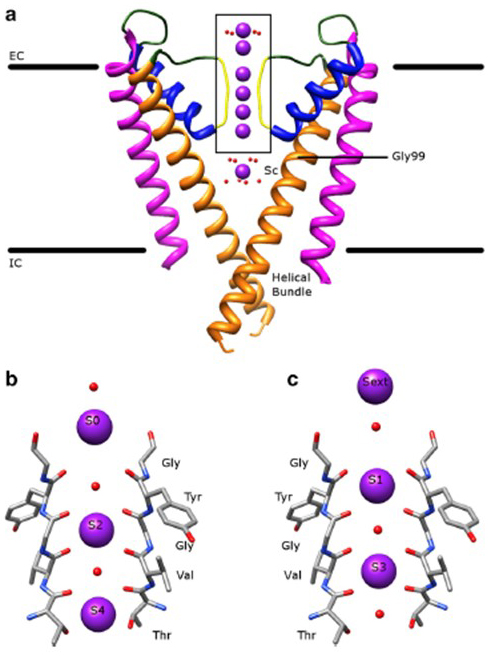
Figure 7. Le domaine des pores des canaux potassiques. (a) Structure du KcsA à l’état conducteur (PDB: 1K4C), avec les hélices extérieures en magenta, les hélices intérieures en orange, les hélices des pores en bleu et le filtre de sélectivité en jaune. Les ions K+ sont en violet tandis que les molécules d’eau environnantes sont en rouge. EC : extracellulaire; IC : intracellulaire. (b, c) Le filtre de sélectivité dans la région encadrée de la structure KcsA est représenté avec des ions K+ occupant soit les positions S2 et S4 (b), soit les positions S1 et S3 (c), pour illustrer la perméation des ions K+ en fichier unique.
La dépendance en tension de l’activation des canaux KV dérive de leurs domaines de capteurs de tension. Comme le montre la Fig. Les canaux 8, KV et les canaux associés tels que les canaux sodiques à régulation de tension et les canaux TRPV1 de la même superfamille ont des dispositions similaires de leurs domaines de pores et de leurs domaines de capteurs de tension. Le domaine de capteur de tension d’une sous-unité interagit avec le domaine de pores d’une sous-unité voisine dans une configuration d’échange de domaine, et à l’intérieur d’un capteur de tension, les résidus d’arginine chargés positivement sur S4 peuvent interagir avec des résidus acides chargés négativement dans des hélices voisines (Fig. 9).
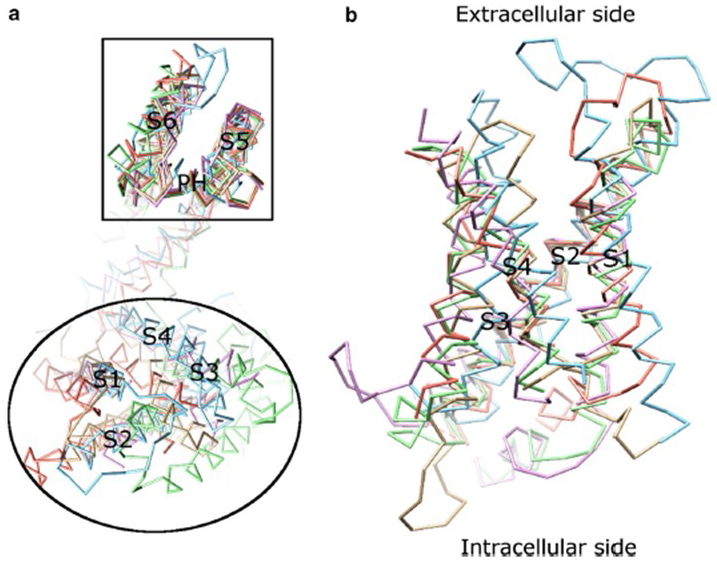
Figure 8. Le domaine du capteur de tension des canaux potassiques à régulation de tension. (a) L’alignement du domaine des pores (S5-P-S6) de différents canaux ioniques révèle que leurs domaines capteurs de tension (S1-S4) peuvent prendre diverses orientations (vues du côté extracellulaire). (b) Superposition du domaine du capteur de tension de KV1.2 (PDB: 3LUT, magenta clair) avec les domaines du capteur de tension de MlotiK1 (PDB: 3BEH, brun clair), NaVAb (PDB : 3RVY, vert clair), NaVRh (PDB : 4DXW, orange clair) et TRPV1 (PDB : 3J5P, bleu clair) (vu de la membrane).
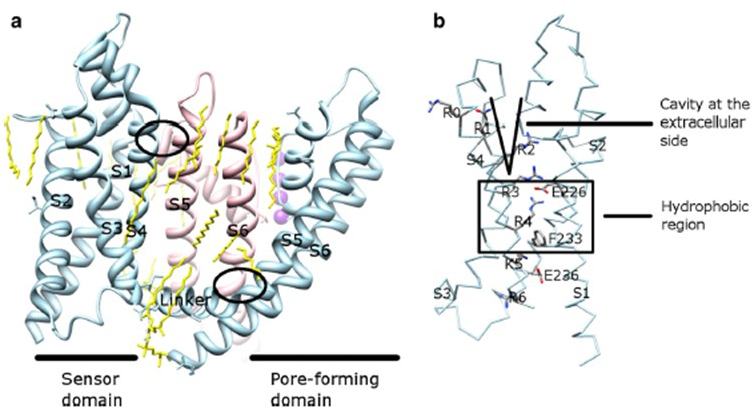
Figure 9. Contacts entre le domaine des pores et le domaine du capteur de tension des canaux KV. (a) La chimère KV1.2-KV2.1 (PDB: 2R9R) avec le domaine du capteur de tension d’une sous-unité (bleu clair) en contact avec le domaine des pores d’une sous-unité voisine (rose). Les contacts du côté intracellulaire impliquent l’interaction du lieur S4-S5 avec S6, et les contacts du côté extracellulaire impliquent l’interaction entre S1 et l’hélice de pores. Les lipides (jaunes) entourant le canal et entre le domaine des pores et le domaine du capteur de tension sont détectables dans la structure cristalline. b) Résidus basiques de S4 et résidus acides à leur proximité dans le domaine du capteur de tension.
Les channelopathies liées aux canaux potassiques à déclenchement en tension
Les canaux potassiques à déclenchement en tension sont largement exprimés dans une variété de tissus. Dans les neurones, ils sont ciblés sur divers compartiments subcellulaires (Fig. 10), et des canaux de différentes compositions de sous-unités peuvent être présents dans différentes sous-populations de neurones. Les mutations des gènes du canal KV peuvent provoquer des maladies neurologiques telles que l’ataxie épisodique et les épilepsies, les maladies cardiaques et la surdité. La conservation évolutive de la fonction du canal KV est évidente, par exemple, à partir des troubles du mouvement similaires causés par la mutation des orthologues KV1 chez l’homme, la souris et la mouche des fruits.
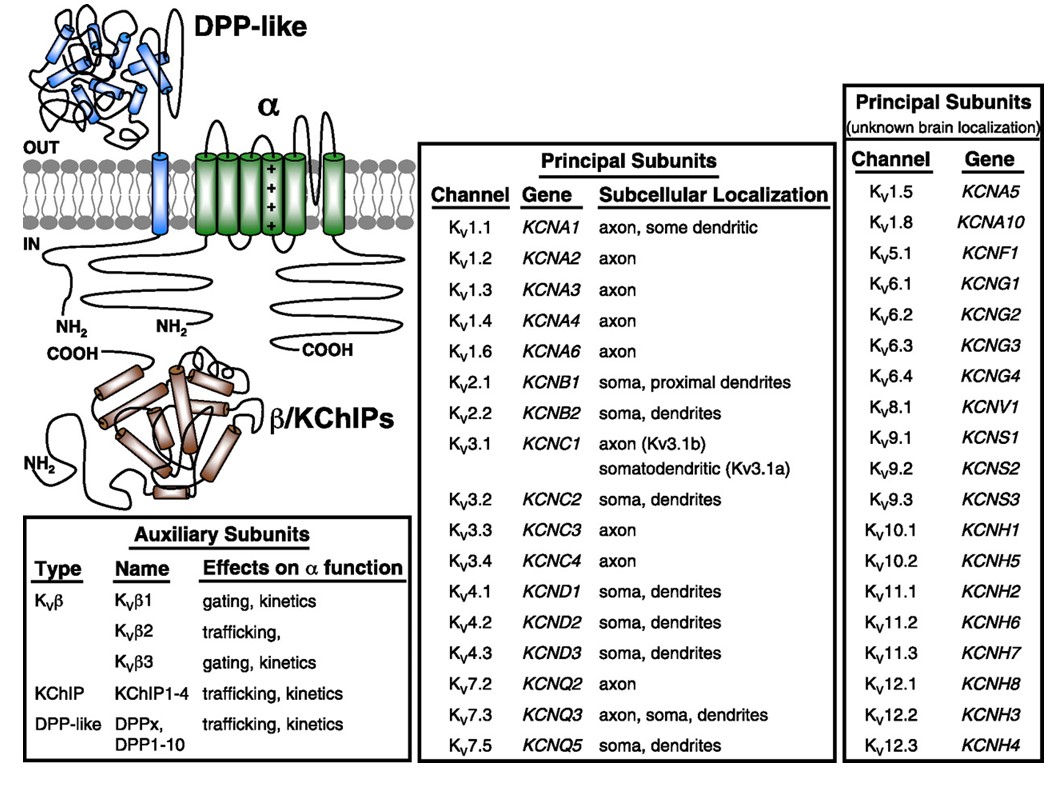
Figure 10. Distribution subcellulaire des canaux potassiques à régulation de tension. Le schéma en haut à gauche représente un canal KV4 avec deux sous-unités auxiliaires différentes. La localisation subcellulaire de divers canaux KV dans les neurones centraux des mammifères est indiquée dans la boîte du milieu.
Références et notes
1.Hille, B., Canaux ioniques des membranes Excitables, 3e édition, Éd. 2001 : Sinauer Associates Inc.
2.Gonzalez, C., et coll., K (+) canaux: fonction – aperçu structurel. Compr Physiol, 2012. 2(3): p. 2087-149.
3.Vacher, H., D.P. Mohapatra et J.S. Trimmer, Localisation et ciblage des canaux ioniques dépendants de la tension dans les neurones centraux des mammifères. Physiol Rev, 2008. 88(4): p. 1407-47.
4.Jegla, T.J., et coll., Évolution de l’ensemble des canaux ioniques humains. Écran à haut débit Comb Chem, 2009. 12(1): p. 2 à 23.
5.Cang, C., et coll., TMEM175 Est un Canal Organelle K (+) Régulant la Fonction Lysosomale. Cellule, 2015. 162(5): p. 1101-12.
6.Hodgkin, A.L. et A.F. Huxley, Courants portés par les ions sodium et potassium à travers la membrane de l’axone géant de Loligo. J. Physiol, 1952. 116(4): p. 449-72.
7.Rosenthal, J.J., T.I. Liu et W.F. Gilly, Une famille d’ADNC de redresseur retardé KV1 montrant une expression spécifique au type cellulaire dans le complexe ganglion stellaire de squid / lobe de fibre géante. J Neurosci, 1997. 17(13): p. 5070-9.
8.Jeunes, J.Z., Neurones fusionnés et contacts synaptiques dans les fibres nerveuses géantes des céphalopodes. Phil Trans R Soc Lond B, 1939. 229: p. 465-503.
9.Rosenthal, J.J. et F. Bezanilla, Édition extensive des ARNM pour le canal K+ du redresseur retardé squid régule la tétramérisation des sous-unités. Neurone, 2002. 34(5): p. 743-57.
10.Jan, L.Y. et Y.N. Jan, Canaux potassiques à régulation de tension et diversité de la signalisation électrique. J Physiol, 2012. 590 (11): p. 2591-9.
11.Johnston, J., I.D. Forsythe et C. Kopp-Scheinpflug, Going native: canaux potassiques à régulation de tension contrôlant l’excitabilité neuronale. J Physiol, 2010. 588 (Pt 17): p. 3187-200.
12.Sous-unités Bockstein, E., KV5, KV6, KV8 et KV9: Pas de simples spectateurs silencieux. J Gen Physiol, 2016. 147(2): p. 105-25.
13.Wulff, H., N.A. Castle, et L.A. Pardo, Canaux potassiques à régulation de tension comme cibles thérapeutiques. Nat Rev Drug Discov, 2009. 8 (12): p. 982-1001.
14.Bates, E., Canaux ioniques dans le développement et le cancer. Annu Rev Cell Dev Biol, 2015. 31: p. 231-47.
15.Huang, X. et L.Y. Jan, Ciblant les canaux potassiques dans le cancer. J Cell Biol, 2014. 206(2): p. 151-62.
16.Huang, X., et coll., canal potassique EAG2 avec une fonction conservée de manière évolutive en tant que cible de tumeur cérébrale. Nat Neurosci, 2015. 18(9): p. 1236-46.
17.Kunzelmann, K., Canaux ioniques et cancer. J Membre Biol, 2005. 205(3): p. 159-73.
18.Li , M. et Z.G. Xiong, canaux ioniques comme cibles pour le traitement du cancer. Int J Physiol Pathophysiol Pharmacol, 2011. 3(2): p. 156-66.
19.Pardo, L.A., Canaux potassiques à régulation de tension dans la prolifération cellulaire. Physiologie (Bethesda), 2004. 19: p. 285-92.
20.Urrego, D., et coll., Canaux potassiques dans le cycle cellulaire et la prolifération cellulaire. Philos Trans R Soc Lond B Biol Sci, 2014. 369 (1638): p. 20130094.
21.Zhou, Y., et coll., Chimie de la coordination et de l’hydratation des ions révélée par un complexe canal K+-Fab à une résolution de 2,0 A. Nature, 2001. 414 (6859): p. 43-8.
22.MacKinnon, R., Canaux potassiques. FEBS Lett, 2003. 555(1): p. 62-5.
23.Kuang, Q., P. Purhonen et H. Hebert, Structure des canaux potassiques. Cell Mol Life Sci, 2015. 72 (19): p. 3677-93.
24.Isacoff, E.Y., L.Y. Jan, et D.L. Minor, Jr., Conduits de l’étincelle de la vie: une perspective sur la recherche sur les canaux ioniques depuis la naissance du neurone. Neurone, 2013. 80(3): p. 658-74.
25.Swartz, K.J., Sensing voltage across lipid membranes. Nature, 2008. 456 (7224): p. 891-7.
26.Nusser, Z., Distribution subcellulaire différentielle des canaux ioniques et diversité de la fonction neuronale. Curr Opin Neurobiol, 2012. 22(3): p. 366-71.
27.Lujan, R., Organisation des canaux potassiques sur la surface neuronale. J Chem Neuroanat, 2010. 40(1): p. 1-20.
28.Abriel, H. et E.V. Zaklyazminskaya, Canal cardiaqueles pathologies: mécanismes génétiques et moléculaires. Gene, 2013. 517(1): p. 1-11.
29.Kullmann, D.M. et M.G. Hanna, Troubles neurologiques causés par des mutations héréditaires des canaux ioniques. Lancet Neurol, 2002. 1(3): p. 157-66.
30.Lehmann-Horn, F. et K. Jurkat-Rott, Canaux ioniques à régulation de tension et maladies héréditaires. Physiol Rev, 1999. 79(4): p. 1317-72.
31.Villa, C. et R. Combi, Canaux Potassiques et Phénotypes Épileptiques Humains: Un Aperçu mis à jour. Neurosci des cellules avant, 2016. 10: p. 81.
32.Long, S.B., E.B. Campbell et R. Mackinnon, Structure cristalline d’un canal K+ de la famille des agitateurs dépendants de la tension chez les mammifères. Science, 2005. 309 (5736): p. 897-903.
33.Chen, X., et coll., Structure du canal potassique KV1.2 de l’agitateur sur toute la longueur par affinement cristallographique aux rayons X en mode normal. Proc Natl Acad Sci U S A, 2010. 107(25): p. 11352-7.
34.Clayton, G.M., et coll., Structure des régions transmembranaires d’un canal régulé par des nucléotides cycliques bactériens. Proc Natl Acad Sci U S A, 2008. 105(5): p. 1511-5.
35.Payandeh, J., et coll., La structure cristalline d’un canal sodique à régulation de tension. Nature, 2011. 475 (7356): p. 353-8.
36.Zhang, X., et coll., Structure cristalline d’un orthologue du canal sodique à chaîne de tension NaChBac. Nature, 2012. 486 (7401): p. 130-4.
37.Liao, M., et coll., Structure du canal ionique TRPV1 déterminée par cryo-microscopie électronique. Nature, 2013. 504 (7478): p. 107-12.
38.Long, S.B., et coll., Structure atomique d’un canal K+ dépendant de la tension dans un environnement semblable à une membrane lipidique. Nature, 2007. 450 (7168): p. 376-82.