Un Syndrome de Mascarade
Shalini Johnson, MD, Jeffrey Nerad, MD, Nasreen Syed, MD
23 janvier 2006
Plainte principale: Diminution de l’acuité visuelle et sensation de corps étranger dans l’œil droit au cours des derniers mois.
Antécédents de maladie actuelle: Le patient est un homme de 67 ans qui présente une lésion conjonctivale pigmentée dans sa paupière supérieure droite. Il l’a d’abord remarqué il y a 1 an, mais était asymptomatique jusqu’à il y a 6 mois lorsqu’il a commencé à ressentir une diminution de l’acuité visuelle et une sensation de corps étranger dans cet œil. Il a d’abord pensé que ses symptômes étaient dus à la sécheresse oculaire.
Antécédents oculaires : Il porte des lunettes, mais n’a pas d’autres antécédents oculaires.
Antécédents médicaux: Il souffre de plusieurs affections chroniques, notamment d’hypertension, de maladie coronarienne, d’hypercholestérolémie, de reflux gastro-œsophagien, de migraines, de maladies articulaires dégénératives et d’appareils auditifs bilatéraux.
Médicaments: Fosinopril, oméprazole, aspirine pour bébé et sertraline
Allergies: Bêta-bloquants et atorvastatine
Antécédents familiaux: Il a un cousin atteint d’un mélanome cutané
Antécédents sociaux: Non-fumeur
Examen physique:
- Général: Pas de détresse aiguë
- Acuité visuelle, avec correction: Œil droit (DO)–20/40-1; Œil gauche (OS)–20/20
- Motilité extraoculaire: Pleine, les deux yeux (OU)
- Pupilles: également réactives sans défaut pupillaire afférent relatif (RAPD)
- Examen du segment externe et antérieur:
- Fissures palpébrales: 11 / 11mm
- Distance réflexe marginale 1 (MRD1): 4/4 mm
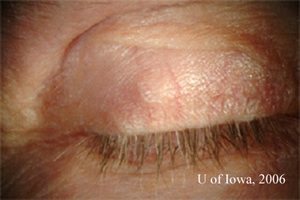
- Lésion érythémateuse élevée dans le tarse de la paupière droite et faisant saillie à travers la conjonctive palpébrale supérieure de la paupière droite (voir Figure 1)
- Examen du fond d’œil dilaté (DFE): Pas de pâleur ni d’œdème de l’un ou l’autre des disques. Macula, vaisseaux et périphérie normaux, OU
| 1A : L’examen externe révèle une masse à l’intérieur de la paupière supérieure droite. |
1B: L’éversion de la paupière supérieure droite révèle une masse sous-conjonctivale élevée, vasculaire et pigmentée |
 |
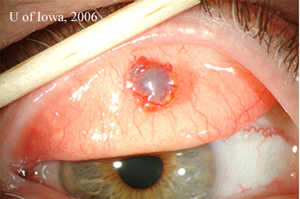 |
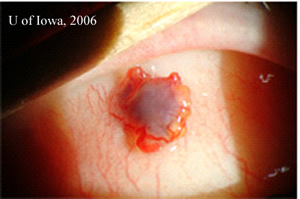
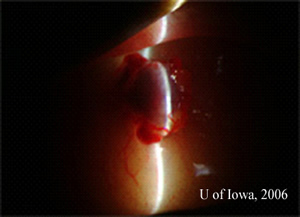
| 2A: Des vues supplémentaires de lampes à fente dans des conditions d’éclairage tangentiel révèlent la nature élevée de la masse sous-conjonctivale pigmentée | 2B: Vue à faisceau fendu |
 |
 |
Cours: Le patient a subi une biopsie excisionnelle qui a révélé un diagnostic de carcinome à Cellules sébacées peu différencié en histopathologie. Il a ensuite subi des biopsies maps et une biopsie du coin de la paupière supérieure droite qui ont montré des glandes Méibomiennes atypiques compatibles avec un carcinome à cellules sébacées. Il a eu une résection finale en coin qui n’a montré aucun carcinome à cellules sébacées résiduelles. Les résultats histopathologiques sont démontrés dans les photomicrographies suivantes.
| 3 BIS: La section colorée H &E (50x) de la biopsie excisionnelle initiale montre le modèle de comédon d’un carcinome à cellules sébacées peu différencié | 3B: Un grossissement plus élevé de la même section colorée H &E (200X) montre des figures mitotiques (flèches blanches) et des corps apoptotiques (flèches noires) au sein de la lésion de carcinome à cellules sébacées peu différenciée |
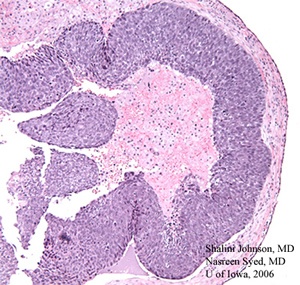 |
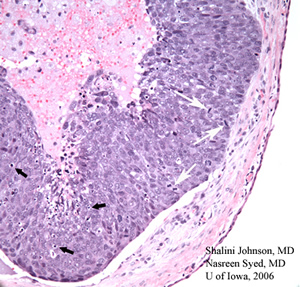 |
| 4A: La section colorée H&E du premier échantillon de coin de paupière révèle un carcinome à cellules sébacées dans le champ inférieur de cette photomicrographe avec des cellules sébacées sombres et pléomorphes atypiques (flèches noires). Celles-ci contrastent nettement avec les glandes sébacées mousseuses normales (flèches blanches) observées dans le champ supérieur de ce photomicrographe. | 4B: H &E la section tachée du deuxième échantillon de coin de paupière ne montre aucun carcinome à cellules sébacées résiduelles et montre des glandes sébacées normales (glandes de Meibomian) disposées verticalement et drainant dans un canal de Meibomian commun. |
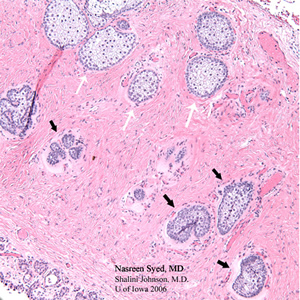 |
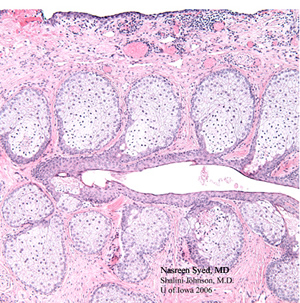 |
Discussion: Bien que les glandes sébacées se trouvent dans tout le corps, le carcinome à cellules sébacées se trouve le plus souvent dans la région oculaire, qui représente 75% des cas. La glande parotide est le site le plus fréquent en dehors de la région oculaire, représentant environ 20% des cas. Il y a cinq zones dans la région périorbitale qui contiennent des cellules sébacées:
- glandes sébacées régulières associées aux unités pilosébacées de la peau du visage et des paupières,
- Glandes de Meibomiennes situées en profondeur dans le tarse qui sécrètent le constituant externe huileux du film lacrymal
- les glandes de Zeiss qui nourrissent les follicules pileux des cils avec des sécrétions huileuses
- les unités pilosébacées des poils des sourcils et
- les glandes sébacées dans la caroncule.
Le carcinome à cellules sébacées peut provenir de l’un de ces types de glandes sébacées. Cependant, classiquement, il provient des glandes de Meibomian de la plaque tarsienne et des paupières supérieures, ce qui représente environ 2/3 des cas. Plus rarement, on le trouve dans les glandes de Zeiss et les paupières inférieures. Il est rare de trouver la lésion dans la caroncule ou le sourcil et très rare de la trouver dans la glande lacrymale, ce qui ne représente qu’une poignée de cas peu différenciés.
En général, le carcinome à cellules sébacées est plus fréquent chez les femmes que chez les hommes et touche une population plus âgée, généralement entre la 6e et la 7e décennie de vie. S’il se présente chez des individus plus jeunes (< 40 ans), il existe généralement des antécédents de radiation pour un hémangiome caverneux, un rétinoblastome ou d’autres lésions. Dans l’ensemble, le carcinome à cellules sébacées est une tumeur peu commune aux États-Unis et ne représente que 0,2 à 0,7% de toutes les tumeurs des paupières et 5% de toutes les tumeurs malignes des paupières. Il s’agit donc de la deuxième tumeur maligne des paupières la plus fréquente après le carcinome basocellulaire, qui représente une plus grande partie (90%) de toutes les tumeurs malignes des paupières. Fait intéressant, il y a une incidence accrue en Chine et en Inde, où elle est également la deuxième tumeur maligne des paupières la plus fréquente, mais représente environ 1/3 de toutes les tumeurs malignes des paupières (Ni et associés, 1982, Abdi et al., 1996).
Bien que le carcinome à cellules sébacées soit l’une des lésions les plus malignes des paupières, il peut être difficile à diagnostiquer. Ceci est démontré par le fait que le délai moyen entre la présentation et le diagnostic varie de un à trois ans. La raison de cette difficulté dans le diagnostic est due à sa présentation variée à la fois cliniquement et histopathologiquement. Il a tendance à se faire passer pour des affections bénignes plus courantes, imitant d’autres tumeurs ainsi que des affections inflammatoires. Par conséquent, le carcinome à cellules sébacées est connu pour masquer d’autres conoditions. Il est donc important d’inclure le carcinome des glandes sébacées dans le diagnostic différentiel de la plupart des masses des paupières et des affections inflammatoires récurrentes.
La présentation clinique peut varier sur un large spectre. La présentation la plus courante est un petit nodule caoutchouteux et ferme qui ressemble à un chalazion. Ceci est compliqué par le fait qu’il existe parfois une véritable formation de chalazion secondaire à l’obstruction des conduits de Meibomian par une masse. La masse peut être de couleur jaune en raison de sa teneur en lipides, d’autant plus qu’elle empiète sur la surface épidermique. La masse peut également être papillomateuse. Plus rarement, il se présente comme un épaississement tarsien diffus avec des signes associés de mauvaise direction des cils et de madarose. Les cils tombent en raison de l’invasion des follicules pileux des cils. La caroncule est un emplacement inhabituel pour cette tumeur, mais elle se présente ici sous la forme d’une masse sous-conjonctivale gris-jaune à lobules multiples recouverte d’épithélium. Lorsqu’elles proviennent des glandes de Zeis, les lésions forment de petits nodules jaunes devant la ligne grise, ce qui entraîne à son tour l’entropion de la paupière. En plus de se présenter sous forme de masses diverses, le carcinome à cellules sébacées se présente également sous forme de diverses conditions inflammatoires. Cela résulte de la propagation intraépithéliale typique de cette lésion. La propagation pagétoïde, caractéristique du carcinome des glandes sébacées, se produit lorsque des cellules tumorales individuelles migrent jusqu’à la surface épithéliale et forment des lésions inégales et sautantes séparées de la masse tumorale d’origine. Cela provoque une irritation et conduit à des présentations inflammatoires telles que la blépharoconjonctivite ou la kératoconjonctivite. Ces présentations inflammatoires peuvent être associées à des ulcérations et à des croûtes et peuvent être présentes pendant des mois, voire des années, avant qu’une masse ne soit cliniquement apparente. En plus de se présenter comme d’autres entités pathologiques, le carcinome à cellules sébacées peut également se présenter comme d’autres tumeurs. Il peut se présenter sous la forme d’un nodule ombilical gris-blanc simulant un carcinome basocellulaire, sous la forme d’une lésion kératinisante pédonculée simulant une corne cutanée ou sous la forme d’une masse dans la fosse lacrymale simulant une tumeur de la glande lacrymale.
Une autre partie de la présentation clinique est le syndrome de Muir-Torre, qui comprend l’association de tumeurs des glandes sébacées ou de kératoacanthomes avec le développement de tumeurs malignes primaires distantes coexistantes, le plus souvent un carcinome du côlon (47%) suivi de tumeurs malignes génito-urinaires (21%) et d’autres. Ce syndrome se développe chez 25 à 59% des patients, plus souvent chez les hommes que chez les femmes (2: 1) et est étonnamment plus fréquemment associé aux variantes bénignes des tumeurs sébacées. Il existe des antécédents familiaux dans 70% des cas de syndrome de Muir-Torre qui sont associés à une mutation des gènes de réparation de l’inadéquation de l’ADN des chromosomes 2p et 3p. La transmission est très probablement autosomique dominante.
Semblable à sa présentation clinique variée, le carcinome à cellules sébacées peut également imiter d’autres processus pathologiques histopathologiquement. Le carcinome sébacé peut avoir des zones focales de différenciation squameuse et est donc couramment confondu avec le carcinome épidermoïde. En fait, 50% des carcinomes à cellules sébacées sont diagnostiqués à tort comme un carcinome épidermoïde. D’autre part, le carcinome basocellulaire peut avoir des zones de différenciation sébacée. Le carcinome mucoépidermoïde a des cellules mucineuses claires qui ressemblent à des cellules sébacées. Le mélanome peut également simuler un carcinome à cellules sébacées, car un mélanome préalablement excisé peut se reproduire sous forme de lésion non pigmentée de la conjonctive ou de la cornée.
En termes de pathologie, il existe différentes classifications pour le carcinome à cellules sébacées. Une classification implique le degré de différenciation. La lésion bien différenciée montre un degré élevé de différenciation sébacée, en particulier au centre de la lésion. La lésion modérément différenciée ne montre que quelques plaques de différenciation sébacée et la variante peu différenciée montre des cellules avec peu de cytoplasme et des noyaux pléomorphes proéminents. Une autre classification est basée sur le modèle de croissance, qui n’a aucune signification pronostique. Le motif lobulaire a des lobules bien délimités de taille variable et présente des caractéristiques basaloïdes. Le modèle de comédocarcinome, qui est observé dans les tumeurs à croissance rapide, présente de grands lobules avec des zones de nécrose centrale bien visibles. Le motif papillaire, généralement observé dans la conjonctive, présente des frondes papillaires qui ressemblent à un carcinome ou à un papillome épidermoïde et le motif mixte est une combinaison de l’un des trois motifs ci-dessus. La classification finale se rapporte à la capacité infiltrante et est divisée en lésions peu infiltrantes par rapport aux lésions hautement infiltrantes.
Une caractéristique du carcinome à cellules sébacées est la façon dont il s’infiltre. La propagation intraépithéliale ou la propagation pagétoïde est rapportée dans 44 à 80% des cas. La propagation pagétoïde est l’infiltration de cellules tumorales simples ou de nids de cellules tumorales dans l’épithélium sus-jacent. Lorsque cette infiltration devient confluente, on parle de changement bowénoïde. Le carcinome à cellules sébacées peut également se propager par extension directe dans des structures adjacentes telles que la cavité intracrânienne, l’orbite et les sinus paranasaux. Celles-ci ne sont pas considérées comme des métastases car il n’y a pas de drainage lymphatique des paupières vers ces structures. Cependant, les paupières ont un drainage lymphatique vers les ganglions lymphatiques intraparotides, préauriculaires et sous-maxillaires, qui sont tous des sites potentiels de métastases régionales (30%). Les métastases à distance sont possibles, mais rares et les organes impliqués comprennent le foie, les poumons, le cerveau et les os.
Étant donné que la présentation du carcinome à cellules sébacées est si variée, le diagnostic différentiel est large, y compris de nombreux processus pathologiques distincts. Cliniquement, le diagnostic différentiel comprend le chalazion, la kératoconjonctivite ou la blépharoconjonctivite et d’autres tumeurs des glandes sudoripares. Histopathologiquement, le diagnostic différentiel comprend le carcinome épidermoïde, le carcinome basocellulaire, le carcinome mucoépidermoïde et le mélanome.
La caractéristique masquée du carcinome sébacé en fait un diagnostic difficile. La fréquence des impressions cliniques erronées est restée inchangée au cours des dernières décennies. Il est donc extrêmement important de maintenir une suspicion clinique élevée. Il y a quelques indices dans l’histoire et physique qui aident à éveiller les soupçons cliniques. Un chalazion qui se présente tard dans la vie sans histoire préalable ou un chalazion récurrent est assez suggestif. Une enquête plus approfondie est également justifiée pour les présentations inflammatoires telles que la blépharite ou la kératoconjonctivite qui ne répondent pas ou ne répondent que partiellement au traitement. Les indices sur l’examen physique qui devraient éveiller les soupçons comprennent une lésion diffuse ou un épaississement et une madarose. Histopathologiquement, des taches spéciales telles que l’huile-rouge-O peuvent être utiles dans le diagnostic. Cependant, cela nécessite des tissus frais ou humides car le traitement à la paraffine élimine les lipides.
Comme pour toute autre lésion, la prise en charge initiale du carcinome à cellules sébacées comprend un historique complet et un examen physique. Il est également important d’effectuer des études de laboratoire de base pour éliminer la maladie métastatique. La prise en charge de choix pour la lésion elle-même est l’excision chirurgicale avec de larges marges, encore plus larges que celle habituellement prise pour un carcinome basocellulaire nodulaire. Les marges peuvent être confirmées par section congelée ou chirurgie de Mohs, mais ces méthodes ne sont pas fiables pour détecter la propagation intraépithéliale en raison de détails sous-optimaux. Par conséquent, la méthode préférée pour confirmer les marges consiste à utiliser des sections permanentes. Ainsi, la plupart des chirurgiens oculoplastiques effectuent les excisions sur quelques jours et reportent la reconstruction à plus tard. Cependant, avant d’effectuer une intervention chirurgicale, des biopsies de la carte conjonctivale sont recommandées. C’est un moyen de déterminer l’étendue de la lésion et de détecter la propagation des pagétoïdes. Ces biopsies de la carte conjonctivale sont recommandées quel que soit le tableau clinique, même s’il n’y a pas de tableau semblable à une blépharoconjonctivite qui suggérerait une propagation intraépithéliale. La procédure consiste à échantillonner des zones représentatives dans toute la conjonctive. Habituellement, 4 biopsies sont prélevées sur la conjonctive tarsienne, 6 sur la conjonctive bulbaire et 1 à 4 sur le limbe. Les biopsies sont petites et ne doivent pas nécessiter de sutures. Chaque biopsie doit être placée dans un récipient séparé et accompagnée d’un diagramme ou d’une carte de l’endroit où la biopsie a été prélevée. Si la propagation intraépithéliale est détectée, la prise en charge est controversée. Les options comprennent soit l’exentération, soit des alternatives plus économes en tissus telles que la cryothérapie ou la chimiothérapie topique avec la Mitomycine C. Études pilotes réalisées par Shields et al. (2002) et Lisman et coll. (1989) montrent des résultats prometteurs, mais d’autres études sont nécessaires. En raison de la propagation intraépithéliale caractéristique, il est également important de surveiller le système des glandes lacrymales. En cas d’invasion orbitale ou de lésions diffuses et volumineuses sur les deux paupières, une exentération est indiquée. La radiothérapie est réservée uniquement aux candidats chirurgicaux pauvres car elle est associée à un taux de récidive élevé. Certaines études de cas, cependant, montrent un succès avec une dose élevée de rayonnement > 55 Gy. Étant donné que des métastases régionales sont possibles, il est important de vérifier l’atteinte des ganglions lymphatiques par biopsie par aspiration à l’aiguille fine et de poursuivre la surveillance de la lymphadénopathie sous-maxillaire, préauriculaire et cervicale. Bien que rare, il est également important d’évaluer le syndrome de Muir-Torre. L’évaluation recommandée comprend un examen rectal, une coloscopie ou un lavement au baryum et une analyse cytologique de l’urine du premier matin.
Résumé
Le carcinome à cellules sébacées est une tumeur agressive observée le plus souvent sur la paupière. Comme il imite cliniquement d’autres maladies, il est difficile à diagnostiquer. Cependant, un diagnostic précis et rapide est crucial car il ne s’agit pas seulement de l’une des lésions les plus malignes de la paupière, mais également d’une lésion avec des associations graves telles que le syndrome de Muir-Torre et un potentiel élevé de métastases régionales et à distance. Comme il est observé presque exclusivement sur la paupière, le fardeau de maintenir une suspicion clinique élevée et de poser ce diagnostic difficile incombe à l’ophtalmologiste et au pathologiste oculaire.
Diagnostic: Carcinome Sébacé
ÉPIDÉMIOLOGIE
|
SIGNES
|
SYMPTÔMES
|
TRAITEMENT
|
Differential Diagnoses for Sebaceous Carcinoma
- Clinical appearance
- Chalazion
- Blepharoconjunctivitis/Keratoconjunctivitis
- Other sweat gland tumors (apocrine, eccrine)
- Histopathologic
- Basal Cell Carcinoma
- Squamous Cell Carcinoma variants (Mucoepidermoid Carcinoma, Spindle Cell Carcinoma)
- Melanoma
- Mucoepidermoid Carcinoma
- Hemangioma
- Albert DM, Jakobiec FA, eds. Principes et pratique de l’ophtalmologie, pratique clinique, 2e éd. Philadelphie : W.B. Saunders, 1999.
- Font RL, Croxatto JO, Rao NA. Atlas AFIP de Pathologie Tumorale: Tumeurs de l’Œil et des Annexes Oculaires, 4ème série, fascicule 5. Washington D.C. : Registre américain de pathologie, 2006.
- Hassanein AM, Al-Quran SZ, Kantor GR, Pauporte M, Telang GH, Spielvogel RL. Antigène de Thomsen-Friedenreich (T): un outil possible pour différencier le carcinome sébacé de ses simulateurs. Appl Immunohistochème Mol Morphol 2001; 9 (3): 250-254.
- Hayashi N, Furihata M, Ohtsuki Y, Ueno H. Recherche d’accumulation de protéine p53 et détection des génomes du virus du papillome humain dans le carcinome des glandes sébacées de la paupière. Arc de Virchows 1994; 424 (5): 503-509.
- Lisman RD, Jakobiec FA, Petit P. Carcinome sébacé des paupières. Le rôle de la cryothérapie d’appoint dans la gestion de la propagation pagétoïde conjonctivale. Ophtalmologie 1989; 96 (7): 1021-1026.
- Pathologie chirurgicale de Rosai J. Ackerman, 8e éd. Saint-Louis : Mosby, 1996.
- Sassani, Joseph. Pathologie Ophtalmique Avec Corrélations Cliniques. Philadelphie : Lippincott-Raven, 1997.
- Shields CL, Naseropour M, Shields JA, Eagle RC Jr. Mitomycine-C topique pour l’invasion pagétoïde de la conjonctive par un carcinome des glandes sébacées des paupières. Ophtalmologie 2002; 109 (11): 2129-2133.
- Boucliers JA, Demirci H, Marr BP, Eagle RC, boucliers CL. Carcinome sébacé de la région oculaire: Une revue. Enquête sur l’ophtalmologie 2005; 50: 103-122.
- Sinard JH. Distinction immunohistochimique du Carcinome Sébacé Oculaire du Carcinome basocellulaire et du Carcinome épidermoïde 1999; 117: 776-783.
- Spencer WH, éd. Pathologie ophtalmique: Un Atlas et un manuel, 4e éd. Philadelphie: W.B. Saunders Company, 1996
- Tumuluri K, Kourt G, Martin P. Mitomycin C dans le carcinome des glandes sébacées avec propagation pagétoïde. Journal britannique d’ophtalmologie 2004; 88 (5): 718-719.
- McKusick VA. OMIM #158320 Syndrome de Muir-Torre; MTS, 1986. http://www.ncbi.nlm.nih.gov/entrez/dispomim.cgi?cmd=entry&id=158320.
Format de citation suggéré: Johnson S, Nerad JA, Syed NA. Carcinome À Cellules Sébacées: Un Syndrome De Mascarade. EyeRounds.org . 23 janvier 2007; Disponible à partir de: http://webeye.ophth.uiowa.edu/cases/eyeforum/62-Sebaceous-Cell-Carcinoma-A-Masquerade-Syndrome.htm, 2007