Objectifs d’apprentissage
À la fin de cette section, vous pourrez ::
- Écrire des symboles de Lewis pour des atomes et des ions neutres
- Dessiner des structures de Lewis représentant la liaison dans des molécules simples
Nous avons discuté des différents types de liaisons qui se forment entre les atomes et/ ou les ions. Dans tous les cas, ces liaisons impliquent le partage ou le transfert d’électrons de coquille de valence entre les atomes. Dans cette section, nous explorerons la méthode typique pour représenter les électrons de la coquille de valence et les liaisons chimiques, à savoir les symboles de Lewis et les structures de Lewis.
Symboles de Lewis
Nous utilisons des symboles de Lewis pour décrire les configurations électroniques de valence des atomes et des ions monatomiques. Un symbole de Lewis est constitué d’un symbole élémentaire entouré d’un point pour chacun de ses électrons de valence:
La figure 1 montre les symboles de Lewis pour les éléments de la troisième période du tableau périodique.

Figure 1. Symboles de Lewis illustrant le nombre d’électrons de valence pour chaque élément de la troisième période du tableau périodique.
Les symboles de Lewis peuvent également être utilisés pour illustrer la formation de cations à partir d’atomes, comme indiqué ici pour le sodium et le calcium:

De même, ils peuvent être utilisés pour montrer la formation d’anions à partir d’atomes, comme indiqué ci-dessous pour le chlore et le soufre:

La figure 2 montre l’utilisation de symboles de Lewis pour montrer le transfert d’électrons lors de la formation de composés ioniques.

Figure 2. Les cations se forment lorsque les atomes perdent des électrons, représentés par moins de points de Lewis, tandis que les anions sont formés par des atomes gagnant des électrons. Le nombre total d’électrons ne change pas.
Structures de Lewis
Nous utilisons également des symboles de Lewis pour indiquer la formation de liaisons covalentes, qui sont illustrés dans les structures de Lewis, dessins qui décrivent la liaison dans les molécules et les ions polyatomiques. Par exemple, lorsque deux atomes de chlore forment une molécule de chlore, ils partagent une paire d’électrons:

La structure de Lewis indique que chaque atome Cl a trois paires d’électrons qui ne sont pas utilisées dans la liaison (appelées paires solitaires) et une paire d’électrons partagée (écrite entre les atomes). Un tiret (ou une ligne) est parfois utilisé pour indiquer une paire d’électrons partagée:

Une seule paire partagée d’électrons est appelée une seule liaison. Chaque atome Cl interagit avec huit électrons de valence: les six dans les paires isolées et les deux dans la liaison unique.
La règle de l’octet
Les autres molécules halogènes (F2, Br2, I2 et At2) forment des liaisons similaires à celles de la molécule de chlore : une liaison unique entre les atomes et trois paires isolées d’électrons par atome. Cela permet à chaque atome d’halogène d’avoir une configuration d’électrons de gaz noble. La tendance des atomes du groupe principal à former suffisamment de liaisons pour obtenir huit électrons de valence est connue sous le nom de règle de l’octet.
Le nombre de liaisons qu’un atome peut former peut souvent être prédit à partir du nombre d’électrons nécessaires pour atteindre un octet (huit électrons de valence); cela est particulièrement vrai pour les non-métaux de la deuxième période du tableau périodique (C, N, O et F). Par exemple, chaque atome d’un élément du groupe 14 a quatre électrons dans son enveloppe la plus externe et nécessite donc quatre électrons supplémentaires pour atteindre un octet. Ces quatre électrons peuvent être obtenus en formant quatre liaisons covalentes, comme illustré ici pour le carbone en CCl4 (tétrachlorure de carbone) et le silicium en SiH4 (silane). Parce que l’hydrogène n’a besoin que de deux électrons pour remplir sa coquille de valence, c’est une exception à la règle de l’octet. Les éléments de transition et les éléments de transition internes ne suivent pas non plus la règle des octets:

Les éléments du groupe 15 tels que l’azote ont cinq électrons de valence dans le symbole de Lewis atomique: une paire unique et trois électrons non appariés. Pour obtenir un octet, ces atomes forment trois liaisons covalentes, comme dans NH3 (ammoniac). L’oxygène et les autres atomes du groupe 16 obtiennent un octet en formant deux liaisons covalentes:
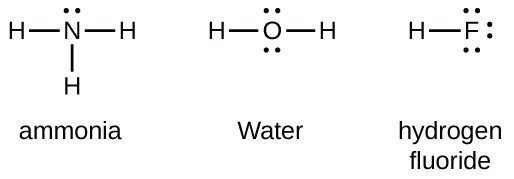
Liaisons doubles et triples
Comme mentionné précédemment, lorsqu’une paire d’atomes partage une paire d’électrons, nous appelons cela une liaison simple. Cependant, une paire d’atomes peut avoir besoin de partager plus d’une paire d’électrons pour atteindre l’octet requis. Une double liaison se forme lorsque deux paires d’électrons sont partagées entre une paire d’atomes, comme entre les atomes de carbone et d’oxygène dans CH2O (formaldéhyde) et entre les deux atomes de carbone dans C2H4 (éthylène) : 
Une triple liaison se forme lorsque trois paires d’électrons sont partagées par une paire d’atomes, comme dans l’azote gazeux (N2):
Écrire des structures de Lewis avec la Règle de l’Octet
Pour des molécules très simples et des ions moléculaires, nous pouvons écrire les structures de Lewis en appariant simplement les électrons non appariés sur les atomes constitutifs. Voir ces exemples:

Pour les molécules et les ions moléculaires plus complexes, il est utile de suivre la procédure étape par étape décrite ici:
- Déterminer le nombre total d’électrons de valence (enveloppe extérieure).
- Dessinez une structure squelette de la molécule, en organisant les atomes autour d’un atome central. (Généralement, l’élément le moins électronégatif doit être placé au centre.) Connectez chaque atome à l’atome central avec une seule liaison (une paire d’électrons).
- Répartissez les électrons restants en paires solitaires sur les atomes terminaux (sauf l’hydrogène), en complétant un octet autour de chaque atome.
- Placez tous les électrons restants sur l’atome central.
- Réarrangez les électrons des atomes extérieurs pour créer de multiples liaisons avec l’atome central afin d’obtenir des octets dans la mesure du possible.
Déterminons la structure de Lewis de PBr3 en utilisant les étapes ci-dessus:
- Étape 1: Déterminer le nombre total d’électrons de valence (enveloppe extérieure).
\ large \begin{array}{l}\\\phantom{\rule{0.8em}{0ex}}{\text{PBr}}_{3}\\\phantom{\rule{0.8em}{0ex}}\text{P: 5 électrons de valence/atome}\times\text{1 atome} = 5\\\underline{+\text{Br: 7 électrons de valence/ atome}\times\text{3 atomes} =21}\\\\phantom{\rule{15.95em}{0ex}} = \text {26 électrons de valence}\end { tableau}
- Étape 2: Dessinez une structure squelette de la molécule, en organisant les atomes autour d’un atome central. (Généralement, l’élément le moins électronégatif doit être placé au centre.) Connectez chaque atome à l’atome central avec une seule liaison (une paire d’électrons).

- Étape 3: Répartissez les électrons restants sous forme de paires isolées sur les atomes terminaux (sauf l’hydrogène), en complétant un octet autour de chaque atome.
-
 Étape 4: Placez tous les électrons restants sur l’atome central.
Étape 4: Placez tous les électrons restants sur l’atome central.

Remarque: Étape 5: N’est pas nécessaire car tous les atomes ont un octet.
Déterminons la structure de Lewis de CH2O.
- Étape 1: Déterminez le nombre total d’électrons de valence (enveloppe extérieure).
\ large \begin{array}{l}\\\phantom{\rule{0.8em}{0ex}}{\text{H}_{2}}\text{CO}\\\phantom{\rule{0.8em}{0ex}}\text{H: 1 électron de valence/ atome}\ times\text{2 atom} = 2\\\text{C: 4 électrons de valence/ atome}\ times\text{1 atom} = 4\\\underline{+\text{O: 6 électrons de valence/ atome}\ temps \text{1 atomes} = 6} \\\\\phantom{\rule{15.95em}{0ex}} = \text{12 électrons de valence}\end{tableau}
- Étape 2: Dessinez une structure squelette de la molécule, en organisant les atomes autour d’un atome central. (Généralement, l’élément le moins électronégatif doit être placé au centre.) Connectez chaque atome à l’atome central avec une seule liaison (une paire d’électrons).

- Étape 3: Répartissez les électrons restants sous forme de paires isolées sur les atomes terminaux (sauf l’hydrogène), en complétant un octet autour de chaque atome.

- Étape 4: Pas nécessaire, car tous les électrons ont été placés. Cependant, le carbone n’a pas d’octet,
- Étape 5: Réorganisez les électrons des atomes extérieurs pour créer de multiples liaisons avec l’atome central afin d’obtenir des octets dans la mesure du possible.

Exemple 1 : Écriture des structures de Lewis
La mission Cassini-Huygens de la NASA a détecté un grand nuage de cyanure d’hydrogène toxique (HCN) sur Titan, l’une des lunes de Saturne. Quelles sont les structures de Lewis de ces molécules ?
Vérifiez votre apprentissage
Le dioxyde de carbone, le CO2, est un produit de la combustion de combustibles fossiles. Le CO2 a été impliqué dans le changement climatique mondial. Quelle est la structure de Lewis du CO2?
Concepts clés et résumé
Les structures électroniques de Valence peuvent être visualisées en dessinant des symboles de Lewis (pour les atomes et les ions monatomiques) et des structures de Lewis (pour les molécules et les ions polyatomiques). Des paires solitaires, des électrons non appariés et des liaisons simples, doubles ou triples sont utilisés pour indiquer où les électrons de valence sont situés autour de chaque atome dans une structure de Lewis. La plupart des structures — en particulier celles contenant des éléments de deuxième rangée — obéissent à la règle de l’octet, dans laquelle chaque atome (sauf H) est entouré de huit électrons. Des exceptions à la règle des octets se produisent pour les molécules d’électrons impairs (radicaux libres), les molécules déficientes en électrons et les molécules hypervalentes.
Exercices
- Écrivez les symboles de Lewis pour chacun des ions suivants:
- As3-
- I –
- Be2 +
- O2 –
- Ga3+
- Li+
- N3–
- De nombreux ions monatomiques se trouvent dans l’eau de mer, y compris les ions formés à partir de la liste d’éléments suivante. Écrivez les symboles de Lewis pour les ions monatomiques formés à partir des éléments suivants:
- Cl
- Na
- Mg
- Ca
- K
- Br
- Sr
- F
- Écrivez les symboles de Lewis des ions dans chacun des composés ioniques suivants et les symboles de Lewis de l’atome à partir duquel ils sont formés :
- MgS
- Al2O3
- GaCl3
- K2O
- Li3N
- KF
- Dans les structures de Lewis énumérées ci-dessous, M et X représentent divers éléments de la troisième période du tableau périodique. Écrivez la formule de chaque composé en utilisant les symboles chimiques de chaque élément:
- Écrivez la structure de Lewis de la molécule diatomique P2, une forme instable de phosphore présente dans la vapeur de phosphore à haute température.
- Écrivez des structures de Lewis pour ce qui suit :
- H2
- HBr
- PCl3
- Ecrire des structures de Lewis pour ce qui suit :
- O2
- H2CO
- AsF3
- SiCl4
Glossaire
double liaison : liaison covalente dans laquelle deux paires d’électrons sont partagées entre deux atomes
radical libre : molécule qui contient un nombre impair d’électrons
molécule hypervalente : molécule contenant au moins un élément du groupe principal qui a plus de huit électrons dans son enveloppe de valence
Structure de Lewis : diagramme montrant des paires isolées et des paires de liaison d’électrons dans une molécule ou un ion
Symbole de Lewis: symbole d’un élément ou d’un ion monatomique qui utilise un point pour représenter chaque électron de valence dans l’élément ou l’ion
paire unique: deux (une paire de) électrons de valence qui ne sont pas utilisés pour former une liaison covalente
règle de l’octet: directive indiquant que les atomes du groupe principal formeront des structures dans lesquelles huit électrons de valence interagiront avec chaque noyau, en comptant les électrons de liaison comme interagissant avec les deux atomes reliés par la liaison
liaison simple: liaison dans laquelle une seule paire d’électrons est partagée entre deux atomes
triple liaison: liaison dans laquelle trois paires d’électrons sont partagées entre deux atomes


 HCN : il ne reste plus d’électrons
HCN : il ne reste plus d’électrons




















