Le cycle glucose-alanine, ou cycle de Cahill, proposé pour la première fois par Mallette, Exton et Park, et Felig et al. entre 1969 et 1970, consiste en une série d’étapes par lesquelles les tissus extrahépatiques, par exemple le muscle squelettique, exportent des groupes pyruvate et amino sous forme d’alanine vers le foie et reçoivent du glucose du foie via la circulation sanguine.
Les principales étapes du cycle glucose-alanine sont résumées ci-dessous.
- Lorsque, dans les tissus extrahépatiques, des acides aminés sont utilisés pour l’énergie, le pyruvate, dérivé de la glycolyse, est utilisé comme accepteur de groupe aminé, formant de l’alanine, un acide aminé non essentiel.
- L’alanine se diffuse dans la circulation sanguine et atteint le foie.
- Dans le foie, le groupe amino de l’alanine est transféré à l’α-cétoglutarate pour former respectivement du pyruvate et du glutamate.
- Le groupe amino du glutamate entre principalement dans le cycle de l’urée et agit en partie comme donneur d’azote dans de nombreuses voies biosynthétiques.
Le pyruvate entre dans la gluconéogenèse et est utilisé pour la synthèse du glucose. - Le glucose nouvellement formé se diffuse dans la circulation sanguine et atteint les tissus périphériques où, en raison de la glycolyse, il est converti en pyruvate qui peut accepter des groupes aminés des acides aminés libres, fermant ainsi le cycle.
Par conséquent, le cycle glucose-alanine fournit un lien entre le métabolisme des glucides et des acides aminés, comme décrit schématiquement ci-dessous.
Glucose → Pyruvate → Alanine → Pyruvate → Glucose
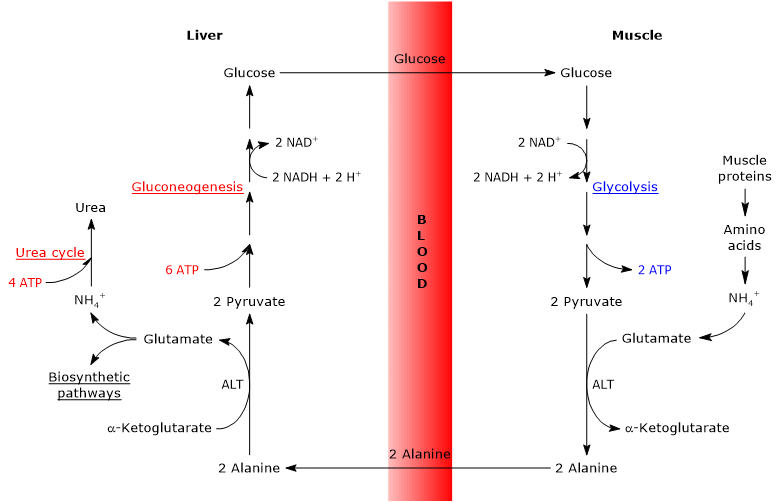
Le cycle glucose-alanine se produit non seulement entre le muscle squelettique, le premier tissu dans lequel il a été observé, et le foie, mais implique d’autres cellules et tissus extrahépatiques, y compris des cellules du système immunitaire, telles que les organes lymphoïdes.
CONTENU
- Les étapes du cycle glucose-alanine
- Le cycle de Cahill dans le muscle squelettique
- Le cycle de Cahill dans le foie
- Transaminases
- Fonctions du cycle glucose-alanine
- Coût énergétique du cycle glucose-alanine
- Similitudes et différences entre le cycle de Cahill et le cycle Cori
Les étapes du cycle glucose-alanine
L’analyse des étapes du cycle glucose-alanine est faite en tenant compte du cycle entre le muscle squelettique et le foie.
Les protéines intracellulaires et extracellulaires sont hydrolysées en continu en acides aminés constitutifs et resynthétisées, et la vitesse à laquelle ces processus se produisent est équilibrée avec précision, empêchant ainsi la perte de masse sans graisse.
Cependant, dans des conditions cataboliques, telles que l’exercice intense et prolongé ou le jeûne, le taux de dégradation des protéines musculaires dépasse la synthèse. Cela conduit à la libération d’acides aminés, dont certains sont utilisés pour l’énergie et d’autres pour la gluconéogenèse. Et l’oxydation des squelettes carbonés des acides aminés, en particulier des acides aminés à chaîne ramifiée ou BCAA (leucine, isoleucine et valine), peut être une source d’énergie importante pour le muscle. Par exemple, après environ 90 minutes d’exercice intense, l’oxydation des acides aminés dans le muscle fournit 10 à 15% de l’énergie nécessaire à la contraction.
L’utilisation des squelettes carbonés des acides aminés pour l’énergie implique l’élimination du groupe amino, puis l’excrétion de l’azote aminé sous une forme non toxique.
L’élimination du groupe α-amino se fait par transamination, qui peut se résumer comme suit :
acide α-Céto + Acide aminé New Nouvel acide aminé + Nouvel acide α-céto
De telles réactions, catalysées par des enzymes appelées aminotransférases ou transaminases (EC 2.6.1) sont librement réversibles.
Les acides aminés à chaîne ramifiée, par exemple, transfèrent le groupe amino à l’α-cétoglutarate ou à l’acide 2-oxoglutarique, pour former du glutamate et l’acide α-céto dérivé de l’acide aminé d’origine, dans une réaction catalysée par l’aminotransférase à chaîne ramifiée ou BCAT (EC 2.6.1.42).
Le cycle de Cahill dans le muscle squelettique
Dans le muscle squelettique, le glutamate nouvellement formé peut réagir avec l’ammoniac pour former de la glutamine, pour de nombreux tissus et organes, tels que le cerveau, le principal véhicule de transport interorganique de l’azote. La réaction est catalysée par l’enzyme cytosolique glutamine synthétase (EC 6.3.1.2), et consomme un ATP.
Glutamate + NH4 + + ATP → Glutamine + ADP + Pi
Dans ce cas, le glutamate quitte le cycle de Cahill.
Alternativement, et contrairement à ce qui se passe dans la plupart des autres tissus, le glutamate nouvellement formé peut transférer le groupe amino en pyruvate, dérivé de la glycolyse, pour former de l’alanine et de l’α-cétoglutarate. Cette transamination est catalysée par l’alanine aminotransférase ou ALT (EC 2.6.1.2), une enzyme présente dans la plupart des tissus animaux et végétaux.
Glutamate + Pyruvate ⇄ Alanine + α-Cétoglutarate
L’alanine produite et celle dérivée directement de la dégradation des protéines, et les protéines musculaires sont riches en alanine, peuvent quitter la cellule et être transportées par la circulation sanguine vers le foie; de cette façon, le groupe amino atteint le foie. Et la vitesse à laquelle l’alanine formée par transamination du pyruvate est transférée dans la circulation est proportionnelle à la production de pyruvate intracellulaire.
Remarque: L’alanine et la glutamine sont les principales sources d’azote et de carbone dans le métabolisme des acides aminés interorganiques.
Le cycle de Cahill dans le foie
Une fois dans le foie, une alanine aminotransférase hépatique catalyse une transamination dans laquelle l’alanine, le principal acide aminé gluconéogène, agit comme donneur de groupe aminé et l’α-cétoglutarate comme accepteur d’acide α-céto. Les produits de la réaction sont le pyruvate, c’est-à-dire le squelette carboné de l’alanine, et le glutamate.
Alanine + α-Cétoglutarate ⇄ Glutamate + Pyruvate
Glutamate, dans la réaction catalysée par la glutamate déshydrogénase (EC 1.4.1.2), une enzyme présente dans la matrice mitochondriale, forme l’ion ammonium, qui entre dans le cycle de l’urée, et l’α-cétoglutarate, qui peut entrer dans le cycle de Krebs. Cette réaction est une réaction anaplérotique qui relie le métabolisme des acides aminés au cycle de Krebs.
Glutamate + H2O + NAD + ⇄ α-Cétoglutarate + NH4 + + NADH + H +
Cependant, le glutamate peut également réagir avec l’oxaloacétate pour former de l’aspartate et de l’α-cétoglutarate, dans une réaction catalysée par l’aspartate aminotransférase (EC 2.6.1.1). L’aspartate est impliqué dans la formation de l’urée ainsi que dans la synthèse des purines et des pyrimidines.
Glutamate + Oxaloacétate ⇄ Aspartate + α-Cétoglutarate
De plus, le pyruvate produit peut avoir des destins métaboliques différents: il peut être oxydé pour la production d’ATP, puis quitter le cycle glucose-alanine, ou entrer dans la voie de la gluconéogenèse, et ainsi continuer dans le cycle.
Le glucose produit est libéré du foie dans la circulation sanguine et délivré à divers tissus qui en ont besoin, comme le muscle squelettique, dans lequel il est utilisé pour la synthèse du pyruvate. À son tour, le pyruvate nouvellement formé peut réagir avec le glutamate, fermant ainsi le cycle.
Transaminases
Comme mentionné précédemment, l’élimination du groupe amino des acides aminés se fait par transamination (voir ci-dessus pour la réaction générale). Ces réactions sont catalysées par des enzymes appelées aminotransférases ou transaminases.
Ce sont des enzymes cytosoliques, présentes dans toutes les cellules et particulièrement abondantes dans le foie, les reins, l’intestin et les muscles; elles nécessitent du phosphate de pyridoxal ou PLP, la forme active de la vitamine B6 ou de la pyridoxine, sous forme de coenzyme, qui est étroitement liée au site actif.
Dans les réactions de transamination, le groupe amino des acides aminés libres, à l’exception de la thréonine et de la lysine, est canalisé vers un petit nombre d’α-cétoacides, notamment le pyruvate, l’oxaloacétate et l’α-cétoglutarate.
Les cellules contiennent différents types d’aminotransférases: beaucoup sont spécifiques de l’α-cétoglutarate en tant qu’accepteur d’acide α-céto, mais diffèrent par leur spécificité pour l’acide aminé, d’où ils sont nommés. Des exemples sont l’alanine aminotransférase précitée, également appelée alanine transaminase et transférase glutamique pyruvique ou GPT, et l’aspartate aminotransférase ou AST, également appelée transaminase glutamique-oxaloacétique ou GOT.
Il convient de souligner qu’il n’y a pas de désamination nette dans ces réactions, pas de perte de groupes amino, car l’accepteur d’acide α-céto est aminé et l’acide aminé désaminé.
Fonctions du cycle glucose-alanine
Ce cycle a diverses fonctions.
- Il transporte l’azote sous une forme non toxique des tissus périphériques vers le foie.
- Il transporte le pyruvate, un substrat gluconéogène, vers le foie.
- Il élimine le pyruvate des tissus périphériques. Cela conduit à une production plus élevée d’ATP à partir du glucose dans ces tissus. En fait, le NADH produit lors de la glycolyse peut pénétrer dans les mitochondries et être oxydé par phosphorylation oxydative.
- Il permet de maintenir une concentration relativement élevée d’alanine dans les hépatocytes, suffisante pour inhiber la dégradation des protéines.
- Il peut jouer un rôle dans la défense de l’hôte contre les maladies infectieuses.
Enfin, il est important de souligner qu’il n’y a pas de synthèse nette de glucose dans le cycle glucose-alanine.
Coût énergétique du cycle glucose-alanine
Comme le cycle Cori, le cycle glucose-alanine a également un coût énergétique, égal à 3-5 ATP.
La partie du cycle qui se déroule dans les tissus périphériques implique la production de 5 à 7 ATP par molécule de glucose:
- 2 L’ATP est produit par glycolyse ;
- 3-5 ATP dérivent du NADH/FADH2 (voir ci-dessous).
Au lieu de cela dans le foie, la gluconéogenèse et le cycle de l’urée coûtent 10 ATP:
- 6 L’ATP est consommé au cours de la gluconéogenèse par molécule de glucose synthétisée;
- 4 ATP sont consommés au cours du cycle de l’urée par molécule d’urée synthétisée.
Le cycle glucose-alanine, comme le cycle Cori, déplace une partie de la charge métabolique des tissus extrahépatiques vers le foie. Cependant, le coût énergétique payé par le foie est justifié par les avantages que le cycle apporte à l’ensemble du corps, car il permet, dans des conditions particulières, une dégradation efficace des protéines dans les tissus extrahépatiques (en particulier le muscle squelettique), ce qui permet à son tour d’obtenir des substrats gluconéogènes ainsi que l’utilisation d’acides aminés pour l’énergie dans les tissus extrahépatiques.
Similitudes et différences entre le cycle de Cahill et le cycle de Cori
Il existe quelques analogies entre les deux cycles, qui sont énumérées ci-dessous.
- Le cycle de Cahill chevauche partiellement le cycle de Cori lorsque le pyruvate est converti en glucose et que le monosaccharide est transporté vers des tissus extrahépatiques, dans lesquels il est à nouveau converti en pyruvate via la voie glycolytique.
- L’entrée dans la voie de la gluconéogenèse est similaire pour les deux cycles: l’alanine et le lactate sont convertis en pyruvate.
- Comme le cycle de Cori, le cycle glucose-alanine se produit entre différents types cellulaires, contrairement aux voies métaboliques telles que la glycolyse, le cycle de Krebs ou la gluconéogenèse qui se produisent dans les cellules individuelles
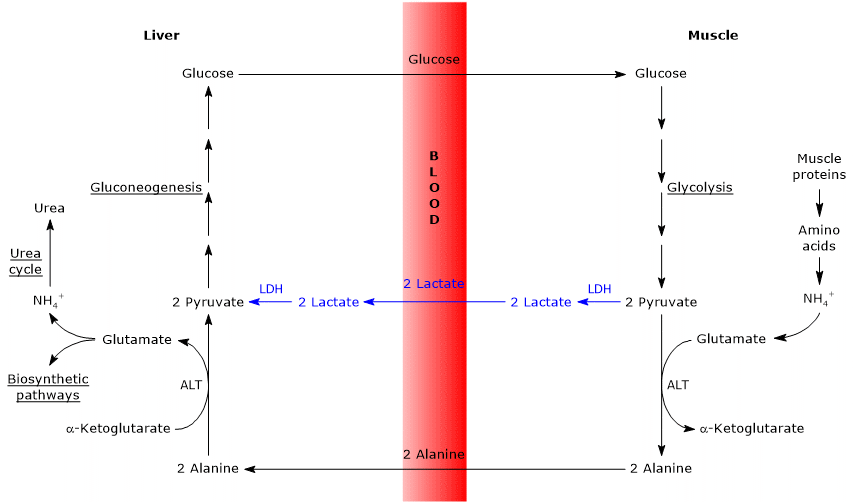
Ci-dessous, quelques différences entre les deux cycles.
- La principale différence concerne les trois intermédiaires de carbone qui, des tissus périphériques, atteignent le foie: lactate dans le cycle Cori et alanine dans le cycle glucose-alanine.
- Une autre différence concerne le devenir du NADH produit par glycolyse dans les tissus périphériques.
Dans le cycle Cori, la coenzyme agit comme agent réducteur pour réduire le pyruvate en lactate, dans la réaction catalysée par la lactate déshydrogénase (EC 1.1.1.27).
Dans le cycle glucose-alanine, cette réduction ne se produit pas et les électrons du NADH peuvent être transportés dans les mitochondries via les navettes malate-aspartate et glycérol 3-phosphate, générant NADH, la première navette, et FADH2, l’autre navette. Et le rendement en ATP de NADH et FADH2 est respectivement de 2,5 et 1,5. - Enfin, du point précédent, il est clair que, contrairement au cycle de Cori, le cycle de Cahill nécessite la présence d’oxygène et de mitochondries dans les tissus périphériques.
Berg J.M., Tymoczko J.L. et Stryer L. Biochimie. 5ème Édition. W. H. Freeman and Company, 2002
Felig P., Pozefsk T., Marlis E., Cahill G.F. Alanine: rôle clé dans la gluconéogenèse. Science 1970; 167 (3920): 1003-4. doi: 10.1126 / science.167.3920.1003
Gropper S.s., Smith J.L., Groff J.L. Nutrition avancée et métabolisme humain. Cengage Learning, 2009
Lecker S.H., Goldberg A.L. et Mitch W.E. Dégradation des protéines par la voie ubiquitine–protéasome dans les états normaux et pathologiques. J Am Soc Nephrol 2006; 17 (7): 1807-19. doi: 10.1681/ ASN.2006010083
Mallette L.E., Exton J.H. et Park C.R. Contrôle de la gluconéogenèse à partir d’acides aminés dans le foie de rat perfusé. J Biol Chem 1969; 244 (20): 5713-23.
Nelson D.L., Cox M.M. Lehninger. Principes de biochimie. 6ème Édition. W.H. Freeman et Compagnie, 2012
Raju S.m., Madala B. Biochimie médicale illustrée. Jaypee Brothers Publishers, 2005
Wu G. Acides aminés: biochimie et nutrition. Presse CRC, 2013