Nom générique: chlorhydrate de diphenhydramine, chlorhydrate de lidocaïne, hydroxyde d’aluminium, hydroxyde de magnésium
Forme posologique: kit de préparation orale
Revue médicale par Drugs.com . Dernière mise à jour le 21 septembre 2020.
- Professionnel
- Interactions
- Avis
- Plus
Avertissement: Ce médicament n’a pas été jugé sûr et efficace par la FDA, et cet étiquetage n’a pas été approuvé par la FDA. Pour plus d’informations sur les médicaments non approuvés, cliquez ici.
FIRST ®-Rince—bouche BLM Rx
Kit de préparation à la Diphenhydramine HCl, à la Lidocaïne HCl, à l’Hydroxyde d’Aluminium, à l’Hydroxyde de Magnésium et à la Siméthicone
POUR PRÉPARATION SUR ORDONNANCE UNIQUEMENT
Sur cette page
First Mouthwash BLM Description
Chaque kit de composition FIRST®-Rince-bouche BLM est composé de 0,2 gramme de poudre de chlorhydrate de diphenhydramine USP et de 1,6 gramme de poudre de chlorhydrate de lidocaïne USP pour usage oral.* Le kit de composition FIRST®—Rince-bouche BLM contient également une suspension de 236 mL contenant 3,15 grammes d’hydroxyde d’aluminium USP (équivalent au gel USP séché), 3,15 grammes d’hydroxyde de magnésium USP et 0,315 grammes de siméthicone USP avec de l’alcool benzylique, du butylparabène, de l’arôme, de l’hydroxyéthylcellulose, du propylparabène, de l’eau purifiée, de la saccharine sodique, une solution de sorbitol, D & C rouge #28, et FD & C rouge #40.* Lorsqu’il est composé, le produit final fournit une suspension homogène contenant du chlorhydrate de diphenhydramine, du chlorhydrate de lidocaïne et de l’hydroxyde d’aluminium, de l’hydroxyde de magnésium et de la siméthicone comparables aux principes actifs (Benadryl®, Lidocaïne HCl 2% Visqueux, Maalox® 1:1:1) contenus dans le bain de bouche magique.**
Instructions d’alimentation et de préparation
| Taille | 237 mL (8 OZ LIQ.)) |
| NDC# | 65628-050-01 |
| Diphenhydramine HCl | 0.2g |
| HCl de lidocaïne | 1,6 g |
| FIRST® – Suspension de rince-bouche | 236 mL |
AU PHARMACIEN
Tout ce dont vous avez besoin pour le faire est inclus…
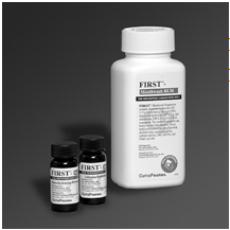
1. Le kit de composition FIRST®—Rince-bouche BLM contient de la poudre de chlorhydrate de diphenhydramine prémesurée, de la poudre de chlorhydrate de lidocaïne et une suspension de rince-bouche (hydroxyde d’aluminium, hydroxyde de magnésium, siméthicone et ingrédients inactifs)

2. Important – Avant de distribuer, tapotez le haut et le bas du flacon contenant du chlorhydrate de diphenhydramine pour desserrer la poudre et retirer le bouchon. Vider la poudre de chlorhydrate de diphenhydramine dans le flacon contenant la suspension liquide de rince-bouche. De même, appuyez sur le haut et le bas de la bouteille contenant du chlorhydrate de lidocaïne pour desserrer la poudre et retirer le bouchon. Videz la poudre de chlorhydrate de lidocaïne dans le flacon contenant la suspension liquide de rince-bouche.
Les quantités appropriées de poudre de chlorhydrate de diphenhydramine et de poudre de chlorhydrate de lidocaïne ont été emballées dans chaque flacon pour fournir la dose requise de chaque médicament. Les quantités résiduelles restant dans les bouteilles après la vidange ne doivent pas être rincées.

3. Fermez la bouteille et agitez pendant 20 à 30 secondes. Demandez au patient de bien agiter le flacon avant chaque utilisation.
Avant la préparation, conserver le kit de préparation FIRST®—Rince-bouche BLM à température ambiante entre 15 et 30 °C (59 à 86 °F). Conservez également la formulation finale à température ambiante, de 15 à 30 °C (59 à 86 °F).
Les composants du kit de composition FIRST®—Rince-bouche BLM ont une date de péremption de trois ans.*** Basé sur des tests de température et d’humidité ambiantes contrôlés en temps réel, le kit de composition BLM compounded FIRST®—Rince-bouche est stable pendant au moins six mois.***
La suspension FIRST®-Rince-bouche répond aux exigences pour un nombre microbien aérobie total ne dépassant pas 100 ufc / mL, ainsi que pour l’absence des microorganismes spécifiés Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus et Salmonella spp. lorsqu’il est testé comme décrit dans l’USP actuel sous < 61 > Tests de dénombrement microbien et < 62 > Tests pour les Microorganismes spécifiés. La suspension de rince—bouche FIRST® répond également aux exigences décrites dans l’USP actuel sous < 51 > Test d’efficacité antimicrobienne pour les produits de catégorie 4.
Pour usage oral uniquement. Évitez le contact avec les yeux. Gardez le récipient bien fermé. Tenir hors de la portée des enfants. Protéger de la lumière. Protéger du gel. Le produit composé, tel qu’il est distribué, est stable pendant au moins 180 jours à température ambiante.
* Certificat d’analyse au dossier
** Ce produit n’est pas fabriqué par Pfizer, Inc., fabricant de Benadryl® ou par Novartis Consumer Health, Inc. fabricant de Maalox®
*** Données et documentation au dossier
RX SEULEMENT
Révisé: février 2010
Brevet américain No. 6 708 822 B1
Brevet Supplémentaire En Instance Aux États-Unis
Distribué Par:
CutisPharma, Inc.
PRODUITS INTELLIGENTS POUR SMART PEOPLE®
Woburn, MA 01801, ÉTATS-UNIS www.cutispharma.com
PANNEAU D’AFFICHAGE PRINCIPAL
NDC 65628-050-01
FIRST® Rince-bouche BLM
Chaque kit contient:
Ingrédients actifs:
Chlorhydrate de diphenhydramine 0,2 g
chlorhydrate de lidocaïne 1,6 g
Hydroxyde d’aluminium 3,15 g en suspension de 236 ml (équivalent au gel séché USP)
Hydroxyde de magnésium 3,15 g en suspension de 236 ml
Siméthicone 0.315g in 236mL suspension
8 FL OZ (237 mL) as dispensed

| First Mouthwash BLM diphenhydramine hydrochloride and lidocaine hydrochloride and aluminum hydroxide and magnesium hydro kit |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
Partie 1 de 3 CHLORHYDRATE de LIDOCAÏNE
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
Partie 2 de 3 PREMIÈRE SUSPENSION DE RINCE-BOUCHE
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
Partie 3 de 3 DIPHENHYDRAMINE HYDROCHLORIDE
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
Labeler – CutisPharma, Inc. (090598256)
More about FIRST Mouthwash BLM (aluminum hydroxide / diphenhydramine / lidocaine / magnesium hydroxide / simethicone topical)
- Drug Interactions
- 2 Reviews
- Drug class: produits pour la bouche et la gorge
Guides de traitement connexes
- Ulcère aphteux
Avertissement médical