Les preuves derrière les Interventions Naturelles pour la Stéatose Hépatique Non alcoolique: Plantes, Nutriments et Probiotiques pour traiter cette maladie commune
Compte tenu de l’augmentation de la stéatose hépatique non alcoolique (NAFLD) chez les adultes et les pédiatres et de l’absence d’un traitement pharmaceutique indiqué, les stratégies naturelles pour le traitement de cette maladie sont bien placées comme la « prochaine meilleure chose. »Plusieurs suppléments nutritionnels et plantes ont été étudiés cliniquement et sont prometteurs pour le traitement de la NAFLD et de son homologue inflammatoire, la stéatohépatite non alcoolique (NASH). Étant donné le nombre de ces thérapies qui traitent les facteurs qui contribuent au développement de la NAFLD, il ne faut pas beaucoup de raisonnement pour comprendre comment elles peuvent traiter efficacement certaines des causes profondes de la maladie, plutôt que de simplement s’attaquer à un symptôme.
Cinq interventions supplémentaires avec des preuves cliniques ou épidémiologiques pour leur utilisation dans le cadre de la NAFLD sont la phosphatidylcholine, qui fournit des phospholipides et de la choline, de la vitamine E, à la fois sous forme d’alpha-tocophérols et d’un mélange de tocotriénols delta et gamma, d’extrait de graine de chardon-marie, de berbérine et de probiotiques.
- Modifications de la stéatose hépatique : Corrélées à une carence en Phosphatidylcholine?
- Vitamine E
- Chardon-marie
- Berbérine
- Probiotiques
- Conclusion
- La Dre Carrie Decker, ND, est diplômée avec mention du Collège National de Médecine Naturelle (maintenant l’Université Nationale de Médecine Naturelle) à Portland, en Oregon. Dr. Decker voit les patients à distance, en mettant l’accent sur les maladies gastro-intestinales, les déséquilibres de l’humeur, les troubles de l’alimentation, les maladies auto-immunes et la fatigue chronique. Avant de devenir médecin naturopathe, le Dr Decker était ingénieur et a obtenu des diplômes d’études supérieures en génie biomédical et en génie mécanique de l’Université du Wisconsin-Madison et de l’Université de l’Illinois à Urbana-Champaign, respectivement. Le Dr Decker continue d’aimer la recherche universitaire et la rédaction et utilise ces compétences pour soutenir l’éducation en médecine intégrative en tant qu’écrivain et contributeur à diverses ressources. Dr. Decker soutient le Groupe de recherche sur les allergies en tant que membre de son équipe de formation et de développement de produits.
- Sources:
- Spengler EK, Loomba R. Recommandations pour le diagnostic, le renvoi pour une biopsie du foie et le traitement de la stéatose hépatique non alcoolique et de la stéatohépatite non alcoolique. Procédures de la clinique Mayo. 2015;90(9):1233–1246.
- Berardis S, Sokal E. Stéatose hépatique pédiatrique non alcoolique: un problème croissant de santé publique. Eur J Pediatr. 2014 Fév; 173(2): 131-9.
- Jadeja R, et al. Médicaments à base de plantes pour le traitement de la stéatohépatite non alcoolique: scénario actuel et perspectives d’avenir. Complément à base d’Evid Alternat Med. 2014:648308.
- Pomorski T, et al. Distribution et transport des lipides à travers les membranes cellulaires. Biol de Développement de cellules Semin. 2001 Avril; 12(2): 139-48.
- Yamaji-Hasegawa A, et al. Distribution asymétrique des phospholipides dans les biomembranes. Taureau de Biol Pharm. 2006 Août; 29 (8): 1547-53.
- Hişmioğullari AA, et al. Sécrétion lipidique biliaire. Turk J Gastroentérol. 2007 Juin; 18(2): 65-70.
- Fischer LM, et al. Le sexe et le statut ménopausique influencent les besoins alimentaires humains en choline nutritive. Je suis Clin Nutr. 2007 Mai; 85(5): 1275-85.
- Wallace TC, et al. Les Apports Habituels de Choline Sont Associés à la Consommation d’Œufs et d’aliments Protéinés aux États-Unis. Nutriment. 5 août 2017; 9 (8).
- Zeisel SH. Les éléments de réponse génique, les polymorphismes génétiques et l’épigénétique influencent les besoins alimentaires humains en choline. IUBMB Vie. 2007 Juin; 59(6): 380-7.
- Zeisel SH. Les éléments de réponse génique, les polymorphismes génétiques et l’épigénétique influencent les besoins alimentaires humains en choline. IUBMB Vie. 2007 Juin; 59(6): 380-7.
- Guerrerio AL, et al. Prise de choline dans une grande cohorte de patients atteints de stéatose hépatique non alcoolique. Je suis Clin Nutr. 2012 Avril; 95 (4): 892-900.
- Ma X, et al. La polyénylphosphatidylcholine atténue la fibrose hépatique non alcoolique et accélère sa régression. J Hépatol. 1996 Mai; 24(5): 604-13.
- Lieber CS, et al. La phosphatidylcholine protège contre la fibrose et la cirrhose chez le babouin. Gastroentérologie. 1994 Jan; 106(1): 152-9.
- Chanussot F, et al. Prévention par les phosphatidylcholines polyinsaturées (n-6) alimentaires de la cholestase intrahépatique induite par la cyclosporine A chez les animaux. Vie Sci. 13 juin 2003; 73(4): 381-92.
- Karaman A, et al. Protective effect of polyunsaturated phosphatidylcholine on liver damage induced by biliary obstruction in rats. J Pediatr Surg. 2003 Sep; 38 (9): 1341-7.
- Karaman A, et al. Protective effect of polyunsaturated phosphatidylcholine on liver damage induced by biliary obstruction in rats. J Pediatr Surg. 2003 Sep; 38 (9): 1341-7.
- Stremmel W, et al. Protection des muqueuses par la phosphatidylcholine. Dig Dis. 2012; 30 Suppl 3:85-91.
- Parlesak A, et al. Les sels biliaires primaires conjugués réduisent la perméabilité de l’endotoxine à travers les cellules épithéliales intestinales et se synergisent avec la phosphatidylcholine pour supprimer la production de cytokines inflammatoires. Soins Critiques Med. 2007 Oct; 35 (10): 2367-74.
- Mitzscherling K, et al. La phosphatidylcholine inverse l’augmentation induite par l’éthanol de la perméabilité des endotoxines transépithéliales et abolit l’activation des leucocytes transépithéliaux. Alcool Clin Exp Res. 2009 Mar; 33 (3): 557-62.
- Buzzetti E, et al. La pathogenèse à succès multiples de la stéatose hépatique non alcoolique (NAFLD). Métabolisme. Août 2016; 65 (8):1038-48.
- El Hadi H, et al. La vitamine E comme traitement de la Stéatose hépatique Non alcoolique: Réalité ou mythe? Antioxydants (Bâle). 16 janvier 2018; 7 (1).
- Bugianesi E, et al. Un essai contrôlé randomisé de la metformine contre la vitamine E ou un régime prescriptif dans la stéatose hépatique non alcoolique. Je suis Gastroentérol. 2005 Mai; 100(5): 1082-90.
- Sanyal AJ, et al. Pioglitazone, vitamine E ou placebo pour la stéatohépatite non alcoolique. En anglais J Med. 2010 6 mai; 362 (18): 1675-85.
- Lavine JE. Traitement de la vitamine E de la stéatohépatite non alcoolique chez les enfants: une étude pilote. J Pediatr. 2000 Juin; 136(6): 734-8.
- Peh HY, et al. Thérapie à la vitamine E au-delà du cancer: Tocophérol contre tocotriénol. Pharmacol Ther. Juin 2016; 162:152-69.
- Qureshi AA, et al. Modulation dose-dépendante des paramètres lipidiques, des cytokines et de l’ARN par le delta-tocotriénol chez des sujets hypercholestérolémiques limités à un régime AHA Step-1. Brit J of Med & Med Res. 2015; 6 (4):351-66.
- Qureshi AA, et al. Impact du delta-tocotriénol sur les biomarqueurs inflammatoires et le stress oxydatif chez les sujets hypercholestérolémiques. Clin Exp Cardiologie. 2015;6(4):1000367.
- Zaiden N, et al. Les tocotriénols gamma delta réduisent la synthèse des triglycérides hépatiques et la sécrétion de VLDL. J Thrombus d’Athéroscler. 27 octobre 2010; 17 (10): 1019-32.
- Magosso E, et al. Tocotriénols pour la normalisation de la réponse échogénique hépatique dans la stéatose hépatique non alcoolique: essai clinique randomisé contrôlé par placebo. Nutr J. 2013 Déc 27; 12 (1): 166.
- Pervez MA, et al. Effets de la supplémentation en Delta-tocotriénol sur les Enzymes Hépatiques, l’inflammation, le stress oxydatif et la Stéatose hépatique chez les patients atteints de Stéatose Hépatique Non alcoolique. Turk J Gastroentérol. Mars 2018; 29 (2):170-176.
- Abenavoli L, et al. Chardon-marie dans les maladies du foie: passé, présent, futur. Phytother Res. 2010 Oct; 24 (10): 1423-32.
- Valenzuela A, et al. Sélectivité de la silymarine sur l’augmentation de la teneur en GSH dans différents tissus du rat. Planta Med. 1989 Oct; 55(5):420-2.
- Rui YC. Progrès dans les études pharmacologiques de la silymarine. Mem Inst Oswaldo Cruz. 1991; 86 Suppl 2:79-85.
- Gu M, et al. La silymarine Améliore le Dysfonctionnement métabolique Associé à l’obésité induite par l’alimentation via l’Activation du récepteur Farnésyl X. Pharmacol avant. 28 septembre 2016; 7:345.
- Ali AH, et al. Progrès récents dans le développement d’agonistes des récepteurs farnésoïdes X. Ann Transl Med. 2015 Jan; 3 (1): 5.
- Traussnigg S, et al. Efficacité et innocuité de l’agoniste des récepteurs farnésoïdes X non stéroïdiens PX-104 chez les patients atteints de stéatose hépatique non alcoolique (NAFLD). Revue de Gastroentérologie. 2017 Mai; 55 (05): A71.
- Zhong S, et al. L’effet thérapeutique de la silymarine dans le traitement de la maladie graisseuse non alcoolique: Une méta-analyse (PRISMA) d’essais témoins randomisés. Médecine (Baltimore). 2017 Déc; 96 (49): e9061.
- Hajiaghamohammadi AA, et al. Effets du traitement par la metformine, la pioglitazone et la silymarine sur la stéatose hépatique non alcoolique: une étude pilote contrôlée randomisée. Hépat Mon. 2012 Août; 12 (8): e6099.
- Birdsall TC, et al. Berbérine : potentiel thérapeutique d’un alcaloïde présent dans plusieurs plantes médicinales. Altern Med Rev. 1997; 2:94-103.
- Imanshahidi M, et al. Effets pharmacologiques et thérapeutiques de Berberis vulgaris et de son constituant actif, la berbérine. Phytother Res. 2008 août; 22 (8): 999-1012.
- Zhu X, et al. Les Mécanismes potentiels de la Berbérine dans le traitement de la Stéatose hépatique Non alcoolique. Molécule. 14 octobre 2016; 21 (10).
- Lan J, et al. Méta-analyse de l’effet et de la sécurité de la berbérine dans le traitement du diabète sucré de type 2, de l’hyperlipémie et de l’hypertension. J Ethnopharmacol. 23 février 2015; 161:69-81.
- Sun R, et al. La Berbérine Administrée par Voie Orale Module le Métabolisme des Lipides Hépatiques en Modifiant le Métabolisme Microbien des Acides Biliaires et la Voie de Signalisation Intestinale FXR. Mol Pharmacol. 2017 Fév; 91 (2): 110-122.
- Guo T, et al. La berbérine Améliore la Stéatose hépatique et Supprime l’Inflammation du Foie et du Tissu adipeux chez les Souris souffrant d’obésité induite par l’alimentation. Sci Rep. 2016 Mar 3; 6: 22612.
- Schattenberg JM, et al. JNK1 mais pas JNK2 favorise le développement de la stéatohépatite chez la souris. Hépatologie. 2006 Jan; 43(1): 163-72.
- Han J, et al. Modulation du microbiote intestinal comme mécanisme antidiabétique de la berbérine. Med Sci Monit. 2011; 17:RA164-7.
- Gu L, et al. La berbérine améliore les dommages aux jonctions étroites de l’épithélium intestinal et régule les voies de la kinase de la chaîne légère de la myosine dans un modèle d’endotoxinémie murine. J Infecter Dis. 1 Juin 2011; 203 (11): 1602-12.
- Li N, et al. La berbérine atténue la perturbation des jonctions serrées induite par les cytokines pro-inflammatoires dans un modèle in vitro de cellules épithéliales intestinales. Eur J Pharm Sci. 16 avril 2010; 40(1): 1-8.
- Ma X, et al. La Pathogenèse du Diabète sucré par le Stress Oxydatif et l’Inflammation: Son Inhibition par la Berbérine. Pharmacol avant. 27 juillet 2018; 9:782.
- Yan HM, et al. Efficacité de la berbérine chez les patients atteints de Stéatose hépatique Non alcoolique. PLoS Un. 2015 7 août; 10 (8): e0134172.
- Ma AA, et al. Effets des probiotiques sur la stéatose hépatique non alcoolique: une méta-analyse. Monde J Gastroentérol. 28 octobre 2013; 19 (40): 6911-8.
- Vajro P, et al. Effects of Lactobacillus rhamnosus strain GG in pediatric obesity-related liver disease. J Pediatr Gastroentérol Nutr. 2011 Juin; 52(6): 740-3.
- Alisi A, et al. Essai clinique randomisé: Les effets bénéfiques du VSL #3 chez les enfants obèses atteints de stéatohépatite non alcoolique. Alimentation Pharmacol Ther. 2014 Juin; 39 (11): 1276-85.
- Pérez-Rubio KG, et al. Effet de l’administration de berbérine sur le syndrome métabolique, la sensibilité à l’insuline et la sécrétion d’insuline. Metab Syndr Relat Disord. 2013 Oct; 11(5): 366-9.
- Iacono A, et al. Les probiotiques comme stratégie thérapeutique émergente pour traiter la NAFLD: focus sur les mécanismes moléculaires et biochimiques. J Nutr Biochem. 2011 Août; 22 (8): 699-711.
- Honda Y, et al. Efficacité du glutathion pour le traitement de la stéatose hépatique non alcoolique: étude pilote en ouvert, à bras unique et multicentrique. Gastroentérol BMC. 2017 8 août; 17 (1):96.
- Dentico P, et al. . Les plus récents Prog Med. 1995 Juil-août; 86 (7-8): 290-3.
- Khoshbaten M, et al. La N-acétyl-cystéine améliore la fonction hépatique chez les patients atteints de stéatose hépatique non alcoolique. Hépatite Mon. 2010;10(1):12-16.
- Muto C, et al. Le gamma-tocotriénol réduit le taux de triacylglycérol dans les hépatocytes primaires de rat par la régulation du métabolisme des acides gras. J Clin Biochem Nutr. 2013;52(1):32-37.
- Parker HM, et al. Supplémentation en oméga-3 et stéatose hépatique non alcoolique: une revue systématique et une méta-analyse. J Hépatol. 2012;56(4):944-51.
Modifications de la stéatose hépatique : Corrélées à une carence en Phosphatidylcholine?
La phosphatidylcholine (PC) est essentielle à la santé de toutes les cellules du corps et est l’un des principaux phospholipides dont sont constituées les membranes cellulaires., PC comprend plus de 90% de la teneur totale en phospholipides biliaires et facilite l’émulsification, l’absorption et le transport des graisses. Des études ont montré que l’apport adéquat recommandé (AI) de choline (voir tableau 1) peut ne pas être suffisant pour prévenir les symptômes de carence tels que des modifications du foie gras ou des lésions musculaires. De plus, une étude récente a révélé que seulement 8% des adultes américains répondent à l’IA recommandée de la choline, les végétariens, les femmes ménopausées et les hommes présentant le plus grand risque d’insuffisance., Les polymorphismes génétiques peuvent également augmenter le besoin de choline, qui est également une source de groupes méthyle dans le corps.
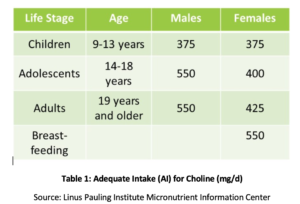
Chez les femmes ménopausées atteintes de NAFLD, une diminution de l’apport en choline s’est avérée significativement associée à un risque accru de fibrose. Chez les animaux, il a été démontré que la PC protège contre la fibrose associée à une inflammation hépatique., Il a été démontré qu’une consommation accrue de PC augmentait la sécrétion de lipides biliaires, prévenant ainsi la cholestase et les lésions hépatiques subséquentes via de nombreux mécanismes, y compris la suppression du facteur nucléaire kappa B (NF-kB), un déclencheur moléculaire bien compris de l’inflammation., Dans un modèle animal d’obstruction biliaire, il a été démontré que la PC supplémentaire réduisait les lésions hépatiques, la prolifération canalaire et la fibrose.
Le PC est également essentiel pour la santé de l’intestin et est un composant primaire de la couche protectrice de mucus intestinal. Dans les cultures cellulaires, il a été démontré que le traitement par PC réduisait la migration de l’endotoxine à travers les cellules épithéliales intestinales, supprimant davantage la réponse inflammatoire associée aux cytokines. Le PC réduit également la translocation des endotoxines dans le cadre d’augmentations induites par l’alcool de la perméabilité intestinale. Cet effet bénéfique a été proposé comme l’un des mécanismes par lesquels la PC peut être considérée comme thérapeutique dans les maladies hépatiques alcooliques.
Vitamine E
Comme un stress oxydatif et une diminution des défenses antioxydantes ont été proposés comme facteur menant au développement de la NAFLD, il ne devrait pas être surprenant que des antioxydants aient été étudiés comme traitement potentiel de la maladie.
 La vitamine E a été étudiée dans plusieurs essais cliniques pour le traitement de la NAFLD, à la fois en tant que thérapie autonome et en complément. Dans une revue de ces études, la dose de vitamine E variait de 400 à 1200 UI / jour et la durée de l’étude allait de 24 semaines à plus de deux ans. Les résultats étaient généralement positifs, montrant que lorsque la vitamine E était incluse, des améliorations des taux d’histologie, de stéatose et / ou de transaminases ont été observées., En pédiatrie avec NAFLD, la vitamine E a également été étudiée comme thérapie. Dans une étude pilote en ouvert comprenant 11 enfants atteints de NAFLD, une supplémentation de 400 à 1200 UI de vitamine E pendant quatre à dix mois s’est avérée normaliser les taux de transaminase et de phosphatase alcaline pendant le traitement, mais ils sont redevenus anormaux une fois le traitement arrêté. L’échogénicité hépatique n’a pas changé au cours du traitement.
La vitamine E a été étudiée dans plusieurs essais cliniques pour le traitement de la NAFLD, à la fois en tant que thérapie autonome et en complément. Dans une revue de ces études, la dose de vitamine E variait de 400 à 1200 UI / jour et la durée de l’étude allait de 24 semaines à plus de deux ans. Les résultats étaient généralement positifs, montrant que lorsque la vitamine E était incluse, des améliorations des taux d’histologie, de stéatose et / ou de transaminases ont été observées., En pédiatrie avec NAFLD, la vitamine E a également été étudiée comme thérapie. Dans une étude pilote en ouvert comprenant 11 enfants atteints de NAFLD, une supplémentation de 400 à 1200 UI de vitamine E pendant quatre à dix mois s’est avérée normaliser les taux de transaminase et de phosphatase alcaline pendant le traitement, mais ils sont redevenus anormaux une fois le traitement arrêté. L’échogénicité hépatique n’a pas changé au cours du traitement.
Les tocotriénols sont la famille la moins étudiée des formes naturelles de vitamine E, les tocophérols, plus souvent présents dans la nature, dominant la recherche scientifique. Cependant, les tocotriénols sont de puissants antioxydants, cités dans certaines recherches comme ayant 40 à 60 fois le potentiel antioxydant des tocophérols. Il a été démontré que les tocotriénols améliorent le cholestérol total et ses fractions, réduisant le cholestérol total et le cholestérol LDL de 15 à 20%, et les triglycérides jusqu’à près de 30%. Il a également été démontré que les tocotriénols ont des effets anti-inflammatoires et antioxydants in vivo, abaissant les niveaux de protéines C-réactives à haute sensibilité (hs-CRP) et réduisant l’oxydation des LDL.
Les tocotriénols ont également été étudiés comme traitement de la NAFLD. Chez les patients présentant une NAFLD diagnostiquée par échographie, il a été démontré que 200 mg de tocotriénols mixtes (provenant d’huile de palme, avec une fraction gamma élevée et 61 mg supplémentaires d’alpha-tocophérols) pris deux fois par jour pendant un an normalisaient significativement la réponse échogénique hépatique et le taux de rémission par rapport au placebo. Dans une deuxième étude, incluant des patients présentant une élévation de la NAFLD et de la transaminase diagnostiquée par échographie, 300 mg de tocotriénols (un mélange delta: gamma de 90: 10) pris deux fois par jour pendant 12 semaines ont significativement diminué les niveaux d’aspartate aminotransférase (AST), d’alanine aminotransférase (ALT), de hs-CRP et de malondialdéhyde (un marqueur du stress oxydatif) ainsi que le score d’indice de stéatose hépatique par rapport au placebo.
Chardon-marie
Le chardon-marie (Silybum marianum) est probablement la plante protectrice du foie la plus connue. La silymarine, un mélange des constituants actifs du chardon-marie, et la silibinine, le composé le plus actif qui s’y trouve, ont été démontrés dans des études animales pour réduire les lésions hépatiques causées par l’acétaminophène, l’alcool, la surcharge en fer et les radiations parmi d’autres substances toxiques pour le foie connues. Il a été démontré que la silymarine augmente les niveaux de glutathion, un puissant antioxydant, dans le foie et les intestins. Il réduit également la peroxydation lipidique, qui endommage les membranes cellulaires, altérant leur fonction et provoquant éventuellement la mort cellulaire.
Il a été démontré que la silibinine et la silymarine activent un récepteur nucléaire des acides biliaires connu sous le nom de récepteur farnésoïde X (FXR) dans le foie, régulant les voies inflammatoires et corrigeant la résistance à l’insuline et la dyslipidémie induites par l’alimentation riche en graisses (HFD). FXR est un régulateur clé de l’équilibre des acides biliaires, du glucose et des lipides dans le corps. Des médicaments qui interagissent avec la FXR de manière similaire à ces composés dérivés du chardon-marie sont également à l’étude pour le traitement de la NAFLD et des défis métaboliques associés.
Des études cliniques ont également montré que le chardon-marie améliore divers paramètres associés à la NAFLD. Une méta-analyse de 2017 a révélé que le traitement au chardon-marie réduit significativement l’ALAT et l’ASAT de -5,08 UI / L et -5,44 UI / L, respectivement, chez les patients atteints de NAFLD. Les doses variaient de 140 mg une fois par jour à 200 mg trois fois par jour, pour une durée de 8 à 24 semaines. À la dose la plus faible de 140 mg par jour, après 8 semaines, des améliorations significatives ont été observées dans la glycémie à jeun (FBG), le profil lipidique et les taux sériques d’insuline, en plus des réductions d’AST et d’ALT de 56 à 37.77 UI /L et 78,73 à 53,05 UI/L, respectivement.
Berbérine
La berbérine, l’alcaloïde jaune orangé que l’on trouve dans des plantes telles que la racine et l’écorce de raisin de l’Oregon, l’astre doré et l’épine-vinette, est une autre substance d’origine botanique qui possède de nombreux mécanismes par lesquels elle peut aider à protéger contre la NAFLD et soutenir sa résolution.,,
Les effets antidiabétiques et équilibrants lipidiques de la berbérine ont été démontrés dans plusieurs essais cliniques, et  peut être un moyen par lequel la berbérine affecte positivement la fonction hépatique. Il a été démontré que la berbérine modifie l’expression des gènes liés au métabolisme et le métabolisme des acides biliaires via des voies impliquant également la FXR. Dans des études animales, il a été démontré que la berbérine avait pour effet de prévenir l’obésité associée à la DHF et l’accumulation de triglycérides hépatiques chez les souris de type sauvage (normales), mais pas chez celles qui avaient l’élimination génétique de l’expression intestinale de FXR. Il a également été démontré que la berbérine supprime l’inflammation associée à l’obésité et la stéatose hépatique chez la souris en diminuant la phosphorylation du complexe inflammatoire connu sous le nom de JNK1, une protéine kinase impliquée dans le développement de la stéatohépatite. JNK1 est fortement activé par les facteurs de stress environnementaux et les cytokines pro-inflammatoires.
peut être un moyen par lequel la berbérine affecte positivement la fonction hépatique. Il a été démontré que la berbérine modifie l’expression des gènes liés au métabolisme et le métabolisme des acides biliaires via des voies impliquant également la FXR. Dans des études animales, il a été démontré que la berbérine avait pour effet de prévenir l’obésité associée à la DHF et l’accumulation de triglycérides hépatiques chez les souris de type sauvage (normales), mais pas chez celles qui avaient l’élimination génétique de l’expression intestinale de FXR. Il a également été démontré que la berbérine supprime l’inflammation associée à l’obésité et la stéatose hépatique chez la souris en diminuant la phosphorylation du complexe inflammatoire connu sous le nom de JNK1, une protéine kinase impliquée dans le développement de la stéatohépatite. JNK1 est fortement activé par les facteurs de stress environnementaux et les cytokines pro-inflammatoires.
La berbérine agit également dans l’intestin. Il affecte non seulement l’équilibre microbien intestinal, mais influence également directement la perméabilité intestinale, améliorant l’intégrité des jonctions serrées chez les animaux soumis à une endotoxémie ou à des cultures cellulaires traitées avec des cytokines pro-inflammatoires., Des effets anti-inflammatoires directs ont également été démontrés.
Les avantages de la berbérine dans la NAFLD ont également été démontrés cliniquement dans un essai clinique ouvert randomisé, contrôlé en parallèle. Chez les patients atteints de NAFLD, il a été démontré que la berbérine rétablissait l’architecture hépatique normale, les lipides et le métabolisme de la glycémie, avec des améliorations significatives observées chez la population qui ne mettait en œuvre que des changements de mode de vie.
Probiotiques
Compte tenu de la relation entre les nombreuses perturbations du système digestif et l’élévation des enzymes hépatiques, il n’est pas surprenant que les probiotiques aient également été étudiés comme traitement de la NAFLD. Une méta-analyse récente résume bien les résultats collectifs.
Cent trente-quatre patients ayant reçu un diagnostic de NAFL/NASH par biopsie hépatique ont été inclus dans cette analyse, et chaque intervention utilisée dans les quatre essais contrôlés randomisés éligibles à cette méta-analyse était unique (Lactobacillus bulgaricus et Streptococcus thermophilus pendant trois mois; Lactobacillus GG pendant huit semaines; Bifidobacterium longum et fructooligosaccharides (FOS) pendant 24 semaines; et une combinaison exclusive de Lactobacillus plantarum, L. delbrueckii, L. acidophilus, L. rhamnosus et Bifidobacterium bifidum pendant six mois). La dose de probiotiques variait de 500 millions à 12 milliards d’unités formant des colonies (UFC) par jour. Les traitements probiotiques ont montré une diminution significative des taux d’ALAT et d’AST de -23,71 UI/L et -19,77 UI/L, respectivement. Des améliorations significatives du taux de cholestérol total, du facteur de nécrose tumorale (TNF)-α et de la résistance à l’insuline ont également été notées.
Deux essais cliniques supplémentaires ont étudié les probiotiques comme traitement de la NAFLD pédiatrique. Dans une étude pilote en double aveugle, contrôlée par placebo, douze enfants, ayant une moyenne d’âge de 10 ans.à l’âge de 7 ans, avec des changements de stéatose hépatique diagnostiqués par échographie et une élévation persistante des transaminases, 12 milliards d’UFC de L. rhamnosus GG ou un placebo ont été administrés quotidiennement pendant 8 semaines. Le traitement par le probiotique a réduit significativement les taux d’ALAT par rapport au placebo, mais l’échogénicité hépatique et les taux d’AST n’ont pas changé. De plus, les anticorps anti-peptidoglycanes-polysaccharides, un indicateur de la translocation bactérienne ou membranaire bactérienne à travers la barrière intestinale, ont considérablement diminué chez les enfants recevant le probiotique par rapport au placebo. La deuxième étude a porté sur le traitement d’enfants ayant une NAFLD prouvée par biopsie avec VSL #3, un mélange à haute puissance de 8 souches probiotiques (dont Streptococcus thermophilus, 3 Bifidobactéries spp., et 4 Lactobacillus spp.), par rapport au placebo. Chez les enfants recevant le probiotique, les scores de stéatose hépatique ont été significativement améliorés, la probabilité d’absence de stéatose hépatique légère, modérée ou sévère à la fin de l’étude étant de 21%, 70%, 9% et 0% par rapport à 0%, 7%, 76% et 17% dans le groupe placebo.
Conclusion
Il existe un large éventail d’options sûres et efficaces qui soutiennent le rétablissement de la santé chez les personnes atteintes de NAFLD. Bien que chaque individu puisse avoir différents mécanismes sous—jacents contribuant à un dysfonctionnement hépatique et à des modifications inflammatoires, chacun de ces agents naturels de soutien — et de nombreux autres (voir tableau 2) – peut soutenir une fonction hépatique normale chez les personnes présentant ces problèmes.
Tableau 2: Interventions nutritionnelles et botaniques pour la NAFLD. Les nutriments tels que ceux-ci doivent être utilisés sous la direction d’un professionnel de la santé qualifié et agréé.
| Nutriment | Dosage | Mécanisme |
| Phosphatidylcholine (PC), une source de choline alimentaire | 1,5 g deux fois par jour aux repas (PC) OU 200 mg deux fois par jour (choline) | La choline est une carence alimentaire courante. Le PC est nécessaire à la production de la bile et de la barrière protectrice de la muqueuse gastro-intestinale. |
| Graines de chardon-marie | 140 à 200 mg une à trois fois par jour | Hépatoprotectrices. Soutient les niveaux de glutathion hépatique, stabilise la pompe d’exportation de sel biliaire (BSEP) et active les voies FXR. |
| Berbérine HCl | 500 mg deux à trois fois par jour | Améliore les profils sériques de glucose et de lipides, réduisant également la teneur en graisse hépatique. |
| Les probiotiques, y compris les souches telles que B. longum, B. bifidum, S. thermophilus, L. rhamnosus, L. acidophilus et L. plantarum | 12 milliards d’unités formant des colonies (UFC) par jour | Amélioration de la fonction de barrière épithéliale intestinale et réduction de l’inflammation intestinale et systémique. |
| Acétyl-glutathion | 300 mg par jour | Améliore la capacité détoxifiante des hépatocytes. |
| N-acétylcystéine (NAC) | 500-600 mg deux fois par jour, à prendre à jeun | La NAC bloque la propagation de la peroxydation lipidique et soutient les niveaux de glutathion hépatique. |
| Vitamine E (tocophérols)
OU Tocotriénols |
400 à 1200 UI par jour avec des aliments
200 à 300 mg deux fois par jour avec des aliments |
Antioxydant protecteur.
Les tocotriénols atténuent l’accumulation de triglycérides en régulant les enzymes de la synthase des acides gras et de la carnitine palmitoyltransférase, ce qui entraîne une réduction de l’inflammation hépatique et du stress du réticulum endoplasmique. |
| Acides gras essentiels oméga-3 | 2 à 4 g par jour, pendant les repas | Les acides gras polyinsaturés oméga-3 sont connus pour réguler à la baisse la protéine-1c liant les éléments régulateurs des stérols et réguler à la hausse le récepteur alpha activé par le proliférateur du peroxysome, favorisant ainsi l’oxydation des acides gras et réduisant la stéatose. |