Introduction
La maladie de la Peyronie (MP) est un trouble du tissu conjonctif localisé et cicatrisant du pénis caractérisé par une cicatrisation de la tunique albuginée. Cette cicatrice inélastique fibreuse entraîne des douleurs péniennes, une déformation du pénis et un dysfonctionnement érectile (ED) avec difficulté à effectuer un coït. François de la Peyronie a décrit la maladie pour la première fois en 1743 alors qu’il était chirurgien de Louis XIV de France. Bien que des études antérieures aient signalé une incidence de 0,3 à 0,7%, des publications récentes ont montré une incidence globale de 3,2 à 8,9%, plus de 75% des cas se produisant chez les hommes âgés de 45 à 65 ans (1,2). Il est à noter que 10 % des patients présentent des symptômes avant l’âge de 40 ans (2). En outre, l’incidence de la MP après une prostatectomie radicale serait aussi élevée que 15,9%, et une étude récente a montré que la courbure du pénis est une constatation courante (38,6%) au moment de la chirurgie d’implantation de prothèse pénienne gonflable pour la dysfonction érectile après un traitement contre le cancer de la prostate (3,4).
Le traitement de la MP commence par un historique ciblé et un examen physique. Une histoire détaillée devrait évaluer les informations sur l’apparition et la durée de la maladie, l’étiologie traumatique associée, le degré de courbure du pénis, la perte de longueur pendant l’érection et le niveau subjectif de la fonction sexuelle. En ce qui concerne l’évaluation sexuelle subjective, des questionnaires standardisés tels que l’Indice International de la fonction Érectile (IIEF) permettent des évaluations initiales objectives et subjectives et un outil de mesure de l’efficacité pendant le traitement. L’examen physique du système génito-urinaire doit inclure la longueur du pénis lorsqu’il est étiré, l’emplacement de la plaque et la taille. Le degré de courbure peut être évalué par le patient en prenant des photographies du phallus érigé ou par des injections vasoactives en combinaison avec une échographie Doppler duplex pénienne.
Il est important de comprendre l’histoire naturelle et la pathogenèse de la MP pour choisir les schémas thérapeutiques appropriés. Bien que la physiopathologie ne soit pas complètement comprise, on suppose que l’événement d’incitation est une déchirure traumatique subclinique de la tunique albuginée. La déchirure entraîne une réaction fibrotique proliférative, entraînant une cicatrice inélastique. Le traitement de la MP est séparé en ceux de la phase aiguë et ceux de la phase de stabilisation chronique. Le temps de phase aiguë est vaguement défini comme étant inférieur à 12 mois à compter de l’apparition des symptômes. Pendant ce temps, la cicatrice du patient continue de se modifier et de changer. La phase chronique est déterminée une fois que la courbure du patient est restée stable pendant au moins 6 mois. Bien que le traitement chirurgical reste l’étalon-or pour la MP, il est principalement offert aux hommes dans la phase chronique de la maladie. Pour les patients en phase aiguë, la pharmacothérapie offre le potentiel d’améliorer la fonction, de réduire la déformation et de stabiliser la progression de la cicatrice (5). Ici, nous passons en revue les connaissances actuelles disponibles concernant les options de traitement oral pour la MP. Il est important de noter que si certaines recommandations énumérées sont fondées sur des constatations fondées sur des données probantes, d’autres reflètent l’opinion d’experts (tableau 1).

Tableau complet
Para-aminobenxoate de potassium (POTABA)
Le POTABA est un composé connu pour ses propriétés antifibrotiques et anti-inflammatoires qui aident au traitement des troubles fibrotiques tels que la dermatomyosite et sclérodermie. On pense que son efficacité est due à une réduction de la formation de collagène via une diminution des niveaux de sérotonine, une augmentation de l’activité de la monoamine oxydase et une inhibition de la sécrétion de glycosaminoglycane de fibroblastes (6). La première utilisation proposée de POTABA pour traiter la MP remonte à 1959 par Zarafonetis et Horrax (7). En 2005, Weidner et coll. réalisation d’un essai multicentrique, randomisé et contrôlé en double aveugle contre placebo de POTABA (51 patients) versus placebo (52 patients) chez des patients atteints de MP naïfs de traitement avec plaque non calcifiée. Le bras d’essai a reçu 3 g de POTABA par voie orale, 4 fois par jour pendant 12 mois. Après 12 mois, les patients sous POTABA présentaient une amélioration significative de la taille de la plaque pénienne par rapport à ceux sous placebo. En outre, les patients recevant un placebo ont noté une aggravation de leur courbure. Les auteurs ont conclu que le POTABA pouvait aider à la stabilisation du tissu cicatriciel, ce qui empêcherait la progression de la courbure (6). Il n’y a pas eu d’autres essais contrôlés randomisés pour évaluer l’efficacité de POTABA. Cela est peut-être dû à son profil d’effets secondaires, qui comprend une détresse gastro-intestinale, une diarrhée, une hépatite aiguë et une hypoglycémie (8).
Vitamine E
La vitamine E, un antioxydant liposoluble, inactive les radicaux libres qui saturent l’oxyde nitrique (NO), maintenant ainsi les niveaux de NO actifs élevés pour permettre une cicatrisation adéquate des plaies. En limitant le stress oxydatif, il offre potentiellement également un effet anti-inflammatoire. Il a été décrit pour la première fois pour le traitement de la PD en 1948 (9) et, en raison de son faible coût et de sa disponibilité, reste l’agent oral le plus fréquemment prescrit pour la PD (10). Malgré son utilisation au cours des sept dernières décennies, plusieurs conceptions contrôlées par placebo n’ont montré aucune amélioration significative de la douleur, du degré de courbure, de la taille de la plaque ou de la capacité à avoir des rapports sexuels. En 1983, Pryor et Farrell ont terminé un essai en double aveugle contrôlé par placebo sur la vitamine E chez 40 patients atteints de MP, et n’ont trouvé aucune amélioration significative de la taille de la plaque ou de la courbure du pénis (11). En outre, une étude plus récente réalisée en 2007 par Safarinejad et al. a fourni le plus grand essai à ce jour évaluant la vitamine E pour la MP. Les auteurs ont comparé la vitamine E seule et en association avec la L-carnitine au placebo chez 236 hommes atteints de MP chronique précoce; classé comme patient souffrant de douleur pendant les érections, de courbure du pénis n’interférant pas avec la pénétration vaginale, de cicatrice palpable non douloureuse, de lésion hyperéchogène lors d’une échographie pénienne, d’absence de calcification et de surface totale de la plaque < 2 cm2. Le groupe 1 (58 hommes) a reçu 300 mg de vitamine E par voie orale deux fois par jour. Le groupe 2 (59 hommes) a reçu de la propionyl-L-carnitine, 1 g par voie orale deux fois par jour. Le groupe 3 (60 hommes) a reçu 300 mg de vitamine E par voie orale deux fois par jour ainsi que 1 g de propionyl-L-carnitine par voie orale deux fois par jour. Enfin, le groupe 4 a reçu un régime similaire de placebo au cours de la période d’essai de 6 mois. Après le traitement, il n’y a pas eu de changement significatif dans la réduction de la courbure du pénis entre les quatre groupes (P = 0,9), ni de diminution de la taille de la plaque (P = 0,1) (12).
Malgré l’absence de preuves prouvant l’efficacité de la vitamine E, elle est encore fréquemment prescrite et souvent administrée en même temps que d’autres modalités de traitement avec l’espoir d’un rôle synergique. Les effets indésirables courants de l’utilisation de vitamine E comprennent des nausées, des vomissements, de la diarrhée et un risque accru de cancer de la prostate et d’événements cérébrovasculaires (13).
Colchicine
Bien que la colchicine soit principalement connue pour son traitement de la goutte, elle présente également des propriétés facilitant le traitement de la MP. La colchicine dépolymérise la tubuline, inhibant ainsi la mitose cellulaire, l’adhésion des leucocytes et le transport du collagène. En appliquant cette propriété, la colchicine devrait théoriquement diminuer la contraction de la plaie en inhibant le dépôt de collagène (14). La plupart des études évaluant la colchicine ont décrit une certaine amélioration de la courbure, mais ces études n’ont pas été randomisées et n’ont pas fourni de mesure objective pour la définition de l’amélioration. Safarinejad et coll. s’est avéré être l’un des rares essais qui ont évalué les effets thérapeutiques de la colchicine en complétant un essai clinique unique, randomisé, en double aveugle, contrôlé par placebo, de 84 patients atteints de MP sans plaques calcifiées (15). Les patients du bras colchicine ont été traités avec 0,5 à 2,5 mg de colchicine par jour pendant 4 mois. À la fin de l’essai, le groupe de colchicine n’a pas démontré d’amélioration objective de la courbure du pénis ou de la taille de la plaque. D’autres études ont évalué les effets synergiques de la colchicine avec la vitamine E. Prieto Castro et al. amélioration significative de la taille de la plaque et de la courbure du pénis chez les patients utilisant quotidiennement de la vitamine E et de la colchicine par rapport à l’ibuprofène seul (16). Il est à noter qu’il n’y avait que 45 patients dans cet essai et qu’il n’y avait pas de bras placebo. Cependant, une étude rétrospective ultérieure de 100 hommes n’a révélé aucune différence statistiquement significative d’efficacité pour le soulagement de la douleur, la courbure du pénis ou la taille de la plaque entre la colchicine et la colchicine associée à la vitamine E (17).
Tamoxifène
Le tamoxifène est un antagoniste des récepteurs des œstrogènes non stéroïdiens. Dans le traitement de la PD, il a été montré qu’il diminuait la fibrogenèse dans la tunique albuginée en modulant la libération de TGF-β libéré par le fibroblaste (18). Ralph et coll. son traitement a été proposé pour la première fois en 1992 à la suite d’une étude non contrôlée qui a démontré une amélioration de la déformation du pénis chez 11 hommes sur 31. Cependant, ces résultats n’étaient pas reproductibles lorsque le tamoxifène a été évalué dans un essai prospectif contrôlé contre placebo chez 25 patients atteints de MP sans plaques calcifiées. Malgré l’utilisation de 20 mg de tamoxifène deux fois par jour, il n’y a pas eu d’amélioration significative de la douleur, de la courbure ou de la taille de la plaque par rapport au placebo (19).
Carnitine
La carnitine est un inhibiteur de l’acétyl-coenzyme-A qui permet de diminuer la formation de radicaux libres pendant les périodes de stress cellulaire. En 2001, Biagiotti et coll. réalisation d’un essai randomisé de 96 patients atteints de MP avec L-carnitine contre tamoxifène. Les résultats ont montré une amélioration significative de la courbure du pénis dans le groupe L carnitine (20). Comme mentionné ci-dessus, l’essai Safarinejad 2007 à 4 bras (vitamine E, carnitine, vitamine E et carnitine, et placebo) n’a révélé aucune amélioration significative de la courbure du pénis, de la taille de la plaque ou de la douleur (12).
Acide gras oméga-3
Comme d’autres agents oraux, les acides gras oméga-3 ont été évalués dans le traitement de la PD en raison de ses propriétés anti-inflammatoires connues. En 2009, Safarinejad et al. publié leurs résultats sur un essai prospectif randomisé en double aveugle sur les acides gras oméga-3 contre placebo. Un total de 224 patients atteints de MP au stade chronique précoce ont été randomisés à 1.84 g de supplémentation quotidienne en oméga-3 par rapport au placebo pendant 6 mois. Les patients ont été évalués avec IIEF-5 et PDDU avant et après les 6 mois de traitement. Malheureusement, il n’y a pas eu d’amélioration significative en ce qui concerne le volume de la plaque, la courbure du pénis, la douleur pendant l’érection et la fonction érectile (21). Actuellement, il y a un manque de données pour soutenir un effet bénéfique de la supplémentation en oméga-3 au stade précoce chronique de la MP.
Procarbazine
La procarbazine est un médicament de chimiothérapie alkylante souvent utilisé pour traiter le lymphome du SNC, le lymphome de Hodgkin et les gliomes de haut grade. En 1968, Aron et al. a noté une régression de la maladie de Dupuytren chez des patients sous traitement de la maladie de Hodgkin par la procarbazine, suggérant ainsi son utilisation dans une maladie à prolifération du tissu conjonctif (22). Avec cette prémisse, dans les années 1970, Byström a proposé la procarbazine pour le traitement de la MP, mais les études ultérieures n’ont révélé aucun bénéfice objectif. En outre, des études ont révélé des effets secondaires importants du médicament cytotoxique, et il a été recommandé de ne pas l’utiliser dans la maladie bénigne de la MP. Les effets secondaires incluent la myélosuppression, l’hépatotoxicité, la fatigue, la détresse gastro-intestinale et la perturbation du SNC (23,24).
Inhibiteurs de la phosphodiestérase de type 5 (inhibiteurs de la PDE-5)
Bien que les inhibiteurs de la PDE-5 soient généralement considérés comme un traitement de la dysfonction érectile, des études récentes ont montré son utilisation potentielle dans le traitement de la PD chez les patients avec ou sans DE. Les inhibiteurs de la PDE-5 augmentent la guanosine monophosphate cyclique (cGMP) en inhibant la dégradation du cGMP en GMP. Avec l’augmentation du cGMP et du NO, la synthèse et le dépôt de collagène sont inhibés et l’apoptose du fibroblaste et du myofibroblaste se produit (25). En raison de cette propriété, les inhibiteurs de la PDE-5 peuvent s’avérer avantageux pour le remodelage des cicatrices. Dans un modèle de PD chez le rat, il a été démontré que le sildénafil entraînait une réduction significative du rapport collagène/ fibroblastes dans la tunique albuginée ainsi que de la taille de la plaque (25). Chung et ses collègues étudient l’utilisation du tadalafil pour le traitement de la MP chez des sujets humains. Ils ont signalé que 2.5 mg de tadalafil par jour pendant 6 mois ont entraîné la résolution de la cicatrice septale chez 69% (24/35) des patients sans plaque pénienne palpable. Seulement 10% du bras non traité a noté une résolution de la cicatrice. Il est important de mentionner que la cicatrice septale n’était pas cliniquement palpable et que la plupart des patients de cette étude n’avaient pas de courbure (26). Plus récemment, une étude de 2014 a rapporté les résultats du traitement de patients atteints de PD utilisant 50 mg de sildénafil par jour ou 400 UI de vitamine E pendant 3 mois. Après 12 semaines, les deux groupes ont montré une réduction similaire du volume de la plaque et de la courbure du pénis qui était statistiquement significative. Les différences entre les deux groupes n’étaient cependant pas statistiquement significatives. La cohorte de sildénafil a montré une amélioration statistiquement significative des scores IIEF et une réduction de la douleur par rapport à la vitamine E seule (27). Un essai placebo à grande échelle en double aveugle devrait être réalisé et valider le bénéfice clinique de l’inhibiteur de la PDE-5, mais les recherches actuelles sont prometteuses (tableau 2).
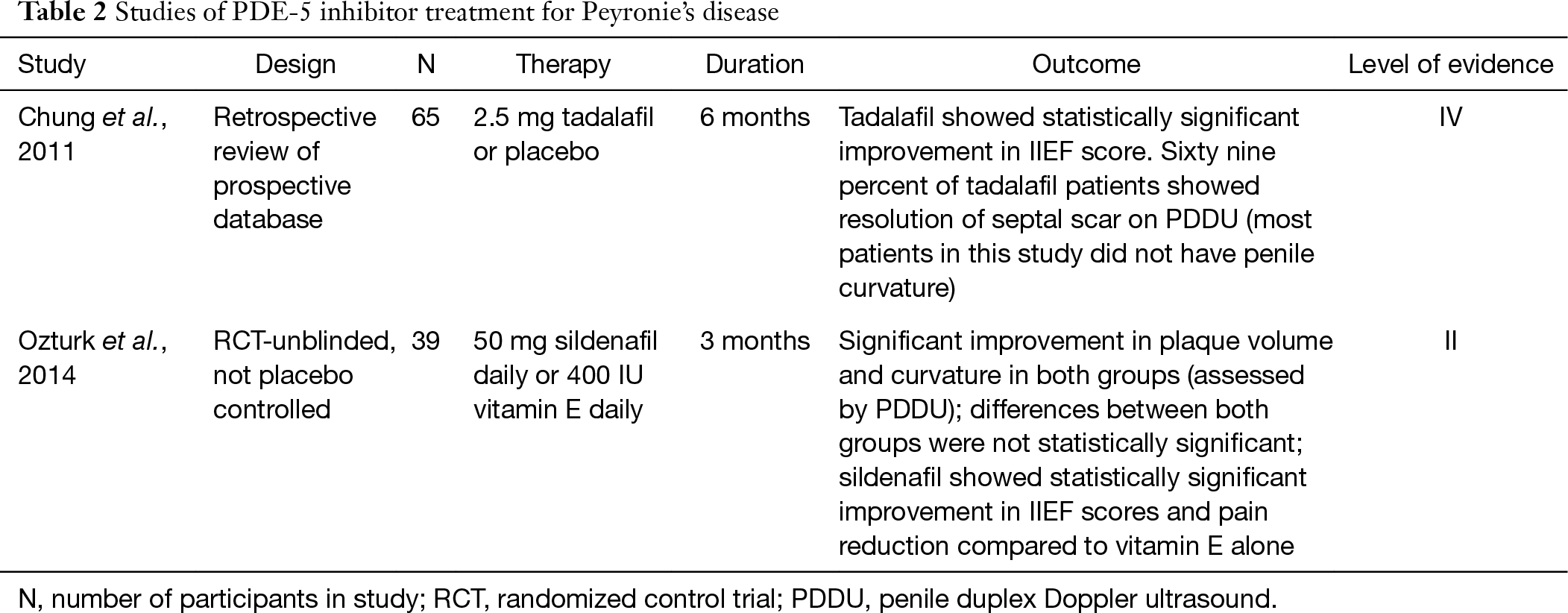
Tableau complet
L-arginine
La L-arginine est un précurseur de la NO qui stimule la NO synthase. Cela provoque une augmentation du NO, ainsi qu’une réduction du fibroblaste due à l’apoptose. On pense que ces deux propriétés sont les mécanismes derrière la L-arginine en tant qu’agent antifibrotique (25). Comme mentionné précédemment, Valente et coll. évaluation des plaques péniennes chez des modèles de rats traités avec des inhibiteurs de la PDE-5, mais aussi avec de la l-arginine. De même que les inhibiteurs de la PDE-5, la L-arginine a présenté une réduction significative de la taille de la plaque ainsi que du rapport collagène / fibroblastes (25). Une étude ultérieure de Medeiros et al. a démontré que l’arginine a également un effet protecteur contre la formation de tissu cicatriciel lors de la soumission du pénis de rats à un rayonnement pelvien (28). En 2012, Abern et coll. a noté une tendance à l’amélioration de la courbure chez les patients atteints de MP traités par traction pénienne en association avec le vérapamil intralésionnel, la L-arginine orale et la pentoxifylline orale (PTX) (29). Bien que cette étude comporte de nombreuses variables qui pourraient contribuer à l’amélioration de la courbure, elle s’avère être l’un des rares essais humains dans lesquels la L-arginine a été utilisée pour traiter la MP. Compte tenu de ces résultats, la L-arginine peut s’avérer être une option de traitement précieuse pour la MP, mais d’autres essais humains sont nécessaires.
Pentoxifylline (PTX)
Bien que la plupart des médicaments oraux étudiés pour le traitement de la MP aient montré des résultats médiocres ou indéterminés dans des études contrôlées, le PTX s’en est beaucoup mieux tiré. Le PTX est un dérivé de la xanthine qui fonctionne comme un inhibiteur de la phosphodiestérase non spécifique aux propriétés anti-inflammatoires et anti-fibrogènes connues (30). Il a été proposé pour le traitement de la PD en raison d’une étude in vitro montrant qu’il empêche la prolifération des fibroblastes tunica albuginea, atténue le dépôt de collagène médié par le TGF-B, réduit le dépôt d’élastine et augmente l’activité fibrinolytique (31-33). Compte tenu de ces propriétés, une étude en double aveugle contrôlée contre placebo menée en 2010 a cherché à déterminer l’effet du PTX chez les patients atteints de MP chronique précoce (30). Deux cent vingt-huit patients ont été randomisés pour recevoir 400 mg de PTX à libération prolongée par rapport au placebo pendant 6 mois. La plupart des participants avaient échoué au moins un traitement antérieur de la MP. Le groupe placebo était 4 fois plus susceptible (42 %) d’avoir une progression de la maladie que le groupe traité (11 %). En outre, le groupe PTX a montré une amélioration significative des mesures objectives et subjectives; (I) amélioration de la courbure du pénis mesurée par échographie duplex avant et après l’injection corporelle de prostaglandine E1; (II) volume de la plaque et (III) scores IIEF (30). Des études plus récentes ont évalué le PTX par voie orale en association avec des antioxydants par voie orale, le PTX intralésionnel et le vérapamil intralésionnel avec des résultats variables (34,35). Bien que le PTX reste un concurrent important pour le traitement de la MP, d’autres essais multicentriques de grande envergure devront être conclus pour garantir la reproductibilité des résultats (tableau 3).

Tableau complet
Conclusions
Malgré des décennies de recherche sur la MP, l’étiologie et la physiopathologie définitives n’ont pas été complètement élucidées. Alors que la thérapie chirurgicale reste la référence en matière de MP chronique sévère, il existe une myriade d’autres options de traitement moins invasives, à savoir les médicaments oraux et intralésionnels. Ici, nous avons passé en revue les agents oraux les plus couramment prescrits ou discutés pour le traitement de la MP. Bien qu’un certain nombre d’études bien conçues aient découvert des réponses positives avec des médicaments oraux, leur petite taille d’échantillon limite la puissance et la reproductibilité de l’étude. Actuellement, les directives de l’American Urological Association stipulent que les cliniciens ne devraient pas offrir de traitement oral avec de la vitamine E, du tamoxifène, de l’acide gras oméga-3 ou une combinaison de vitamine E avec de la L-carnitine. De même, la Consultation internationale sur la médecine sexuelle de 2010 n’a pas soutenu l’utilisation clinique systématique d’agents oraux pour la MP (5). Deux médicaments oraux non limités par les lignes directrices sont les inhibiteurs de la PDE-5 et le PTX. D’autres recherches sur le PDE-5 et le PTX, pour inclure de grands essais multicentriques à double insu, randomisés, sont nécessaires pour déterminer leur efficacité. Les deux classes de médicaments donnent espoir à l’absence de médicaments oraux autorisés pour le traitement de la MP.
Remerciements
Aucun.
Note de bas de page
Conflits d’intérêts : Les auteurs n’ont aucun conflit d’intérêts à déclarer.
- Mulhall JP, Creech SD, Boorjian SA, et al. Analyse subjective et objective de la prévalence de la maladie de la Peyronie dans une population d’hommes se présentant pour un dépistage du cancer de la prostate. J Urol 2004; 171:2350-3.
- Mulhall JP, Schiff J, Guhring P. Une analyse de l’histoire naturelle de la maladie de la Peyronie. J Urol 2006;175:2115-8; discussion 2118.
- Tal R, Heck M, Teloken P, et al. Maladie de la Peyronie suite à une prostatectomie radicale: incidence et prédicteurs. J Sexe Med 2010; 7: 1254-61.
- Lin H, Alba F, Romero C, et al. 1815 la courbure du pénis est une découverte courante lors de l’implantation de la prothèse pénienne chez les patients atteints de dysfonction érectile après une prostatectomie radicale. J Urol 2011; 185: e728-e729.
- Ralph D, Gonzalez-Cadavid N, Mirone V, et al. La prise en charge de la maladie de la Peyronie : lignes directrices 2010 fondées sur des données probantes. J Sexe Med 2010; 7: 2359-74.
- Weidner W, Hauck EW, Schnitker J, et al. paraaminobenzoate de potassium (POTABA) dans le traitement de la maladie de la Peyronie: une étude prospective, contrôlée par placebo et randomisée. Eur Urol 2005; 47:530-5; discussion 535-6.
- Zarafonetis CJ, Horrax TM. Traitement de la maladie de la Peyronie avec du para-aminobenzoate de potassium (potaba). J Urol 1959; 81:770-2.
- Roy J, Carrier S. Hépatite aiguë associée au traitement de la maladie de la Peyronie par le para-aminobenzoate de potassium (Potaba). J Sexe Med 2008; 5:2967-9.
- Scott WW, Scardino PL. Un nouveau concept dans le traitement de la maladie de la Peyronie. Med Sud J 1948; 41:173-7.
- Levine LA, Burnett AL. Procédures opératoires normalisées pour la maladie de la Peyronie. J Sexe Med 2013; 10:230-44.
- Pryor JP, Farrell CF. Essai clinique contrôlé de vitamine E dans la maladie de la Peyronie. Prog Reprod Biol 1983; 9:41-5.
- Safarinejad MR, Hosseini SY, Kolahi AA. Comparaison de la vitamine E et de la propionyl-L-carnitine, séparément ou en association, chez des patients atteints de la maladie chronique précoce de la Peyronie: étude randomisée à double insu contrôlée par placebo. J Urol 2007;178:1398-403; discussion 1403.
- Klein EA, Thompson IM Jr, Tangen CM, et al. La vitamine E et le risque de cancer de la prostate: l’essai de prévention du cancer au sélénium et à la vitamine E (SELECT). JAMA 2011; 306:1549-56.
- El-Sakka AI, Bakircioglu ME, Bhatnagar RS, et al. Les effets de la colchicine sur une condition semblable à celle de la Peyronie dans un modèle animal. J Urol 1999; 161:1980-3.
- Safarinejad MR. Effets thérapeutiques de la colchicine dans la prise en charge de la maladie de la Peyronie: une étude randomisée en double aveugle contrôlée par placebo. Int J Impot Res 2004; 16:238-43.
- Prieto Castro RM, Leva Vallejo ME, Regueiro Lopez JC, et al. Traitement combiné avec de la vitamine E et de la colchicine dans les premiers stades de la maladie de la Peyronie. BJU Int 2003; 91:522-4.
- Cortés-González JR, Glina S. Traitement conservateur de la maladie de la Peyronie: colchicine vs colchicine plus vitamine E. Actas Urol Esp 2010; 34: 444-9.
- Ralph DJ, Brooks MD, Bottazzo GF, et al. Le traitement de la maladie de la Peyronie par le tamoxifène. Br J Urol 1992; 70:648-51.
- Teloken C, Rhoden EL, Grazziotin TM, et al. Tamoxifène contre placebo dans le traitement de la maladie de la Peyronie. J Urol 1999; 162:2003-5.
- Biagiotti G, Cavallini G. Acétyl-L-carnitine vs tamoxifène dans le traitement oral de la maladie de la Peyronie: rapport préliminaire. BJU Int 2001; 88:63-7.
- Safarinejad MR. Efficacité et innocuité des oméga-3 pour le traitement de la maladie de la Peyronie à un stade précoce: Une étude prospective, randomisée et contrôlée par placebo en double aveugle. J Sexe Med 2009; 6: 1743-54.
- Aron E. Traitement médical de la maladie de Dupuytren avec un agent cytostatique (méthylhydrazine). Presse Med 1968; 76:1956.
- Byström J, Johansson B, Edsmyr F, et al. Induratio penis plastica (maladie de la Peyronie). Les résultats des différentes formes de traitement. Scand J Urol Nephrol 1972; 6:1-5.
- Oosterlinck W, rend G. Traitement de la maladie de la Peyronie par procarbazine. Br J Urol 1975; 47:219-20.
- Valente EG, Vernet D, Ferrini MG, et al. Les inhibiteurs de la L-arginine et de la phosphodiestérase (PDE) neutralisent la fibrose de la plaque fibrotique de la Peyronie et des cultures de fibroblastes associées. Oxyde nitrique 2003; 9:229-44.
- Chung E, Deyoung L, Brock GB. Le rôle des inhibiteurs de la PDE5 dans le remodelage des cicatrices septales du pénis: évaluation des résultats cliniques et radiologiques. J Sexe Med 2011; 8:1472-7.
- Ozturk U, Yesil S, Goktug HN, et al. Effets du traitement par le sildénafil sur les patients atteints de la maladie de la Peyronie et de dysfonction érectile. Ir J Med Sci 2014; 183:449-53.
- Medeiros JL Jr, Costa WS, Felix-Patricio B, et al. Effets protecteurs de la supplémentation nutritionnelle en arginine et en glutamine sur le pénis des rats soumis à une radiothérapie pelvienne. Andrologie 2014; 2:943-50.
- Abern MR, Larsen S, Levine LA. Combinaison de traction pénienne, de vérapamil intralésionnel et de thérapies orales pour la maladie de la Peyronie. J Sexe Med 2012; 9:288-95.
- Safarinejad MR, Asgari MA, Hosseini SY, et al. Une étude contrôlée par placebo en double aveugle de l’efficacité et de l’innocuité de la pentoxifylline dans la maladie chronique précoce de la Peyronie. BJU Int 2010; 106:240-8.
- Raetsch C, Jia JD, Boigk G, et al. La pentoxifylline régule à la baisse les cytokines profibrogènes et l’expression du procollagène I dans la fibrose biliaire secondaire du rat. Gut 2002; 50:241-7.
- Schandené L, Vandenbussche P, Crusiaux A, et al. Effets différentiels de la pentoxifylline sur la production de facteur denécrose tumorale alpha (TNF-alpha) et d’interleukine-6 (IL-6) par les monocytes et les cellules T. Immunologie 1992; 76:30-4.
- Shindel AW, Lin G, Ning H, et al. La pentoxifylline atténue le dépôt de collagène stimulé par le facteur de croissance β1 et l’élastogenèse dans les fibroblastes dérivés de tunica albuginée humaine partie 1: impact sur la matrice extracellulaire. J Sexe Med 2010; 7: 2077-85.
- Paulis G, Barletta D, Turchi P, et al. Évaluation de l’efficacité et de la sécurité de la pentoxifylline associée à d’autres antioxydants dans le traitement médical de la maladie de la Peyronie: une étude cas-témoin. Res Rep Urol 2015; 8:1-10.
- Alizadeh M, Karimi F, Fallah M. Evaluation de l’efficacité du vérapamil dans la maladie de la Peyronie en comparaison avec la pentoxifylline. Glob J Health Sci 2014; 6:23-30.
- Smith JF, Shindel AW, Huang YC, et al. Traitement à la pentoxifylline et calcifications péniennes chez les hommes atteints de la maladie de la Peyronie. J Androl asiatique 2011; 13:322-5.