La lèpre est une maladie infectieuse chronique causée par Mycobacterium leprae. Il endommage les nerfs périphériques et peut affecter la peau, les yeux, le nez et les muscles. Une lésion nerveuse dans la lèpre peut provoquer de graves déformations invalidantes.
Bien qu’elle soit souvent considérée comme une maladie des temps anciens, elle existe encore aujourd’hui et l’Organisation mondiale de la Santé a enregistré 3,8 millions de nouveaux cas de lèpre dans 105 pays différents au cours de la dernière décennie. La lèpre n’est que rarement signalée en Europe aujourd’hui, mais elle était autrefois répandue dans toute la région et peut encore survenir chez les personnes qui vivent ou travaillent à l’étranger dans des pays endémiques. Les personnes atteintes de lèpre souffrent souvent d’une stigmatisation sociale profonde en raison de leur maladie, et la lèpre impose d’énormes charges économiques et psychologiques aux individus et aux systèmes de santé.
La lèpre (également connue sous le nom de maladie de Hansen) est considérée comme une maladie tropicale négligée. Il s’agit d’une infection rare, généralement présente chez moins de 1:10 000 personnes dans la plupart des populations, et souvent associée à la pauvreté. Le plus grand nombre de nouveaux cas aujourd’hui provient de l’Asie du Sud-Est, des Amériques et de l’Afrique. La lèpre est curable avec un traitement antibiotique multiple, généralement composé de rifampine, de dapsone et de clofazimine. La détection et le traitement précoces peuvent aider à éviter de nombreuses complications invalidantes de la lèpre. Bien que plusieurs essais prototypes soient en cours de développement, il n’existe actuellement aucun test de dépistage en laboratoire pour faciliter la détection précoce de la lèpre, et la maladie doit être diagnostiquée cliniquement.
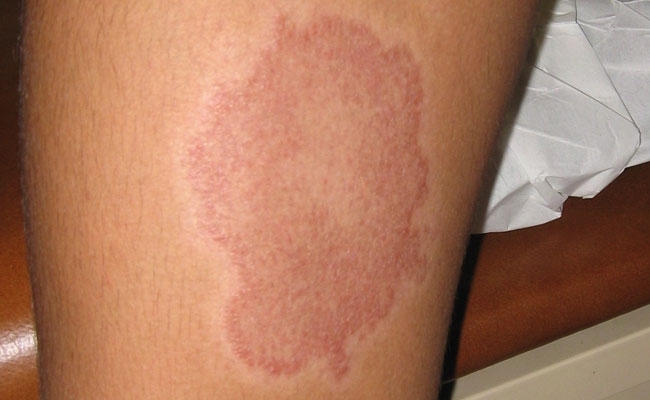
- FIG. 1. LÉSION DE LÈPRE TUBERCULOÏDE BORDERLINE SUR LES MEMBRES INFÉRIEURS. LE CENTRE DE CETTE LÉSION ÉTAIT ANESTHÉSIQUE.
- Caractéristiques cliniques
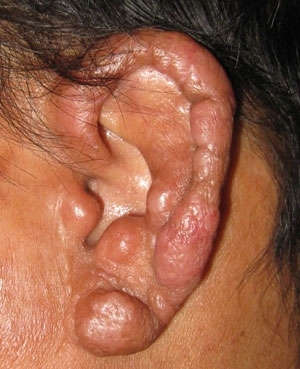
- FIG. 2. LÉSION DE LÈPRE LÉPROMATEUSE MANIFESTE SUR L’OREILLE. D’ABONDANTS BACILLES INTRACELLULAIRES ACIDO-RAPIDES ÉTAIENT PRÉSENTS DANS CE TISSU, UN SITE FRAIS FAVORABLE À LA CROISSANCE DE M. LEPRAE.
- Lésion nerveuse
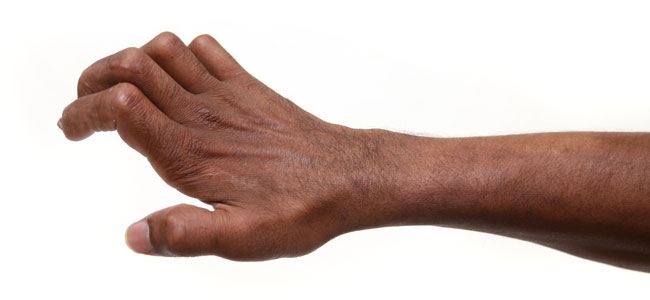
- FIG. 4. MAIN GRIFFUE RÉSULTANT D’UNE LÉSION AVANCÉE DU NERF ULNAIRE DUE À LA LÈPRE.
- Parasite intracellulaire
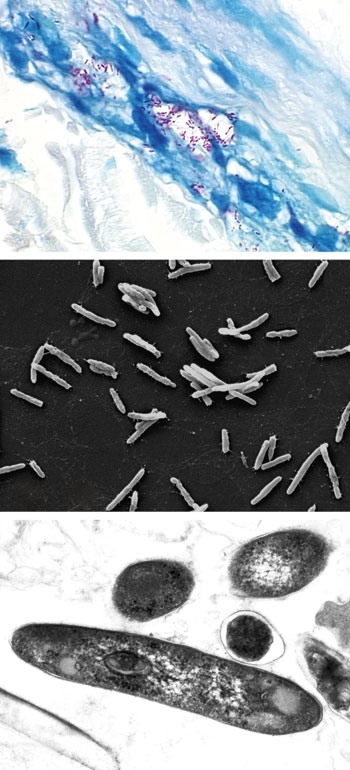
- FIG. 5. (A) SECTION DE PEAU TACHÉE DE FITE MONTRANT M. LEPRAE (ROUGE) DANS UN NERF CUTANÉ, CARACTÉRISTIQUE PATHOGNOMONIQUE DE LA PATHOLOGIE DE LA LÈPRE. B) MICROGRAPHIE ÉLECTRONIQUE À BALAYAGE DE M. LEPRAE. BARRE, 5 MM. (C) MICROGRAPHIE ÉLECTRONIQUE EN TRANSMISSION DE M. LEPRAE EN COUPE TRANSVERSALE. BARRE, 250 NM.
- Tatous
- FIG. 6. TATOU À NEUF BANDES (DASYPUS NOVEMCINCTUS).
- Vaccins et diagnostics
- RICHARD TRUMAN, RAHUL SHARMA, MARIA PENA, BARBARA STRYJEWSKA, JOHN FIGAROLA & DAVID SCOLLARD
- POUR EN SAVOIR PLUS
FIG. 1. LÉSION DE LÈPRE TUBERCULOÏDE BORDERLINE SUR LES MEMBRES INFÉRIEURS. LE CENTRE DE CETTE LÉSION ÉTAIT ANESTHÉSIQUE.
Caractéristiques cliniques
La lèpre n’est pas très contagieuse. La susceptibilité à la lèpre semble être d’origine génétique et 95% de toutes les personnes semblent être naturellement résistantes à la maladie. Les personnes qui développent la lèpre incubent généralement l’infection pendant 3 à 5 ans avant de manifester la maladie, et elles présentent un large spectre de réponses cliniques et histopathologiques à l’infection déterminées par leur réponse immunologique à Mycobacterium leprae. Dans la partie tuberculoïde du spectre, les personnes présentent peu de lésions discrètes constituées de granulomes bien organisés avec un petit nombre de bacilles (Fig. 1). Alors que ceux de la partie lépromateuse du spectre peuvent présenter plusieurs lésions nodulaires ou diffuses (Fig. 2) contenant de nombreux bacilles dans des granulomes mal organisés. Cependant, la caractéristique pathologique la plus importante commune à toutes les formes de lèpre est l’atteinte et les lésions du système nerveux périphérique (SNP).
FIG. 2. LÉSION DE LÈPRE LÉPROMATEUSE MANIFESTE SUR L’OREILLE. D’ABONDANTS BACILLES INTRACELLULAIRES ACIDO-RAPIDES ÉTAIENT PRÉSENTS DANS CE TISSU, UN SITE FRAIS FAVORABLE À LA CROISSANCE DE M. LEPRAE.
Lésion nerveuse
M. leprae a la capacité remarquable d’envahir les cellules de Schwann du nerf périphérique, qui enferment et soutiennent les axones des neurones sensoriels et moteurs. L’infection cellulaire de Schwann provoque de nombreuses altérations biologiques et pathologiques complexes, notamment la démyélinisation, la dé-différenciation et la reprogrammation des cellules. Les axones non protégés par les cellules de Schwann sont vulnérables aux blessures et peuvent être détruits par la réponse inflammatoire de l’hôte à M. leprae. Généralement, les petits neurones sensoriels non myélinisés et myélinisés sont affectés en premier, et à mesure que la maladie progresse, les motoneurones et les muscles peuvent également être compromis. Les patients perdent la sensation dans les zones touchées par la lèpre. Ils ne peuvent souvent pas discerner la différence entre le chaud et le froid, et l’anesthésie des mains et des pieds contribue de manière significative à l’ulcération sous pression (Fig. 3, en haut) et des lésions traumatiques et des infections secondaires, qui peuvent entraîner la perte de chiffres et d’autres conséquences graves. Si le traitement n’est pas interrompu, une lésion nerveuse peut évoluer vers une faiblesse motrice et une paralysie des muscles intrinsèques des doigts ou des orteils, entraînant une invalidité à vie (Fig. 4).
FIG. 4. MAIN GRIFFUE RÉSULTANT D’UNE LÉSION AVANCÉE DU NERF ULNAIRE DUE À LA LÈPRE.
Il existe encore de grandes lacunes dans notre compréhension de la neuropathogenèse de la lèpre. Les nerfs périphériques servent non seulement de cible principale pour l’infection à M. leprae, mais servent également de refuge pour le bacille, car la barrière sang–nerf protège l’organisme contre de nombreuses réponses immunitaires de l’hôte. M. leprae semble tirer parti de la remarquable capacité de régénération du SNP adulte pour sécuriser sa niche préférée, et la régénération des nerfs périphériques endommagés se poursuit même après le traitement chez les patients atteints de lèpre avancée. Les lésions nerveuses peuvent évoluer progressivement pendant toute la durée de la maladie et peuvent être irréversibles.
Parasite intracellulaire
M. leprae est un pathogène de niche très adapté. Il est faiblement acide (Fig. 5). Son génome a connu une évolution réductrice drastique. À seulement 3 ans.3Mbp il a le plus petit génome parmi les mycobactéries, et les pseudogènes non fonctionnels occupent également près de la moitié du chromosome. Cette perte de fonctionnalité sous-tend probablement notre incapacité continue à cultiver l’organisme sur des milieux de laboratoire artificiels, et influence probablement le temps de génération remarquablement long de l’organisme (12,5 jours). M. leprae préfère les températures fraîches. Les lésions sur les patients se trouvent généralement dans des zones plus froides de la peau. La viabilité de M. leprae diminue rapidement à des températures supérieures à 35 °C. La plupart des animaux éliminent facilement les bacilles et ne peuvent pas être infectés expérimentalement par M. leprae. leprae. Une réplication limitée peut être obtenue après l’inoculation de M. leprae dans les coussinets postérieurs des souris conventionnelles et athymiques. Cependant, les bacilles ne se développeront pas lorsqu’ils seront inoculés de manière systémique et les augmentations exponentielles de la croissance nécessitent de nombreux mois pour atteindre. L’infection chez la souris n’implique pas les nerfs de l’animal. Le seul animal qui résume de manière fiable la lèpre observée chez l’homme et développe une atteinte neurologique étendue avec M. leprae est le tatou à neuf bandes (Dasypus novemcinctus). Outre les humains, les tatous sont également les seuls hôtes naturels de M. leprae.
FIG. 5. (A) SECTION DE PEAU TACHÉE DE FITE MONTRANT M. LEPRAE (ROUGE) DANS UN NERF CUTANÉ, CARACTÉRISTIQUE PATHOGNOMONIQUE DE LA PATHOLOGIE DE LA LÈPRE. B) MICROGRAPHIE ÉLECTRONIQUE À BALAYAGE DE M. LEPRAE. BARRE, 5 MM. (C) MICROGRAPHIE ÉLECTRONIQUE EN TRANSMISSION DE M. LEPRAE EN COUPE TRANSVERSALE. BARRE, 250 NM.
Tatous
Les tatous sont des animaux exotiques de la taille des chats domestiques (fig. 6). Avec une peau épaisse et dure et une carapace dure et flexible qui protège la majeure partie de leur corps, Rudyard Kipling a suggéré que les tatous étaient un mélange d’une tortue et d’un porc-épic. Ce sont des mammifères de l’ordre des Xénarthres, et apparentés aux paresseux et aux fourmiliers. Leur température corporelle normale varie de 33 à 35 ° C, et c’est ce trait qui a d’abord attiré l’attention des chercheurs sur la lèpre. L’infection expérimentale des tatous par M. leprae nécessite de 18 à 24 mois pour se manifester comme une maladie entièrement disséminée, mais des quantités prolifiques (1012) de bacilles peuvent être récoltées sur un seul animal, et les tatous sont les hôtes de choix pour la propagation des bacilles de la lèpre. Les quantités remarquables de M. leprae mis à disposition par tatous ont été une aubaine pour la recherche sur la lèpre.
Peu de temps après la découverte initiale de la sensibilité unique du tatou à une infection expérimentale, une mycobactériose systémique d’origine naturelle a également été trouvée chez les tatous en liberté aux États-Unis. Des études ultérieures ont confirmé que les tatous sauvages sont un grand réservoir pour M. leprae et que les animaux avaient nourri une infection naturelle par M. leprae pendant de nombreuses décennies avant d’être utilisés dans la recherche sur la lèpre. La lèpre n’était pas présente dans le Nouveau Monde à l’époque précolombienne, et il est raisonnable de supposer que les tatous ont dû avoir contracté l’infection des humains au cours des derniers siècles. Ils sont maintenant reconnus comme le seul réservoir non humain de M. leprae et font partie de l’écologie naturelle de la maladie aux États-Unis. Des rapports récents indiquent que la transmission zoonotique de M. leprae par des tatous est responsable de jusqu’à 64% de tous les cas de lèpre chez les personnes nées aux États-Unis. Les tatous vont du sud des États-Unis à l’Argentine en passant par l’Amérique latine et les biomarqueurs de M. des lepraes ont été observés chez certains tatous d’Amérique du Sud. Le rôle que les tatous pourraient jouer dans la perpétuation de la lèpre dans les Amériques est actuellement à l’étude.
FIG. 6. TATOU À NEUF BANDES (DASYPUS NOVEMCINCTUS).

Vaccins et diagnostics
On pense généralement que M. leprae se transmet de personne à personne par voie respiratoire, et les stratégies de contrôle mondiales actuelles se concentrent sur le traitement antibiotique des cas actifs pour guérir l’infection et interrompre la transmission. Cependant, les preuves s’accumulent qu’un réservoir occulte de cas asymptomatiques précliniques, et peut-être des tatous ou d’autres hôtes environnementaux, peut jouer un rôle plus important dans l’écologie de la maladie, et la lèpre ne peut probablement pas être éliminée par le seul traitement médicamenteux. Le contrôle de la lèpre par vaccination ou immunothérapie en complément d’un traitement médicamenteux peut présenter des avantages significatifs par rapport au contrôle par traitement médicamenteux seul. Depuis 2002, un consortium de fondations philanthropiques promeut la recherche sur de nouveaux tests diagnostiques et un prototype de vaccin. Des scientifiques du monde entier sont engagés dans ces efforts et leurs produits commencent maintenant à être mis à l’essai. Si la technologie triomphe, nous pourrons enfin mettre fin aux souffrances causées par l’une des plus anciennes maladies mycobactériennes connues.
RICHARD TRUMAN, RAHUL SHARMA, MARIA PENA, BARBARA STRYJEWSKA, JOHN FIGAROLA & DAVID SCOLLARD
Département de la Santé et des Services sociaux des États-Unis, Administration des Ressources et des Services de Santé, Bureau des systèmes de Santé, Programme national des maladies de Hansen, Baton Rouge, Louisiane, États-Unis
POUR EN SAVOIR PLUS
Masaki, T. & autres (2013). La reprogrammation de cellules de Schwann adultes en cellules semblables à des cellules souches par des bacilles de la lèpre favorise la dissémination de l’infection. Cellule 152, 51-67.
Monot, M. & autres (2009). Analyse génomique et phylogéographique comparative de Mycobacterium leprae. Nat Genet 41, 1282-1289.
Rodrigues, L. C. & Lockwood, D. (2011). La lèpre maintenant: épidémiologie, progrès, défis et lacunes dans la recherche. Lancette Infecte Dis 11, 464-470.
Scollard, D. M. & autres (2006). Les défis continus de la lèpre. Clin Microbiol Rev 19, 338-381.
Truman, R. W. & autres (2011). Lèpre zoonotique probable dans le sud des États-Unis. N Engl J Med 364, 1626-1633.