Prove Dietro Naturali Interventi per la Non-alcolica Malattia del Fegato Grasso: Botaniche, Nutrienti, e Probiotici per il Trattamento di Questa Comune Malattia
Dato l’aumento analcoliche steatosi epatica (NAFLD), negli adulti e la pediatria e la mancanza di un indicato trattamento farmaceutico,, strategie naturali per il trattamento di questa condizione di stand ben equilibrata come la “prossima cosa migliore.”Diversi integratori alimentari e botanici sono stati studiati clinicamente e mostrano promesse per il trattamento della NAFLD e della sua controparte infiammatoria, la steatoepatite non alcolica (NASH). Dato il numero di queste terapie affrontare i fattori che contribuiscono allo sviluppo di NAFLD, non ci vuole molto ragionamento per capire come possono affrontare efficacemente alcune delle cause alla radice della malattia, piuttosto che affrontare solo un sintomo.
Cinque interventi supplementari con evidenza clinica o epidemiologica per il loro uso nell’ambito di NAFLD sono fosfatidil colina, che fornisce fosfolipidi e colina, vitamina E, sia come alfa tocoferoli e una miscela di delta e gamma tocotrienoli, estratto di semi di cardo mariano, berberina e probiotici.
- Alterazioni del fegato grasso: correlate a una carenza di fosfatidil colina?
- Vitamina E
- Cardo mariano
- Berberina
- Probiotici
- Conclusione
- Dr. Carrie Decker, ND laureato con lode presso il National College of Natural Medicine (ora la National University of Natural Medicine) a Portland, Oregon. Il Dott. Decker vede i pazienti a distanza, con particolare attenzione alle malattie gastrointestinali, squilibri dell’umore, disturbi alimentari, malattie autoimmuni e stanchezza cronica. Prima di diventare un medico naturopata, Dr. Decker era un ingegnere, e ha ottenuto lauree in ingegneria biomedica e meccanica presso l’Università del Wisconsin-Madison e University of Illinois a Urbana-Champaign rispettivamente. Dr. Decker continua a godere di ricerca accademica e la scrittura e utilizza queste competenze per sostenere l’educazione medicina integrativa come scrittore e collaboratore di varie risorse. Il Dott. Decker supporta Allergy Research Group come membro del loro team di formazione e sviluppo del prodotto.
- Fonti:
- Spengler EK, Loomba R. Raccomandazioni per la diagnosi, il rinvio per la biopsia epatica e il trattamento della steatosi epatica non alcolica e della steatoepatite non alcolica. Mayo Clinic Proceedings. 2015;90(9):1233–1246.
- Berardis S, Sokal E. Malattia del fegato grasso non alcolica pediatrica: un crescente problema di salute pubblica. Eur J Pediatr. 2014 Febbraio; 173 (2): 131-9.
- Jadeja R, et al. Medicinali a base di erbe per il trattamento della steatoepatite non alcolica: scenario attuale e prospettive future. Complemento a base di Evid Alternat Med. 2014:648308.
- Pomorski T, et al. Distribuzione e trasporto dei lipidi attraverso le membrane cellulari. Semin Cell Dev Biol. 2001 Aprile; 12 (2): 139-48.
- Yamaji-Hasegawa A, et al. Distribuzione asimmetrica dei fosfolipidi nelle biomembrane. Biol Pharm Bull. 2006 Agosto; 29 (8): 1547-53.
- Hişmioğullari AA, et al. Secrezione lipidica biliare. Turk J Gastroenterol. 2007 Giugno; 18 (2): 65-70.
- Fischer LM, et al. Il sesso e lo stato della menopausa influenzano i requisiti dietetici umani per la colina nutriente. Am J Clin Nutr. 2007 Maggio; 85 (5): 1275-85.
- Wallace TC, et al. L’assunzione abituale di colina è associata al consumo di uova e proteine negli Stati Uniti. Nutriente. 2017 Agosto 5; 9 (8).
- Zeisel SH. Gli elementi di risposta genica, i polimorfismi genetici e l’epigenetica influenzano il fabbisogno alimentare umano per la colina. IUBMB Vita. 2007 Giugno; 59 (6): 380-7.
- Zeisel SH. Gli elementi di risposta genica, i polimorfismi genetici e l’epigenetica influenzano il fabbisogno alimentare umano per la colina. IUBMB Vita. 2007 Giugno; 59 (6): 380-7.
- Guerrerio AL, et al. Assunzione di colina in una grande coorte di pazienti con malattia del fegato grasso non alcolica. Am J Clin Nutr. 2012 Aprile; 95 (4):892-900.
- Ma X, et al. La polienilfosfatidilcolina attenua la fibrosi epatica non alcolica e accelera la sua regressione. J Epatolo. 1996 Maggio; 24(5): 604-13.
- Lieber CS, et al. La fosfatidilcolina protegge dalla fibrosi e dalla cirrosi nel babbuino. Gastroenterologia. 1994 Jan;106(1):152-9.
- Chanussot F, et al. Prevenzione da phosphatidylcholines polinsaturated dietetico (n-6) della colestasi intraepatica indotta da cyclosporine A in animali. Sci vita. 2003 Giugno 13; 73 (4): 381-92.
- Karaman A, et al. Effetto protettivo della fosfatidilcolina polinsatura sul danno epatico indotto dall’ostruzione biliare nei ratti. J Pediatr Surg. 2003 Settembre; 38 (9): 1341-7.
- Karaman A, et al. Effetto protettivo della fosfatidilcolina polinsatura sul danno epatico indotto dall’ostruzione biliare nei ratti. J Pediatr Surg. 2003 Settembre; 38 (9): 1341-7.
- Stremmel W, et al. Protezione mucosa da fosfatidilcolina. Scavare Dis. 2012; 30 Suppl 3: 85-91.
- Parlesak A, et al. I sali biliari primari coniugati riducono la permeabilità dell’endotossina attraverso le cellule epiteliali intestinali e sinergizzano con la fosfatidilcolina nella soppressione della produzione di citochine infiammatorie. Crit Cura Med. 2007 Ottobre; 35 (10): 2367-74.
- Mitzscherling K, et al. La fosfatidilcolina inverte l’aumento indotto dall’etanolo nella permeabilità transepiteliale dell’endotossina e abolisce l’attivazione dei leucociti transepiteliali. Alcole Clin Exp Res. 2009 Mar;33(3):557-62.
- Buzzetti E, et al. La patogenesi a più colpi della malattia del fegato grasso non alcolica (NAFLD). Metabolismo. 2016 Agosto;65 (8):1038-48.
- El Hadi H, et al. Vitamina E come trattamento per la malattia del fegato grasso non alcolica: realtà o mito? Antiossidanti (Basilea). 2018 Gennaio 16;7 (1).
- Bugianesi E, et al. Uno studio randomizzato controllato di metformina contro vitamina E o dieta prescrittiva nella malattia del fegato grasso non alcolica. Am J Gastroenterol. 2005 Maggio; 100 (5): 1082-90.
- Sanyal AJ, et al. Pioglitazone, vitamina E o placebo per steatoepatite non alcolica. N Ingl J Med. 2010 Maggio 6; 362 (18): 1675-85.
- Lavine JE. Vitamina E trattamento della steatoepatite non alcolica nei bambini: uno studio pilota. J Pediatr. 2000 Giugno; 136 (6): 734-8.
- Peh HY, et al. Terapia della vitamina E oltre il cancro: Tocoferolo contro tocotrienolo. Pharmacol Ther. 2016 Giugno; 162: 152-69.
- Qureshi AA, et al. Modulazione dose-dipendente dei parametri lipidici, citochine e RNA da parte del delta-tocotrienolo in soggetti ipercolesterolemici limitati alla dieta AHA Step-1. Brit J di Med & Med Res. 2015;6(4):351-66.
- Qureshi AA, et al. Impatto del delta-tocotrienolo sui biomarcatori infiammatori e sullo stress ossidativo in soggetti ipercolesterolemici. Cardiologia di Exp di Clin. 2015;6(4):1000367.
- Zaiden N, et al. I tocotrienoli Gamma delta riducono la sintesi dei trigliceridi epatici e la secrezione di VLDL. Trombi aterosclerici. 2010 Ottobre 27;17 (10): 1019-32.
- Magosso E, et al. Tocotrienoli per la normalizzazione della risposta ecogenica epatica nel fegato grasso non alcolico: uno studio clinico randomizzato controllato verso placebo. Nutr J. 2013 Dicembre 27;12(1):166.
- Pervez MA, et al. Effetti della supplementazione di Delta-tocotrienolo sugli enzimi epatici, infiammazione, stress ossidativo e steatosi epatica in pazienti con steatosi epatica non alcolica. Turk J Gastroenterol. 2018 Mar; 29(2):170-176.
- Abenavoli L, et al. Cardo mariano nelle malattie del fegato: passato, presente, futuro. Phytother Res. 2010 Ott;24(10):1423-32.
- Valenzuela A, et al. Selettività della silimarina sull’aumento del contenuto di GSH in diversi tessuti del ratto. Planta Med. 1989 Oct; 55(5): 420-2.
- Rui YC. Progressi negli studi farmacologici sulla silimarina. Mem Inst Oswaldo Cruz. 1991; 86 Suppl 2: 79-85.
- Gu M, et al. La silimarina migliora la disfunzione metabolica associata all’obesità indotta dalla dieta tramite l’attivazione del recettore Farnesyl X. Pharmacol anteriore. 2016 Settembre 28;7: 345.
- Ali AH, et al. Recenti progressi nello sviluppo di agonisti del recettore X farnesoide. Ann Transl Med. 2015 Gen;3(1):5.
- Traussnigg S, et al. Efficacia e sicurezza dell’agonista non steroideo del recettore farnesoid X PX-104 in pazienti con malattia epatica grassa non alcolica (NAFLD). Zeitschrift für Gastroenterologie. 2017 Più;55 (05): A71.
- Zhong S, et al. L’effetto terapeutico della silimarina nel trattamento della malattia grassa non alcolica: una meta-analisi (PRISMA) di studi di controllo randomizzati. Medicina (Baltimora). 2017 Dicembre; 96 (49):e9061.
- Hajiaghamohammadi AA, et al. Effetti del trattamento con metformina, pioglitazone e silimarina sulla steatosi epatica non alcolica: uno studio pilota randomizzato controllato. Hepat Mon. 2012 Agosto; 12 (8): e6099.
- Birdsall TC, et al. Berberina: potenziale terapeutico di un alcaloide trovato in diverse piante medicinali. Altern Med Rev. 1997;2:94-103.
- Imanshahidi M, et al. Effetti farmacologici e terapeutici di Berberis vulgaris e del suo costituente attivo, la berberina. Phytother Res. 2008 Aug;22(8):999-1012.
- Zhu X, et al. I potenziali meccanismi della berberina nel trattamento della steatosi epatica non alcolica. Molecola. 2016 Ottobre 14; 21 (10).
- Lan J, et al. Meta-analisi dell’effetto e della sicurezza della berberina nel trattamento del diabete mellito di tipo 2, dell’iperlipemia e dell’ipertensione. Etanofarmacolo. 2015 Febbraio 23;161: 69-81.
- Sun R, et al. La berberina somministrata per via orale modula il metabolismo lipidico epatico alterando il metabolismo degli acidi biliari microbici e la via di segnalazione FXR intestinale. Mol Pharmacol. 2017 Febbraio; 91 (2): 110-122.
- Guo T, et al. La berberina migliora la steatosi epatica e sopprime l’infiammazione del fegato e del tessuto adiposo nei topi con obesità indotta dalla dieta. Sci Rep. 2016 Marzo 3; 6: 22612.
- Schattenberg JM, et al. JNK1 ma non JNK2 promuove lo sviluppo di steatoepatite nei topi. Epatologia. 2006 Gennaio; 43 (1): 163-72.
- Han J, et al. Modulazione del microbiota intestinale come meccanismo anti-diabetico della berberina. Med Sci Monit. 2011;17: RA164-7.
- Gu L, et al. La berberina migliora il danno epiteliale intestinale della stretto-giunzione e giù-regola le vie della chinasi della catena leggera della miosina in un modello del topo dell’endotossinemia. J Infettare Dis. 2011 Giugno 1; 203 (11): 1602-12.
- Li N, et al. La berberina attenua la rottura della giunzione stretta indotta da citochine pro-infiammatoria in un modello in vitro di cellule epiteliali intestinali. Eur J Pharm Sci. 2010 Aprile 16; 40 (1):1-8.
- Ma X, et al. La patogenesi del diabete mellito da stress ossidativo e infiammazione: la sua inibizione da parte della berberina. Pharmacol anteriore. 2018 Luglio 27; 9: 782.
- Yan HM, et al. Efficacia della berberina in pazienti con malattia epatica grassa non alcolica. PLoS Uno. 2015 Agosto 7; 10 (8): e0134172.
- Ma AA, et al. Effetti dei probiotici sulla steatosi epatica non alcolica: una meta-analisi. Mondo J Gastroenterol. 2013 Ottobre 28;19 (40): 6911-8.
- Vajro P, et al. Effetti del ceppo GG di Lactobacillus rhamnosus nella malattia epatica pediatrica correlata all’obesità. J Pediatr Gastroenterol Nutr. 2011 Giugno; 52 (6): 740-3.
- Alisi A, et al. Studio clinico randomizzato: Gli effetti benefici della VSL # 3 nei bambini obesi con steatoepatite non alcolica. Alimento Pharmacol Ther. 2014 Giugno; 39 (11): 1276-85.
- Pérez-Rubio KG, et al. Effetto della somministrazione di berberina sulla sindrome metabolica, sulla sensibilità all’insulina e sulla secrezione di insulina. Metab Syndr Relat Disordine. 2013 Ottobre; 11 (5): 366-9.
- Iacono A, et al. I probiotici come strategia terapeutica emergente per il trattamento della NAFLD: focus sui meccanismi molecolari e biochimici. J Nutr Biochem. 2011 Agosto; 22 (8): 699-711.
- Honda Y, et al. Efficacia del glutatione per il trattamento della malattia del fegato grasso non alcolica: uno studio pilota in aperto, a braccio singolo, multicentrico. Gastroenterolo BMC. 2017 Agosto 8;17 (1):96.
- Dentico P, et al. . Recenti Prog Med. 1995 Luglio-agosto; 86 (7-8):290-3.
- Khoshbaten M, et al. N-acetil-cisteina migliora la funzionalità epatica nei pazienti con malattia epatica grassa non alcolica. Epatite Mon. 2010;10(1):12-16.
- Muto C, et al. Il gamma-tocotrienolo riduce il livello di triacilglicerolo negli epatociti primari di ratto attraverso la regolazione del metabolismo degli acidi grassi. J Clin Biochem Nutr. 2013;52(1):32-37.
- Parker HM, et al. Supplementazione di Omega-3 e steatosi epatica non alcolica: una revisione sistematica e meta-analisi. J Epatolo. 2012;56(4):944-51.
Alterazioni del fegato grasso: correlate a una carenza di fosfatidil colina?
La fosfatidil colina (PC) è essenziale per la salute di tutte le cellule del corpo ed è uno dei principali fosfolipidi di cui sono composte le membrane cellulari., PC comprende oltre il 90% del contenuto totale di fosfolipidi biliari e facilita l’emulsificazione, l’assorbimento e il trasporto dei grassi. Gli studi hanno dimostrato che l’assunzione adeguata raccomandata (AI) di colina (vedere Tabella 1) potrebbe non essere sufficiente per la prevenzione di sintomi di carenza come alterazioni del fegato grasso o danni muscolari. Inoltre, un recente studio ha rilevato che solo l ‘ 8% degli adulti statunitensi soddisfa l’IA raccomandata della colina, con vegetariani, donne in postmenopausa e uomini a maggior rischio di inadeguatezza., I polimorfismi genetici possono anche aumentare la necessità di colina, che è anche una fonte di gruppi metilici nel corpo.
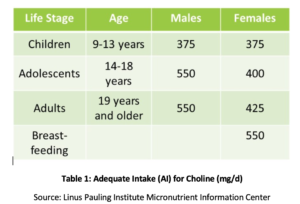
Nelle donne in postmenopausa con NAFLD, è stato dimostrato che una ridotta assunzione di colina è significativamente associata ad un aumentato rischio di fibrosi. Negli animali, la PC ha dimostrato di proteggere contro la fibrosi associata a infiammazione epatica., L’assunzione aumentata di PC ha dimostrato di migliorare la secrezione lipidica biliare, prevenendo così la colestasi e il successivo danno epatico attraverso numerosi meccanismi, inclusa la soppressione del fattore nucleare kappa B (NF-kB), un trigger molecolare ben compreso dell’infiammazione., In un modello animale dell’ostruzione biliare, il PC supplementare è stato indicato per ridurre il danno epatico, la proliferazione duttale e la fibrosi.
Il PC è inoltre essenziale per la salute dell’intestino ed è una componente primaria dello strato protettivo del muco intestinale. Nelle colture cellulari, il trattamento con PC ha dimostrato di ridurre la migrazione dell’endotossina attraverso le cellule epiteliali intestinali, sopprimendo ulteriormente la risposta infiammatoria associata alle citochine. PC riduce anche la traslocazione dell’endotossina nell’impostazione di aumenti indotti dall’alcol nella permeabilità intestinale. Questo effetto benefico è stato proposto come uno dei meccanismi con cui la PC può essere considerata terapeutica nella malattia epatica alcolica.
Vitamina E
Come un colpo di stress ossidativo e difese antiossidanti diminuite è stato proposto come un fattore che porta allo sviluppo di NAFLD, non dovrebbe sorprendere che gli antiossidanti siano stati studiati come un potenziale trattamento per la condizione.
 La vitamina E è stata studiata in diversi studi clinici per il trattamento della NAFLD, sia come terapia autonoma che aggiuntiva. In una revisione di questi studi, il dosaggio di vitamina E variava da 400 a 1200 UI/die e la durata dello studio era da 24 settimane a più di due anni. I risultati sono stati generalmente positivi, mostrando che quando è stata inclusa la vitamina E, sono stati osservati miglioramenti nei livelli di istologia, steatosi e/o transaminasi., In pediatria con NAFLD, la vitamina E è stata studiata anche come terapia. In uno studio pilota in aperto su 11 bambini affetti da NAFLD, durante il trattamento è stata riscontrata una supplementazione compresa tra 400 e 1200 UI di vitamina E per quattro-dieci mesi in grado di normalizzare i livelli di transaminasi e fosfatasi alcalina, che tuttavia sono tornati ad essere anormali una volta interrotto il trattamento. L’ecogenicità epatica non è cambiata durante il corso del trattamento.
La vitamina E è stata studiata in diversi studi clinici per il trattamento della NAFLD, sia come terapia autonoma che aggiuntiva. In una revisione di questi studi, il dosaggio di vitamina E variava da 400 a 1200 UI/die e la durata dello studio era da 24 settimane a più di due anni. I risultati sono stati generalmente positivi, mostrando che quando è stata inclusa la vitamina E, sono stati osservati miglioramenti nei livelli di istologia, steatosi e/o transaminasi., In pediatria con NAFLD, la vitamina E è stata studiata anche come terapia. In uno studio pilota in aperto su 11 bambini affetti da NAFLD, durante il trattamento è stata riscontrata una supplementazione compresa tra 400 e 1200 UI di vitamina E per quattro-dieci mesi in grado di normalizzare i livelli di transaminasi e fosfatasi alcalina, che tuttavia sono tornati ad essere anormali una volta interrotto il trattamento. L’ecogenicità epatica non è cambiata durante il corso del trattamento.
I tocotrienoli sono la famiglia meno studiata delle forme naturali di vitamina E, con i tocoferoli, più spesso presenti in natura, che dominano la ricerca scientifica. Tuttavia, i tocotrienoli sono potenti antiossidanti, citati in alcune ricerche come aventi da 40 a 60 volte il potenziale antiossidante dei tocoferoli. I tocotrienoli hanno dimostrato di migliorare il colesterolo totale e le sue frazioni, riducendo il colesterolo totale e LDL dal 15 al 20%, e trigliceridi fino a quasi il 30%. I tocotrienoli hanno anche dimostrato di avere effetti antinfiammatori e antiossidanti in vivo, abbassando i livelli di proteina C-reattiva ad alta sensibilità (hs-CRP) e riducendo l’ossidazione delle LDL.
I tocotrienoli sono stati studiati anche come trattamento per la NAFLD. Nei pazienti con NAFLD con diagnosi ecografica, 200 mg di tocotrienoli misti (provenienti da olio di palma, con un’alta frazione gamma e altri 61 mg di alfa tocoferoli) assunti due volte al giorno per un anno hanno dimostrato di normalizzare significativamente la risposta ecogenica epatica e il tasso di remissione rispetto al placebo. In un secondo studio, che ha incluso pazienti con ultrasuoni-diagnosi di NAFLD e transaminasi elevazione, 300 mg di tocotrienoli (90:10 delta:gamma miscela) da prendere due volte al giorno per 12 settimane è diminuito significativamente, aspartato aminotransferasi (AST), alanina aminotransferasi (ALT), hs-CRP, e malondialdeide (un marker di stress ossidativo) i livelli di fegato grasso, l’indice di punteggio rispetto al placebo.
Cardo mariano
Cardo mariano (Silybum marianum) è forse il più noto botanico fegato-protettivo. La silimarina, una miscela dei costituenti attivi del cardo mariano e la silibinina, il composto più attivo trovato all’interno di esso, hanno dimostrato in studi sugli animali di ridurre le lesioni epatiche causate da paracetamolo, alcol, sovraccarico di ferro e radiazioni tra le altre sostanze tossiche per il fegato note. La silimarina ha dimostrato di aumentare i livelli di glutatione, un potente antiossidante, sia nel fegato che nell’intestino. Riduce anche la perossidazione lipidica, che danneggia le membrane cellulari, alterando la loro funzione e possibilmente causando la morte cellulare.
La silibinina e la silimarina hanno dimostrato di attivare un recettore degli acidi biliari nucleare noto come recettore farnesoide X (FXR) nel fegato, che regola le vie infiammatorie e corregge la resistenza all’insulina e la dislipidemia indotta dall’alimentazione ad alto contenuto di grassi (HFD). FXR è un regolatore chiave dell’acido biliare, del glucosio e dell’equilibrio lipidico nel corpo. I farmaci che interagiscono con FXR in modo simile a questi composti derivati dal cardo mariano sono anche studiati per il trattamento della NAFLD e le relative sfide metaboliche.
Studi clinici hanno anche dimostrato che il cardo mariano migliora vari parametri associati alla NAFLD. Una meta-analisi del 2017 ha rilevato che il trattamento con cardo mariano riduce significativamente ALT e AST di -5,08 UI/L e -5,44 UI/L, rispettivamente, nei pazienti con NAFLD. I dosaggi variavano da 140 mg una volta al giorno a 200 mg tre volte al giorno, per una durata da 8 a 24 settimane. Al dosaggio più basso di 140 mg al giorno, dopo 8 settimane, sono stati osservati miglioramenti significativi nella glicemia a digiuno (FBG), nel profilo lipidico e nei livelli sierici di insulina oltre alle riduzioni di AST e ALT da 56 a 37.77 UI/L e 78,73-53,05 UI / L, rispettivamente.
Berberina
La berberina, l’alcaloide giallo-arancio trovato in botanicals quali la radice e la corteccia dell’uva dell’Oregon, goldenseal e crespino, è un’altra sostanza botanicamente-derivata che ha numerosi meccanismi da cui può contribuire a proteggere contro NAFLD ed a sostenere la sua risoluzione.,,
Gli effetti antidiabetici e di bilanciamento dei lipidi della berberina sono stati dimostrati in diversi studi clinici e può essere un mezzo attraverso il quale la berberina influisce positivamente sulla funzionalità epatica. È stato dimostrato che la berberina altera l’espressione genica correlata al metabolismo e il metabolismo degli acidi biliari attraverso vie che coinvolgono anche FXR. Negli studi sugli animali, la berberina ha dimostrato di avere l’effetto di prevenire l’obesità associata a HFD e l’accumulo di trigliceridi epatici nei topi wild-type (normali), ma non in quelli che avevano l’eliminazione genetica dell’espressione FXR intestinale. La berberina ha anche dimostrato di sopprimere l’infiammazione associata all’obesità e la steatosi epatica nei topi diminuendo la fosforilazione del complesso infiammatorio noto come JNK1, una proteina chinasi implicata nello sviluppo della steatoepatite. JNK1 è fortemente attivato da fattori di stress ambientali e citochine pro-infiammatorie.
può essere un mezzo attraverso il quale la berberina influisce positivamente sulla funzionalità epatica. È stato dimostrato che la berberina altera l’espressione genica correlata al metabolismo e il metabolismo degli acidi biliari attraverso vie che coinvolgono anche FXR. Negli studi sugli animali, la berberina ha dimostrato di avere l’effetto di prevenire l’obesità associata a HFD e l’accumulo di trigliceridi epatici nei topi wild-type (normali), ma non in quelli che avevano l’eliminazione genetica dell’espressione FXR intestinale. La berberina ha anche dimostrato di sopprimere l’infiammazione associata all’obesità e la steatosi epatica nei topi diminuendo la fosforilazione del complesso infiammatorio noto come JNK1, una proteina chinasi implicata nello sviluppo della steatoepatite. JNK1 è fortemente attivato da fattori di stress ambientali e citochine pro-infiammatorie.
La berberina agisce anche nell’intestino. Colpisce non solo l’equilibrio microbico intestinale, ma influenza anche direttamente la permeabilità intestinale, migliorando l’integrità della giunzione stretta negli animali soggetti a endotossemia o colture cellulari trattate con citochine pro-infiammatorie., sono stati dimostrati anche effetti antinfiammatori diretti.
I benefici della berberina nella NAFLD sono stati dimostrati clinicamente anche in uno studio clinico randomizzato, controllato in parallelo, in aperto. Nei pazienti con NAFLD, la berberina ha dimostrato di ripristinare la normale architettura epatica, il metabolismo dei lipidi e della glicemia, con miglioramenti significativi osservati nella popolazione che ha implementato solo cambiamenti nello stile di vita.
Probiotici
Data la relazione tra i molti disturbi del sistema digestivo e l’innalzamento degli enzimi epatici, non sorprende che i probiotici siano stati studiati anche come trattamento per la NAFLD. Una recente meta-analisi riassume bene i risultati collettivi.
Un centinaio di trenta-quattro pazienti diagnosticati con NAFL/NASH da biopsia epatica sono stati inclusi in questa analisi, e ogni intervento in quattro studi randomizzati, controllati ammissibili per questa meta-analisi è stato unico (Lactobacillus bulgaricus e Streptococcus thermophilus per tre mesi; Lactobacillus GG per otto settimane; Bifidobacterium longum e frutto-oligosaccaridi (FOS) per 24 settimane; e una combinazione brevettata di Lactobacillus plantarum, L. delbrueckii, L. acidophilus, L. rhamnosus e Bifidobacterium bifidum per sei mesi). Il dosaggio dei probiotici variava da 500 milioni a 12 miliardi di unità formanti colonie (CFU) al giorno. I trattamenti probiotici hanno dimostrato di ridurre significativamente i livelli di ALT e AST di -23.71 UI/L e -19.77 UI / L, rispettivamente. Sono stati anche osservati miglioramenti significativi nei livelli di colesterolo totale, fattore di necrosi tumorale (TNF)-α e resistenza all’insulina.
Due ulteriori studi clinici hanno esaminato i probiotici come trattamento per la NAFLD pediatrica. In uno studio pilota in doppio cieco, controllato con placebo, dodici bambini, con un’età media di 10 anni.7 anni, con alterazioni del fegato grasso diagnosticate con ultrasuoni e aumento persistente delle transaminasi sono stati somministrati 12 miliardi di CFU di L. rhamnosus GG o placebo al giorno per 8 settimane. Il trattamento con il probiotico ha ridotto significativamente i livelli di ALT rispetto al placebo, tuttavia l’ecogenicità epatica e i livelli di AST non sono cambiati. Inoltre, gli anticorpi anti-peptidoglicano-polisaccaridi, un indicatore di batteri o traslocazione della membrana batterica attraverso la barriera intestinale, sono diminuiti significativamente nei bambini che hanno ricevuto il probiotico rispetto al placebo. Il secondo studio ha studiato il trattamento di bambini con NAFLD comprovato da biopsia con VSL #3, una miscela ad alta potenza di 8 ceppi probiotici (tra cui Streptococcus thermophilus, 3 Bifidobacteria spp., e 4 Lactobacillus spp.), rispetto al placebo. Nei bambini che hanno ricevuto il probiotico, i punteggi del fegato grasso sono stati significativamente migliorati con la probabilità che nessun fegato grasso, leggero, moderato o grave alla fine dello studio fosse del 21%, 70%, 9% e 0% rispetto allo 0%, 7%, 76% e 17% nel gruppo placebo.
Conclusione
C’è una vasta gamma di opzioni sicure ed efficaci disponibili che supportano il ripristino della salute in quelli con NAFLD. Sebbene ogni individuo possa avere diversi meccanismi sottostanti che contribuiscono alla disfunzione epatica e ai cambiamenti infiammatori, ciascuno di questi agenti naturali di supporto—e molti altri (vedere Tabella 2)—può supportare la normale funzionalità epatica in individui con queste sfide.
Tabella 2: Interventi nutrizionali e botanici per la NAFLD. Nutrienti come questi dovrebbero essere utilizzati sotto la guida di un professionista sanitario qualificato e autorizzato.
| Nutrienti | Dosaggio | Meccanismo |
| la Fosfatidilcolina (PC), una fonte alimentare di colina | 1,5 g due volte al giorno con i pasti (PC) O 200 mg due volte al giorno (colina) | Colina è un comune carenza alimentare. PC è necessario per la produzione di bile e barriera protettiva mucosa gastrointestinale. |
| Semi di cardo mariano | da 140 a 200 mg una o tre volte al giorno | Epatoprotettivo. Supporta i livelli di glutatione epatico, stabilizza la pompa di esportazione del sale biliare (BSEP) e attiva le vie FXR. |
| Berberina HCl | 500 mg due o tre volte al giorno | Migliora il glucosio nel siero e profili lipidici, riducendo anche il contenuto di grassi epatici. |
| Probiotici, tra cui ceppi come B. longum, B. bifidum, S. thermophilus, L. rhamnosus, L. acidophilus e L. plantarum | 12 miliardi di unità formanti colonie (CFU) al giorno | Miglioramento della funzione di barriera epiteliale intestinale e riduzione dell’infiammazione intestinale e sistemica. |
| Acetil-glutatione | 300 mg al giorno | Migliora la capacità disintossicante degli epatociti. |
| N-acetilcisteina (NAC) | 500-600 mg due volte al giorno, meglio assunto a stomaco vuoto | NAC blocca la propagazione della perossidazione lipidica e supporta i livelli di glutatione epatico. |
| Vitamina E (tocoferoli)
O Tocotrienoli |
400 a 1200 UI al giorno con il cibo
da 200 a 300 mg due volte al giorno con il cibo |
Antiossidante protettivo.
I tocotrienoli attenuano l’accumulo di trigliceridi regolando gli enzimi degli acidi grassi sintasi e carnitina palmitoiltransferasi, portando ad una riduzione dell’infiammazione epatica e dello stress del reticolo endoplasmatico. |
| Gli acidi grassi essenziali Omega-3 | 2 – 4 g al giorno, con i pasti | Gli acidi grassi polinsaturi Omega-3 sono noti per ridurre la regolazione degli steroli che legano la proteina-1c e upregolare il recettore alfa attivato dal proliferatore del perossisoma, favorendo così l’ossidazione degli acidi grassi e riducendo la steatosi. |