tillbaka till att skriva Lewis strukturer för molekyler
skelettstrukturen hos en kovalent molekyl kan ofta bestämmas genom att beakta valen hos de ingående atomerna. Vanligtvis finns atomen som bildar det största antalet bindningar i mitten av skelettet, där den kan ansluta till det maximala antalet andra atomer.
exempel 1: hypoklorsyra har molekylformeln HOCl. Rita en
strukturformel.
Lösning Det finns flera möjliga sätt att koppla samman atomerna
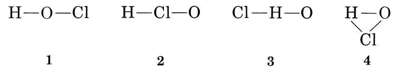
den vanliga valensen av H är 1, och så strukturer 3 och 4, som har två bindningar till H, kan elimineras. Den vanliga valensen av Cl är också 1, och så kan struktur 2 också uteslutas. Struktur 1 visar att H bildar en bindning, CL bildar en och O bildar två, i överensstämmelse med de vanliga valenserna, och så väljs det.
det totala antalet tillgängliga valenselektroner är 1 från H plus 6 från O plus 7 från Cl eller 14. Fyller dessa i skelettet vi har
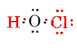
Observera att O, som hade den största valensen, ligger i mitten av skelettet.
exempel 2:
rita en strukturformel för hydroxylamin, NH3O.
lösning i detta fall N har den största valensen (3), följt av O (2) och H (1). Både N och O kan bilda ”broar” mellan andra atomer, men H kan inte. Därför placerar vi N och O i mitten av skelettet för att ge
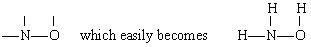
genom tillsats av de tre h-atomerna.
det finns totalt 5 + 3 + 6 = 14 valenselektroner från N, 3H och O. dessa kan placeras enligt följande:
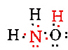
När Lewis-diagrammet har bestämts skrivs molekylformeln ofta om för att påminna oss om vad strukturformeln är. Till exempel skrivs molekylformeln för hydroxylamin vanligtvis NH2OH istället för NH3O för att påminna oss om att två H är bundna till N och en till O. Det antas att personen som läser formeln kommer att inse att N och O vardera har en valenselektron kvar att dela med varandra, ansluta —NH2 med —OH. I vissa fall kommer mer än en skelettstruktur att tillfredsställa valensen hos varje atom och oktettregeln också. Du kan till exempel verifiera att molekylformeln C2H6O motsvarar båda följande:
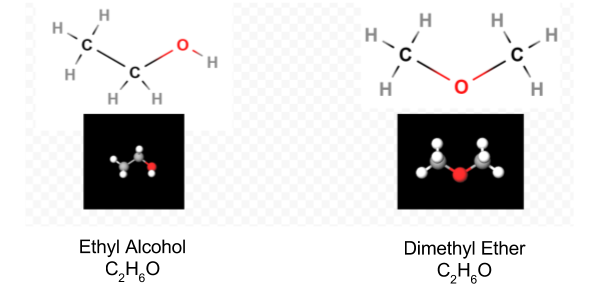
i ett sådant fall kan vi bara bestämma vilken molekylstruktur vi har genom experiment. Egenskaperna hos etylalkohol vid utspädning med vatten och konsumtion är välkända. Dimetyleter är en gas. Liksom dietyletern som används i operationssalar är den mycket explosiv och kan sova dig. Två molekyler, såsom dimetyleter och etylalkohol, som har samma molekylformel men olika strukturella formler sägs vara isomerer.
tillbaka till att skriva Lewis-strukturer för molekyler
bekräftelser:
C2H6O-molekylerna och deras skelettstrukturer skapades med MolView.