reaktionshastigheter
Variation av priser när du ändrar halogen
reaktionshastigheter ökar i ordningen HF – HCl – HBr – HI. Vätefluorid reagerar mycket långsammare än de andra tre och ignoreras normalt när man talar om dessa reaktioner.
när vätehalogeniderna reagerar med alkener måste vätehalogenbindningen brytas. Bindningsstyrkan faller när du går från HF till HI, och väte-fluorbindningen är särskilt stark. Eftersom det är svårt att bryta bindningen mellan väte och fluor, är tillsatsen av HF bunden att vara långsam.
Variation av priser när du ändrar alkenen
gäller detta osymmetriska alkener såväl som symmetriska. För enkelhetens skull är exemplen nedan alla symmetriska – men de behöver inte vara.
reaktionshastigheter ökar när alkenen blir mer komplicerad – i betydelsen av antalet alkylgrupper (såsom metylgrupper) kopplade till kolatomerna i vardera änden av dubbelbindningen. Till exempel:
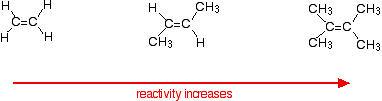
det finns två sätt att titta på orsakerna till detta – som båda behöver du veta om mekanismen för reaktionerna.
alkener reagerar eftersom elektronerna i pi-bindningen lockar saker med någon grad av positiv laddning. Allt som ökar elektrontätheten runt dubbelbindningen hjälper detta.
alkylgrupper har en tendens att” skjuta ” elektroner bort från sig själva mot dubbelbindningen. Ju fler alkylgrupper du har, desto mer negativt blir området runt dubbelbindningarna.
ju mer negativt laddad regionen blir, desto mer kommer den att locka molekyler som väteklorid.
den viktigaste orsaken ligger dock i stabiliteten hos den mellanliggande jonen som bildas under reaktionen. De tre exemplen som ges ovan producerar dessa karbokationer (karboniumjoner) vid reaktionens halvvägs:
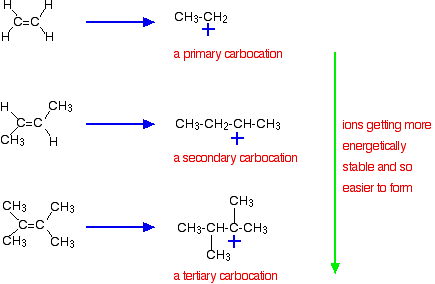
stabiliteten hos de mellanliggande jonerna styr aktiveringsenergin för reaktionen. När du går mot de mer komplicerade alkenerna faller aktiveringsenergin för reaktionen. Det betyder att reaktionerna blir snabbare.