glukos-alanin cykel, eller Cahill cykel, föreslås för första gången av Mallette, Exton och Park, och Felig et al. mellan 1969 och 1970 består av en serie steg genom vilka extrahepatiska vävnader, till exempel skelettmuskeln, exporterar pyruvat-och aminogrupper som alanin till levern och får glukos från levern via blodomloppet.
huvudstegen i glukos-alanin-cykeln sammanfattas nedan.
- när aminosyror används i extrahepatiska vävnader för energi används pyruvat, härledd från glykolys, som aminogruppacceptor och bildar alanin, en icke-essentiell aminosyra.
- alanin diffunderar in i blodomloppet och når levern.
- i levern överförs aminogruppen av alanin till XXL-ketoglutarat för att bilda pyruvat respektive glutamat.
- aminogruppen av glutamat går mestadels in i ureacykeln och fungerar delvis som en kvävedonator i många biosyntetiska vägar.
pyruvat går in i glukoneogenes och används för glukossyntes. - den nybildade glukosen diffunderar in i blodomloppet och når perifera vävnader där, på grund av glykolys, omvandlas till pyruvat som kan acceptera aminogrupper från de fria aminosyrorna och därmed stänga cykeln.
därför ger glukos-alanin-cykeln en koppling mellan kolhydrat och aminosyrametabolism, som schematiskt beskrivs nedan.
glukos / Glukos / glukos / Glukos / glukos / Glukos / glukos / Glukos / glukos / Glukos / glukos / Glukos / glukos / Glukos / glukos / Glukos / glukos / Glukos / glukos / Glukos / glukos / Glukos / glukos / Glukos
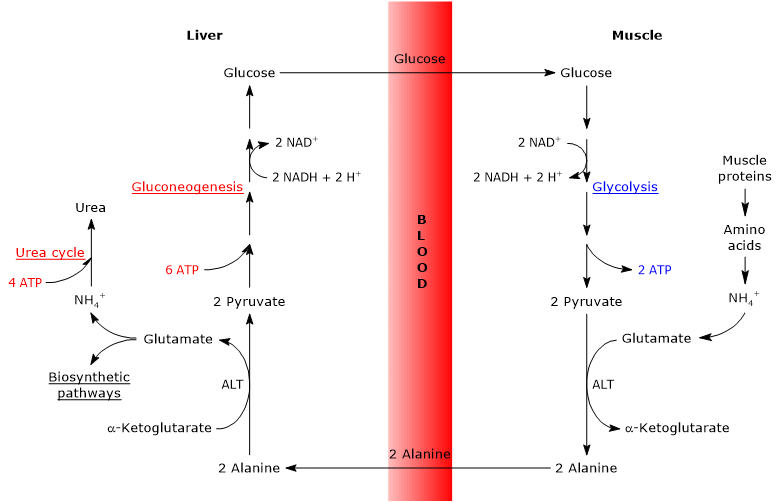
glukos-alanin cykel sker inte bara mellan skelettmuskulaturen, den första vävnaden där det observerades, och levern, men involverar andra celler och extrahepatiska vävnader inklusive celler i immunsystemet, såsom lymfoida organ.
innehåll
- stegen i glukos-alanin-cykeln
- Cahill-cykeln i skelettmuskel
- Cahill-cykeln i levern
- transaminaser
- funktioner av glukos-alanin cykel
- energikostnaden för glukos-alanin cykel
- likheter och skillnader mellan Cahill cykel och Cori cykel
stegen i glukos-alanin cykel
analysen av stegen i glukos-alanin cykel görs med tanke på cykeln mellan skelettmuskel och levern.
både intracellulära och extracellulära proteiner hydrolyseras kontinuerligt till de ingående aminosyrorna och återsyntetiseras, och den hastighet med vilken dessa processer inträffar balanseras exakt och förhindrar därmed förlust av fettfri massa.
men under kataboliska förhållanden, såsom intensiv och långvarig träning eller fasta, överstiger hastigheten för muskelproteinnedbrytning syntesen. Detta leder till frisättning av aminosyror, av vilka några används för energi och andra för glukoneogenes. Och oxidationen av kolskelett av aminosyror, i synnerhet grenade aminosyror eller BCAA (leucin, isoleucin och valin), kan vara en signifikant energikälla för muskeln. Till exempel, efter cirka 90 minuters ansträngande träning, ger aminosyraoxidation i muskler 10-15% av den energi som behövs för sammandragning.
användningen av kolskelett av aminosyror för energi innefattar avlägsnande av aminogruppen och sedan utsöndring av aminokväve i en giftfri form.
avlägsnandet av gruppen av aminosyror sker genom transaminering, som kan sammanfattas på följande sätt:
sackaros-Keto-syra + aminosyra 2903>
sådana reaktioner, katalyserade av enzymer som kallas aminotransferaser eller transaminaser (EC 2.6.1) är fritt reversibla.
grenade aminosyror, till exempel, överför aminogruppen till Bisexuell-ketoglutarat eller 2-oxoglutarsyra, för att bilda glutamat och den keto-syra som härrör från den ursprungliga aminosyran, i en reaktion katalyserad av Grenad kedjeaminotransferas eller BCAT (EC 2.6 .1.42).
Cahill-cykeln i skelettmuskel
i skelettmuskel kan det nybildade glutamatet reagera med ammoniak för att bilda glutamin, för många vävnader och organ, såsom hjärnan, det viktigaste fordonet för transport av kväve mellan organ. Reaktionen katalyseras av det cytosoliska enzymet glutaminsyntetas (EC 6.3.1.2) och förbrukar en ATP.
glutamat + NH4+ + ATP-2903 + ADP + pi
i detta fall lämnar glutamat Cahill-cykeln.
alternativt, och i motsats till vad som händer i de flesta andra vävnader, kan det nybildade glutamatet överföra aminogruppen till pyruvat, härrörande från glykolys, för att bilda alanin och GHz-ketoglutarat. Denna transaminering katalyseras av alaninaminotransferas eller ALT (EC 2.6.1.2), ett enzym som finns i de flesta djur-och växtvävnader.
glutamat + pyruvat Bisexuell alanin + sackaros-ketoglutarat
alanin produceras och som härrör direkt från proteinnedbrytning, och muskelproteiner är rika på alanin, kan lämna cellen och transporteras av blodomloppet till levern; på detta sätt når aminogruppen levern. Och den hastighet vid vilken alanin bildad genom transaminering av pyruvat överförs till cirkulationen är proportionell mot den intracellulära pyruvatproduktionen.
Obs: alanin och glutamin är de viktigaste källorna till kväve och kol i interorgan aminosyrametabolism.
Cahill-cykeln i levern
en gång i levern katalyserar ett hepatiskt alaninaminotransferas en transaminering där alanin, den huvudsakliga glukoneogena aminosyran, fungerar som en aminogruppdonator och bisexuell-ketoglutarat som en acceptor för acetyl-keto-syra. Produkterna av reaktionen är pyruvat, dvs kolskelettet av alanin och glutamat.
alanin + 2903 + pyruvat glutamat, i reaktionen katalyserad av glutamatdehydrogenas (EC 1.4.1.2), ett enzym som är närvarande i mitokondriematrisen, bildar ammoniumjon, som går in i ureacykeln, och bisexuell-ketoglutarat, som kan komma in i Krebs-cykeln. Denna reaktion är en anaplerotisk reaktion som kopplar aminosyrametabolism med Krebs-cykeln.
glutamat + H2O + NAD+ chubbi-ketoglutarat + NH4+ + NADH + H+
glutamat kan emellertid också reagera med oxaloacetat för att bilda aspartat och chubbi-ketoglutarat, i en reaktion katalyserad av aspartataminotransferas (EC 2.6.1.1). Aspartat är involverat i bildandet av urea såväl som i syntesen av puriner och pyrimidiner.
glutamat + Oxaloacetate-aspartat + -ketoglutarat
även det producerade pyruvatet kan ha olika metaboliska öden: det kan oxideras för ATP-produktion och sedan lämna glukos-alanin-cykeln eller gå in i glukoneogenesvägen och fortsätta därmed i cykeln.
den producerade glukosen frigörs från levern in i blodomloppet och levereras till olika vävnader som kräver det, som skelettmuskeln, där den används för pyruvatsyntes. I sin tur kan det nybildade pyruvatet reagera med glutamat och därmed stänga cykeln.
transaminaser
som tidigare nämnts sker avlägsnandet av aminogruppen från aminosyror genom transaminering (se ovan för den allmänna reaktionen). Dessa reaktioner katalyseras av enzymer som kallas aminotransferaser eller transaminaser.
de är cytosoliska enzymer, närvarande i alla celler och särskilt rikliga i lever, njure, tarm och muskel; de kräver pyridoxalfosfat eller PLP, den aktiva formen av vitamin B6 eller pyridoxin, som ett koenzym, som är tätt bundet till det aktiva stället.
i transamineringsreaktioner kanaliseras aminogruppen av fria aminosyror, utom av treonin och lysin, mot ett litet antal sackarios-keto-syror, särskilt pyruvat, oxaloacetat och sackarios-ketoglutarat.
celler innehåller olika typer av aminotransferaser: många är specifika för sackarios-ketoglutarat som acceptor av ketosyra, men skiljer sig åt i specificitet för aminosyran, från vilken de heter. Exempel är ovannämnda alaninaminotransferas, även kallad alanintransaminas och glutamisk pyruvtransferas eller GPT, och aspartataminotransferas eller AST, även kallad glutamisk-oxaloättiksyratransaminas eller GOT.
det bör understrykas att det inte finns någon nettodeaminering i dessa reaktioner, ingen förlust av aminogrupper, eftersom sackarios-keto-syraacceptorn amineras och aminosyran deamineras.
funktioner i glukos-alanin-cykeln
denna cykel har olika funktioner.
- det transporterar kväve i en giftfri form från perifera vävnader till levern.
- det transporterar pyruvat, ett glukoneogent substrat, till levern.
- det tar bort pyruvat från perifera vävnader. Detta leder till en högre produktion av ATP från glukos i dessa vävnader. Faktum är att NADH som produceras under glykolys kan komma in i mitokondrier och oxideras genom oxidativ fosforylering.
- det tillåter att upprätthålla en relativt hög koncentration av alanin i hepatocyter, tillräcklig för att hämma proteinnedbrytning.
- det kan spela en roll i värdförsvar mot infektionssjukdomar.
slutligen är det viktigt att understryka att det inte finns någon nettosyntes av glukos i glukos-alanin-cykeln.
energikostnad för glukos-alanin-cykeln
liksom Cori-cykeln har också glukos-alanin-cykeln en energikostnad, lika med 3-5 ATP.
den del av cykeln som äger rum i perifera vävnader innefattar produktion av 5-7 ATP per molekyl glukos:
- 2 ATP produceras genom glykolys;
- 3-5 ATP härrör från NADH/FADH2 (se nedan).
istället i levern kostar glukoneogenes och ureacykeln 10 ATP:
- 6 ATP konsumeras i under glukoneogenes per molekyl syntetiserad glukos;
- 4 ATP konsumeras i ureacykeln per molekyl syntetiserad urea.
glukos-alanin-cykeln, som Cori-cykeln, skiftar en del av den metaboliska bördan från extrahepatiska vävnader till levern. Energikostnaden som betalas av levern är emellertid motiverad av de fördelar som cykeln ger till hela kroppen, eftersom det under särskilda förhållanden möjliggör en effektiv nedbrytning av proteiner i extrahepatiska vävnader (särskilt skelettmuskel), vilket i sin tur tillåter att erhålla glukoneogena substrat samt användningen av aminosyror för energi i extrahepatiska vävnader.
likheter och skillnader mellan Cahill cycle och Cori cycle
det finns några analogier mellan de två cyklerna, som listas nedan.
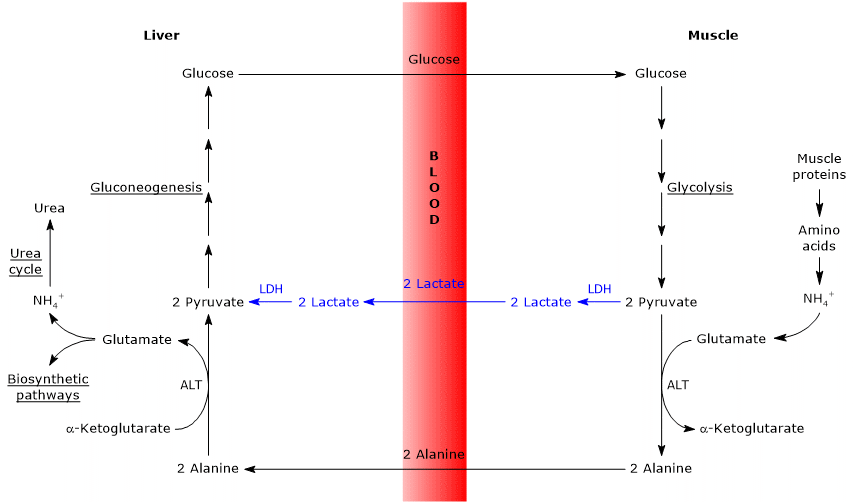
- Cahill-cykeln överlappar delvis Cori-cykeln när pyruvat omvandlas till glukos och monosackariden transporteras till extrahepatiska vävnader, i vilka den omvandlas igen till pyruvat via den glykolytiska vägen.
- inträdet i glukoneogenesvägen är liknande för de två cyklerna: både alanin och laktat omvandlas till pyruvat.
- liksom Cori-cykeln sker glukos-alanin-cykeln mellan olika celltyper, till skillnad från metaboliska vägar som glykolys, Krebs-cykel eller glukoneogenes som förekommer i enskilda celler
nedan, några skillnader mellan de två cyklerna.
- huvudskillnaden gäller de tre kolintermediärerna som från perifera vävnader når levern: laktat i Cori-cykeln och alanin i glukos-alanin-cykeln.
- en annan skillnad gäller ödet för NADH som produceras av glykolys i perifera vävnader.
i Cori-cykeln fungerar koenzymet som reduktionsmedel för att reducera pyruvat till laktat, i reaktionen katalyserad av laktatdehydrogenas (EC 1.1.1.27).
i glukos-alanin-cykeln sker inte denna reduktion och elektronerna av NADH kan transporteras in i mitokondrierna via malat-aspartat och glycerol 3-fosfatbussar, vilket genererar NADH, den första skytteln och FADH2, den andra skytteln. Och utbytet av ATP från NADH och FADH2 är 2,5 respektive 1,5. - slutligen, från föregående punkt, är det uppenbart att, till skillnad från Cori-cykeln, kräver Cahill-cykeln närvaron av syre och mitokondrier i perifera vävnader.
Berg JM, Tymoczko Jl och Stryer L. biokemi. 5: e upplagan. WH Freeman och företag, 2002
Felig P., Pozefsk T., Marlis E., Cahill GF alanin: nyckelroll i glukoneogenes. Vetenskap 1970; 167 (3920):1003-4. doi: 10.1126/vetenskap.167. 3920. 1003
Gropper S. S., Smith J. L., Groff J. L. Avancerad näring och mänsklig metabolism. Cengage Learning, 2009
Lecker S. H., Goldberg A. L. och Mitch W. E. proteinnedbrytning av ubiquitin–proteasomvägen i normala och sjukdomstillstånd. J Am Soc Nephrol 2006; 17 (7): 1807-19. doi: 10.1681 / ASN.2006010083
Mallette L. E., Exton J. H. och Park C. R. kontroll av glukoneogenes från aminosyror i den perfuserade råttleveren. J Biol Chem 1969; 244 (20): 5713-23.
Nelson D. L., Cox M. M. Lehninger. Principer för biokemi. 6: e upplagan. W. H. Freeman och företag, 2012
Raju S. M., Madala B. Illustrerad medicinsk biokemi. Jaypee Brothers Publishers, 2005
Wu G. aminosyror: biokemi och näring. CRC Press, 2013