inlärningsmål
i slutet av detta avsnitt kommer du att kunna:
- skriv Lewis-symboler för neutrala atomer och joner
- Rita Lewis-strukturer som visar bindningen i enkla molekyler
vi har diskuterat de olika typerna av bindningar som bildas mellan atomer och/eller joner. I alla fall involverar dessa bindningar delning eller överföring av valensskalelektroner mellan atomer. I det här avsnittet kommer vi att undersöka den typiska metoden för att skildra valensskalelektroner och kemiska bindningar, nämligen Lewis-symboler och Lewis-strukturer.
Lewis-symboler
vi använder Lewis-symboler för att beskriva valenselektronkonfigurationer av atomer och monatomiska joner. En Lewis-symbol består av en elementär symbol omgiven av en punkt för var och en av dess valenselektroner:
Figur 1 visar Lewis-symbolerna för elementen i den tredje perioden i det periodiska systemet.

Figur 1. Lewis symboler som illustrerar antalet valenselektroner för varje element i den tredje perioden av det periodiska systemet.
Lewis-symboler kan också användas för att illustrera bildandet av katjoner från atomer, som visas här för natrium och kalcium:

på samma sätt kan de användas för att visa bildandet av anjoner från atomer, som visas nedan för klor och svavel:

Figur 2 visar användningen av Lewis-symboler för att visa överföringen av elektroner under bildandet av joniska föreningar.

Figur 2. Katjoner bildas när atomer förlorar elektroner, representerade av färre Lewis-prickar, medan anjoner bildas av atomer som får elektroner. Det totala antalet elektroner ändras inte.
Lewis-strukturer
vi använder också Lewis-symboler för att indikera bildandet av kovalenta bindningar, som visas i Lewis-strukturer, ritningar som beskriver bindningen i molekyler och polyatomiska joner. Till exempel, när två kloratomer bildar en klormolekyl, delar de ett par elektroner:

Lewis-strukturen indikerar att varje Cl-atom har tre par elektroner som inte används i bindning (kallas ensamma par) och ett delat elektronpar (skrivet mellan atomerna). Ett streck (eller linje) används ibland för att indikera ett delat elektronpar:

ett enda delat par elektroner kallas en enda bindning. Varje CL-atom interagerar med åtta valenselektroner: de sex i de ensamma paren och de två i singelbindningen.
oktettregeln
de andra halogenmolekylerna (F2, Br2, I2 och At2) bildar bindningar som de i klormolekylen: en enda bindning mellan atomer och tre ensamma par elektroner per atom. Detta gör att varje halogenatom kan ha en ädelgaselektronkonfiguration. Tendensen hos huvudgruppatomer att bilda tillräckligt med bindningar för att erhålla åtta valenselektroner är känd som oktettregeln.
antalet bindningar som en atom kan bilda kan ofta förutsägas från antalet elektroner som behövs för att nå en oktett (åtta valenselektroner); detta gäller särskilt icke-metallerna i den andra perioden i det periodiska systemet (C, N, O och F). Till exempel har varje atom i ett Grupp 14-element fyra elektroner i sitt yttersta skal och kräver därför ytterligare fyra elektroner för att nå en oktett. Dessa fyra elektroner kan erhållas genom att bilda fyra kovalenta bindningar, som illustreras här för kol i CCl4 (koltetraklorid) och kisel i SiH4 (silan). Eftersom väte bara behöver två elektroner för att fylla sitt valensskal, är det ett undantag från oktettregeln. Övergångselementen och de inre övergångselementen följer inte heller oktettregeln:

Grupp 15 element som kväve har fem valenselektroner i atom Lewis-symbolen: ett ensamt Par och tre oparade elektroner. För att erhålla en oktett bildar dessa atomer tre kovalenta bindningar, som i NH3 (ammoniak). Syre och andra atomer i Grupp 16 erhåller en oktett genom att bilda två kovalenta bindningar:
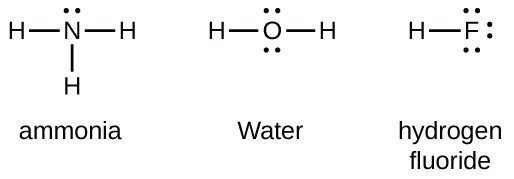
dubbel-och trippelbindningar
som tidigare nämnts, när ett par atomer delar ett par elektroner, kallar vi detta en enda bindning. Ett par atomer kan dock behöva dela mer än ett par elektroner för att uppnå den erforderliga oktetten. En dubbelbindning bildas när två par elektroner delas mellan ett par atomer, mellan kol-och syreatomerna i CH2O (formaldehyd) och mellan de två kolatomerna i C2H4 (etylen):
en trippelbindning bildas när tre elektronpar delas av ett par atomer, som i kvävgas (N2):
skriva Lewis-strukturer med oktettregeln
för mycket enkla molekyler och molekylära joner kan vi skriva Lewis-strukturerna genom att bara para ihop de oparade elektronerna på de ingående atomerna. Se dessa exempel:

för mer komplicerade molekyler och molekylära joner är det bra att följa steg-för-steg-proceduren som beskrivs här:
- bestäm det totala antalet valenselektroner (yttre skal).
- rita en skelettstruktur av molekylen, arrangera atomerna runt en central atom. (I allmänhet bör det minst elektronegativa elementet placeras i mitten.) Anslut varje atom till den centrala atomen med en enda bindning (ett elektronpar).
- fördela de återstående elektronerna som ensamma par på terminalatomerna (utom väte) och slutföra en oktett runt varje atom.
- placera alla återstående elektroner på den centrala atomen.
- omorganisera elektronerna i de yttre atomerna för att göra flera bindningar med den centrala atomen för att erhålla oktetter där det är möjligt.
Låt oss bestämma Lewis-strukturen för PBr3 med hjälp av stegen ovan:
- Steg 1: Bestäm det totala antalet valenselektroner (yttre skal).
\stor \ begin{array}{l}\ \ \ phantom {\rule{0.8 em}{0ex}} {\text{PBr}} _ {3}\\ \phantom{\rule{0.8 em}{0ex}}\text{p: 5 valenselektroner/atom}\gånger \text{1 atom}=5\\ \understryka{+\text{Br: 7 valenselektron/atom}\gånger \text{3 atomer}=21}\\ \\ \phantom{\rule{15.95em}{0ex}}= \ text{26 valenselektroner} \ end{array}
- steg 2: rita en skelettstruktur av molekylen, arrangera atomerna runt en central atom. (I allmänhet bör det minst elektronegativa elementet placeras i mitten.) Anslut varje atom till den centrala atomen med en enda bindning (ett elektronpar).

- steg 3: fördela de återstående elektronerna som ensamma par på terminalatomerna (utom väte) och slutföra en oktett runt varje atom.
-
 steg 4: Placera alla återstående elektroner på den centrala atomen.
steg 4: Placera alla återstående elektroner på den centrala atomen.

Obs: Steg 5: behövs inte eftersom alla atomer har en oktett.
Låt oss bestämma Lewis-strukturen för CH2O.
- Steg 1: Bestäm det totala antalet Valens (yttre skal) elektroner.
\stor \begin{array}{l}\\ \phantom{\rule{0.8 em}{0ex}}{\text{H}_{2}}\text{CO}\\ \phantom{\rule{0.8 em}{0ex}}\text{H: 1 valenselektron/atom}\gånger \text{2 atom}=2\\\text{C: 4 valenselektroner/atom}\gånger \text{1 atom}=4\\ \understryka{+\text{o: 6 valenselektroner/atom}\gånger \text{1 atomer}=6}\\ \\ \fantom{\rule{15.95 em}{0EX}}=\text{12 valenselektroner}\end{array}
- steg 2: rita en skelettstruktur av molekylen, arrangera atomerna runt en central atom. (I allmänhet bör det minst elektronegativa elementet placeras i mitten.) Anslut varje atom till den centrala atomen med en enda bindning (ett elektronpar).

- steg 3: fördela de återstående elektronerna som ensamma par på terminalatomerna (utom väte) och slutföra en oktett runt varje atom.

- steg 4: behövs inte, eftersom alla elektroner har placerats. Kol har emellertid inte en oktett,
- Steg 5: Omorganisera elektronerna hos de yttre atomerna för att göra flera bindningar med den centrala atomen för att erhålla oktetter där det är möjligt.

exempel 1: Att skriva Lewis-strukturer
NASA: s Cassini-Huygens-uppdrag upptäckte ett stort moln av giftig vätecyanid (HCN) på Titan, en av Saturnus månar. Vad är Lewis-strukturerna för dessa molekyler?
kontrollera ditt lärande
koldioxid, CO2, är en produkt av förbränning av fossila bränslen. CO2 har varit inblandad i globala klimatförändringar. Vad är Lewis-strukturen för CO2?
nyckelbegrepp och sammanfattning
Valens elektroniska strukturer kan visualiseras genom att rita Lewis-symboler (för atomer och monatomiska joner) och Lewis-strukturer (för molekyler och polyatomiska joner). Ensamma par, oparade elektroner och enkel -, dubbel-eller trippelbindningar används för att indikera var valenselektronerna finns runt varje atom i en Lewis-struktur. De flesta strukturer—särskilt de som innehåller andra radelement—följer oktettregeln, där varje atom (utom H) omges av åtta elektroner. Undantag från oktettregeln förekommer för odd-elektronmolekyler (fria radikaler), elektronbristande molekyler och hypervalenta molekyler.
övningar
- skriv Lewis-symbolerna för var och en av följande joner:
- As3 –
- I –
- Be2 +
- O2 –
- Ga3 +
- Li +
- N3–
- många monatomiska joner finns i havsvatten, inklusive joner bildade från följande lista över element. Skriv Lewis-symbolerna för de monatomiska joner som bildas av följande element:
- Cl
- Na
- Mg
- Ca
- K
- Br
- Sr
- F
- skriv Lewis-symbolerna för jonerna i var och en av följande joniska föreningar och Lewis-symbolerna för atomen från vilken de bildas:
- MgS
- Al2O3
- GaCl3
- K2O
- Li3N
- KF
- i Lewis-strukturerna som anges nedan representerar M och X olika element i den tredje perioden av det periodiska systemet. Skriv formeln för varje förening med de kemiska symbolerna för varje element:
- skriv Lewis-strukturen för den diatomiska molekylen P2, en instabil form av fosfor som finns i fosforånga med hög temperatur.
- skriv Lewis-strukturer för följande:
- H2
- HBr
- PCl3
- skriv Lewis-strukturer för följande:
- O2
- H2CO
- AsF3
- SiCl4
ordlista
dubbelbindning: kovalent bindning där två par elektroner delas mellan två atomer
fri radikal: molekyl som innehåller ett udda antal elektroner
hypervalent molekyl: molekyl som innehåller minst ett huvudgruppselement som har mer än åtta elektroner i sitt valensskal
Lewis struktur: diagram som visar ensamma par och bindningspar av elektroner i en molekyl eller en jon
Lewis symbol: symbol för ett element eller monatomisk jon som använder en punkt för att representera varje valenselektron i elementet eller Jonen
ensampar: två (ett par) valenselektroner som inte används för att bilda en kovalent bindning
oktettregel: riktlinje som anger huvudgruppatomer kommer att bilda strukturer där åtta valenselektroner interagerar med varje kärna, räknar bindningselektroner som interagerar med båda atomerna som är förbundna med bindningen
enkelbindning: bindning där en enstaka elektronpar delas mellan två atomer
trippelbindning: bindning där tre par elektroner delas mellan två atomer


 HCN: inga elektroner kvar
HCN: inga elektroner kvar




















