introduktion
spänningsstyrda kaliumkanaler bildar en stor och mångfaldig familj som evolutionärt bevaras. Det finns 40 humana spänningsstyrda kaliumkanalgener som tillhör 12 underfamiljer. Dessa kV-kanaler visar breda fördelningar i nervsystemet och andra vävnader. För exciterbara celler som neuroner, kardiomyocyter och muskler reglerar KV-kanaler vågformen och avfyrningsmönstret för åtgärdspotentialer. KV-kanaler kan också reglera cellvolymen, proliferationen och migrationen av ett brett spektrum av celltyper.
Spänningsgrindade kaliumkanaler (KV) tillhör en av de största och mycket evolutionärt konserverade jonkanalfamiljerna . Varje kv-kanal innehåller fyra liknande eller identiska porbildande underenheter i enlighet med denna förordning, och den kan också innehålla extra underenheter i enlighet med denna förordning som kan påverka kanalfunktionen och/eller lokaliseringen . Varje porbildande underenhet av KV-kanaler innehåller sex transmembransegment (S1-S6), med de första fyra transmembransegmenten (S1-S4) som utgör spänningssensorn och de två sista transmembransegmenten som flankerar en porslinga (S5-P-S6) som pordomän. Förutom kromosomplaceringen för varje kv-kanalgen i människa, mus och råtta har kanalens fysiologiska och farmakologiska egenskaper och dess vävnadsfördelning och patofysiologi tillhandahållits av Jonkanaldatabasen av Underutskottet för Spänningsgrindade kaliumkanaler från Nomenklaturutskottet för International Union of Pharmacology (NC-IUPHAR). Denna artikel presenterar en introduktion till mångfalden och funktionerna hos spänningsstyrda kaliumkanaler.
evolutionär bevarande av kaliumkanaler
K+-selektiviteten som uppstod i prokaryoter bevaras i ett stort antal kaliumkanaler med anmärkningsvärd mångfald . Som visas i Figur 1 kan ett evolutionärt träd av den spänningsstyrda katjonkanalsfamiljen föreslås baserat på jämförelsen av kanalgener i det mänskliga genomet med de i genomerna hos andra metazoaner inklusive mus, kyckling, Pufferfisk, tunika, fruktfluga, mygga, nematod och havsanemon . Detta evolutionära träd föreställer sig ett enda ursprung för K + – selektiviteten för inåt likriktande kaliumkanaler (Kir), spänningsstyrda kaliumkanaler (KV) och tvåporkaliumkanaler (K2P). Det är dock viktigt att notera att en distinkt K+-selektivitet sannolikt är associerad med den evolutionärt konserverade organell k+ – kanalen som finns i endosomer och lysosomer .
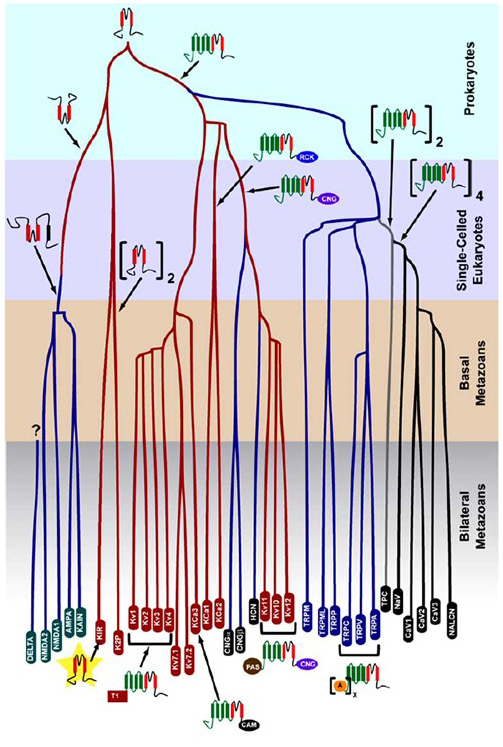
Figur 1. Ett evolutionärt träd för uppkomsten av den spänningsstyrda katjonkanalen superfamilj. Baserat på genomomfattande analyser av jonkanaler från cnidarians och bilaterala metazoaner , visar detta evolutionära träd ett gemensamt ursprung för K+-selektiviteten hos kaliumkanaler (med familjenamn i röda ovaler), som är relaterade till tetramera cykliska nukleotid-gated katjon (CNG) kanaler, hyperpolarisering-gated katjon (HCN) kanaler och TRP-kanaler, de dimera TPC-kanalerna och de monomer Na+, Ca2+ och NALCN kanaler. Grenlängderna återspeglar inte tiden. Genfamiljenamnen längst ner markerar enskilda grenar. Jonotropa glutamatreceptorer ingår baserat på hypotesen att de härstammar från en inversion av den kaliumkanalporbildande domänen med två transmembransegment (röd). Spänningssensordomänen har fyra transmembransegment (grön). A: ankryin upprepar; CAM: kalmodulin-bindande domän; CNG: cyklisk nukleotidbindande domän; PAS: per-ARNT-Sim-domän; RCK: regulator för konduktans av K+ domän; T1: tetrameriseringsdomän.
mångfald av spänningsstyrda kaliumkanaler
det mänskliga genomet innehåller ~80 kaliumkanalgener varav 40 gener kodar spänningsstyrda kaliumkanalporbildande underenheter som faller i 12 underfamiljer (Fig. 2). Fysiologiskt uppdelad i kaliumkanaler av A-typ som visar snabb inaktivering och fördröjda likriktarkaliumkanaler utan snabb inaktivering, dessa KV-kanaler är molekylärt och funktionellt olika. Snabb inaktivering, som kan påverka åtgärdspotentialens varaktighet under repetitiv avfyring, framgår av KV1-kanaler som innehåller KV1.4 eller Kv1, KV3 kanaler och KV4 kanaler . Den fördröjda likriktaren kaliumström ursprungligen kännetecknas av Hodgkin och Huxley för sin roll i åtgärdspotential sannolikt motsvarar squid KV1 kanaler som kan förlita sig på RNA redigering för att uppnå den flexibla funktionella mångfalden så många små axoner av jätte fiber lob neuroner säkring för att bilda bläckfisk jätte axon med större aktionspotential ledningshastighet .
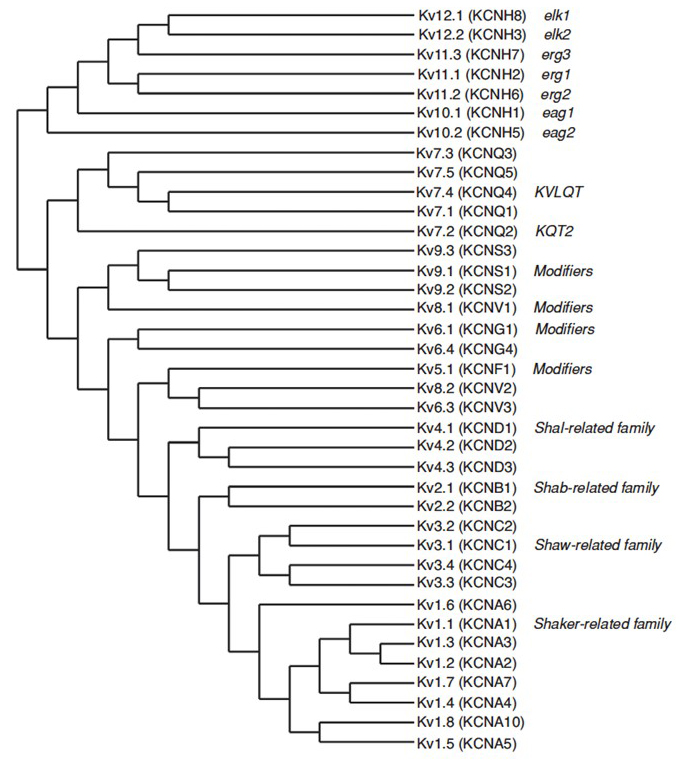
Figur 2. Fylogenetiskt träd för KV1 – 12-familjerna. Detta fylogenetiska träd genereras baserat på analyser av den hydrofoba domänen som innehåller de sex transmembransegmenten (S1-S6) . Både iuphar och hgnc (inom parentes) namn visas, tillsammans med andra vanliga namn för dessa spänningsstyrda kaliumkanaler.
anmärkningsvärd mångfald av KV-kanaler kan uppnås på grund av blandning och matchning av KV-kanalunderenheter. Inom var och en av KV1 -, KV2 -, KV3 -, KV4-och KV7-familjerna kan homomera och heteromera kanaler bildas med en rad funktionella egenskaper . KV2 familjemedlemmar kan också samlas med KV5, KV6, KV8 eller KV9 familjemedlemmar med mer begränsade uttrycksmönster i nervsystemet och släta muskler , som illustreras schematiskt i Fig. 3.

Figur 3. KV-kanaldiversitet via blandning och matchning av porbildande kanalunderenheter. (A) de tetrameriska KV-kanalerna med olika egenskaper och distribution omfattar homomera KV1 -, KV2 -, KV3 -, KV4-och KV7-kanaler, heteromera kanaler bildade av olika medlemmar inom var och en av dessa kV-kanalfamiljer och heteromera kanaler bildade genom sammansättning av KV2-familjemedlemmar med KV5 -, KV6 -, KV8-eller KV9-familjemedlemmar . KV5, KV6, KV8 och KV9 familjer ger upphov till homomera kanaler som är elektriskt tysta sannolikt på grund av deras kvarhållande i endoplasmatisk retikulum , därför kallas de KVS. (B) sammansättning av KV2 – och KVS-familjemedlemmar involverar deras cytoplasmatiska n-och C-terminala domäner. (C, D) montering av KV2-och KVS-familjemedlemmar ger upphov till heteromera kanaler med olika spänningsberoende (C) och grindmekanismer (D) jämfört med homomera kanaler bildade av KV2-familjemedlemmar .
funktionella skillnader i spänningsberoende och kinetik hos KV-kanaler ligger till grund för deras differentiella bidrag till åtgärdspotentialmodulering (Fig. 4). Medan KV1 -, KV4-och KV7-kanaler kräver låga nivåer av membrandepolarisering för deras aktivering aktiveras KV2-och KV3-kanaler genom större depolarisering. De tidigare, lågspänningsaktiverade, KV-kanalerna kan påverka tröskeln för aktionspotentialgenerering och antalet aktionspotentialer som genereras under depolarisering eller excitatoriska synaptiska potentialer. Däremot kan de högspänningsaktiverade KV-kanalerna modulera åtgärdspotentialens varaktighet och avfyrningsmönster . Kinetiken hos KV-kanaler påverkar också hur de bidrar till generering av handlingspotential. Medan de LÅGSPÄNNINGSAKTIVERADE KV1-kanalerna med snabb aktivering kan påverka åtgärdspotentialtröskeln och vågformen, kan de högspänningsaktiverade KV3-kanalerna och KV2-kanalerna aktiveras sekventiellt under en åtgärdspotential på grund av skillnaden i deras aktiveringskinetik, och KV2-kanaler kan ha mer långvariga effekter på grund av deras långsamma inaktiveringskinetik. Dessutom kan KV4-kanaler med snabb inaktivering bidra till skillnaden i åtgärdspotentialvågformen under repetitiv avfyrning på grund av undertryckande av KV4-kanalaktiviteten genom depolarisering .
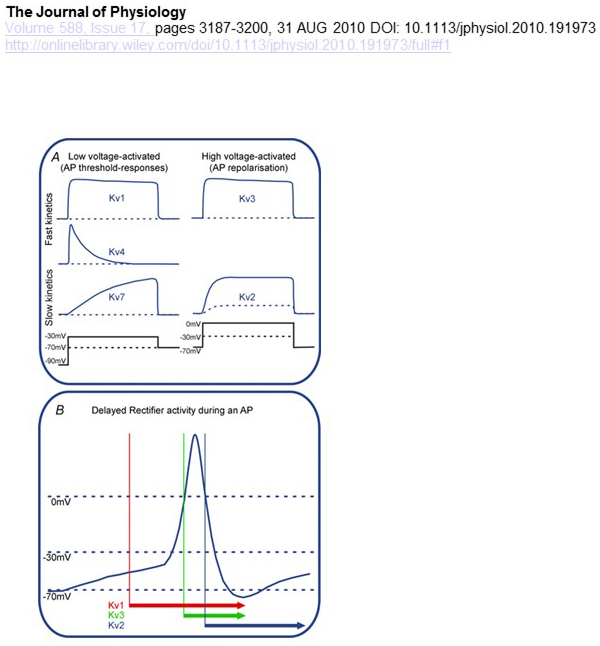
Figur 4. Funktionella skillnader i kv-kanaler och deras bidrag till åtgärdspotentialen. (A) olika KV-kanaler har olika spänningsberoende för aktivering och olika kinetik . (B) de LÅGSPÄNNINGSAKTIVERADE KV1-kanalerna med snabb kinetik öppen när cellen depolariseras mot tröskeln för aktionspotentialgenerering. Medan både KV2-och KV3-kanaler är högspänningsaktiverade öppnas KV3-kanaler tidigare än KV2-kanaler under en åtgärdspotential. KV2-kanaler kan också ta längre tid att stänga efter en åtgärdspotential .
potentiella terapeutiska tillämpningar av kaliumkanalmodulatorer
kaliumkanalmodulatorernas förmåga att ändra åtgärdspotentialbränningsmönster har väckt frågan om de kan vara av terapeutiskt värde . Såsom anges i Fig. 5, olika neurologiska och psykiska störningar kan innebära förändringar i åtgärdspotentialbränningsmönster, som kan moduleras av KV-kanalaktivatorer och blockerare . Spänningsgrindade kaliumkanaler kan också spela en roll i cellproliferation och migration; KV – kanalmodulatorer har därför beaktats för potentiella behandlingar av cancertillväxt och metastasering . I Fig. 6, KV1.2-kanalstrukturen används schematiskt för att illustrera att KV-kanalmodulatorer kan hämma kanalaktivitet antingen genom att ockludera kanalgenomträngningsvägen, som i fallet med yttre porblockerande toxiner och inre porblockerare, eller via deras interaktion med spänningssensorn för att stabilisera kanalens stängda tillstånd, som i fallet med gating modifierings toxiner. Alternativt verkar vissa små molekyler genom att binda till grindmaskineriet som grindmodifierare, eller genom att interagera med gränssnittet mellan underenheterna för att ändra kanalaktivitet .
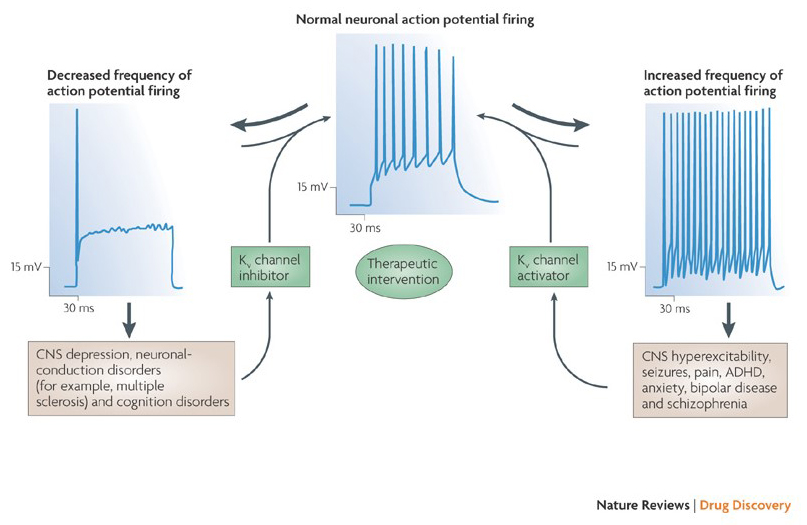
Figur 5. Potentiella tillämpningar av KV kanalmodulatorer. Eftersom onormala åtgärdspotentialbränningsmönster har associerats med sjukdomar såsom epilepsi och multipel skleros, KV-kanalaktivatorer och hämmare har beaktats för potentiella terapeutiska behandlingar av sjukdomar som involverar förändring av neuronal excitabilitet .
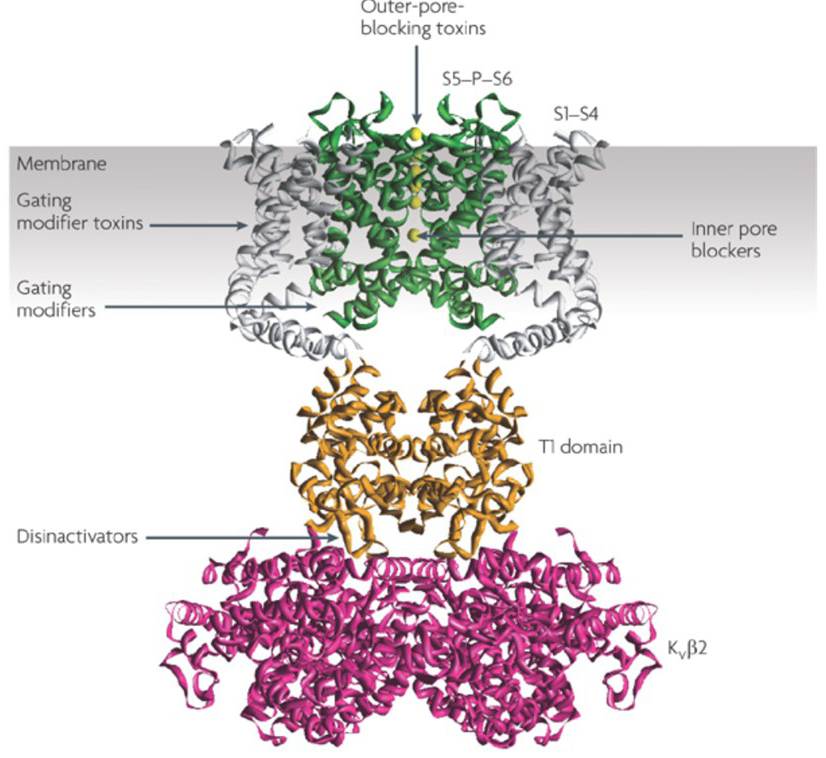
Figur 6. Exempel på verkningssätt för KV – kanalmodulatorer. Det finns flera olika sätt för peptidtoxiner och små molekyler att modulera KV-kanalaktivitet. KV1 .2-strukturen visas med pordomänerna (S5-P-S6) i grönt, spänningssensordomänerna (S1-S4) i grått, T1-tetrameriseringsdomänerna i orange och kv-underenheterna för extra enheter i Magenta. Yttre porblockerande toxiner från skorpioner, havsanemoner, ormar och kon sniglar kan binda till den yttre vestibulen och blockera jongenomträngning. Gating modifierings toxiner från spindlar såsom hanatoxin kan interagera med spänningssensorn för att öka stabiliteten hos det stängda tillståndet, vilket orsakar höger förskjutning av spänningsberoendekurvan för kanalaktivering. Det finns också små molekylkanalmodulatorer som binder till den inre poren (inre porblockerare), grindgångjärnen (grindmodifierare) eller gränssnittet mellan subenheterna för 2 – och 2-underenheter (disinaktivatorer) .
spänningsstyrd kaliumkanalstruktur
den anmärkningsvärda selektiviteten hos kaliumkanaler, som tillåter K+-joner att gå igenom kanalporen med storleksordningar större lätthet än de mindre Na+-jonerna och med nära diffusionsbegränsad hastighet , förklaras av förmågan hos ryggradskarbonylerna i selektivitetsfiltret att samordna K+ – joner som till stor del avlägsnas av deras hydratiseringsskal , så att mer än en K+ – Jon kommer att röra sig genom detta smalaste segment av poren i tandem (fig. 7) – en lång por för enda fil K+ Jon permeation som bygger .
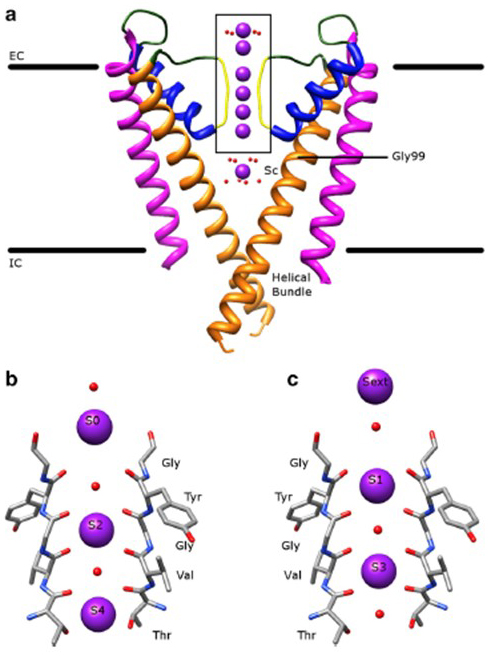
Figur 7. Pordomänen för kaliumkanaler. (a) struktur av KcsA i ledande tillstånd (PDB: 1k4c), med de yttre spiralerna i magenta, inre spiraler i orange, porspiraler i blått och selektivitetsfiltret i gult. K + joner är i lila medan dess omgivande vattenmolekyler är i rött. EC: extracellulär; IC: intracellulär. (b, c) selektivitetsfiltret i det boxade området av KcsA-strukturen visas med K+ – joner som upptar antingen S2-och S4-positionerna (b) eller S1-och S3-positionerna (c) för att illustrera K+ – jonpermeation i en enda fil .
spänningsberoendet för KV-kanalaktivering härrör från deras spänningssensordomäner . Såsom visas i Fig. 8, KV-kanaler och relaterade kanaler som spänningsstyrda natriumkanaler och TRPV1-kanaler i samma superfamilj har liknande arrangemang av sina pordomäner och spänningssensordomäner. Spänningssensordomänen för en subenhet interagerar med pordomänen för en angränsande subenhet i en domänbyteskonfiguration, och inom en spänningssensor kan de positivt laddade argininresterna på S4 interagera med negativt laddade sura rester i angränsande spiraler (Fig. 9).
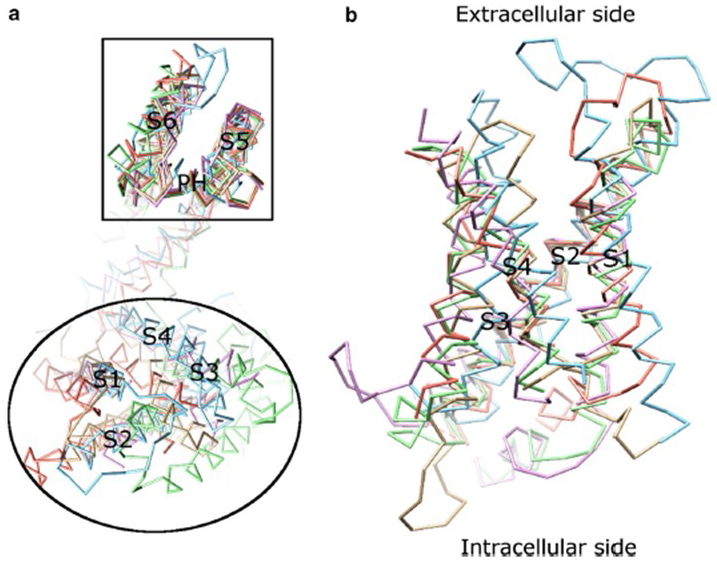
figur 8. Spänningssensordomänen för spänningsgrindade kaliumkanaler. (a) att anpassa pordomänen (S5-P-S6) för olika jonkanaler avslöjar att deras spänningssensordomäner (S1-S4) kan ta olika riktningar (sett från den extracellulära sidan). (b) överlagring av spänningssensordomänen för KV1.2 (PDB: 3LUT, ljus magenta) med spänningssensordomänerna för MlotiK1 (PDB: 3beh, ljusbrun) , NaVAb (PDB: 3rvy, ljusgrön) , NaVRh (PDB: 4DXW, ljusorange) och TRPV1 (PDB: 3j5p, ljusblå) (sett från membranet) .
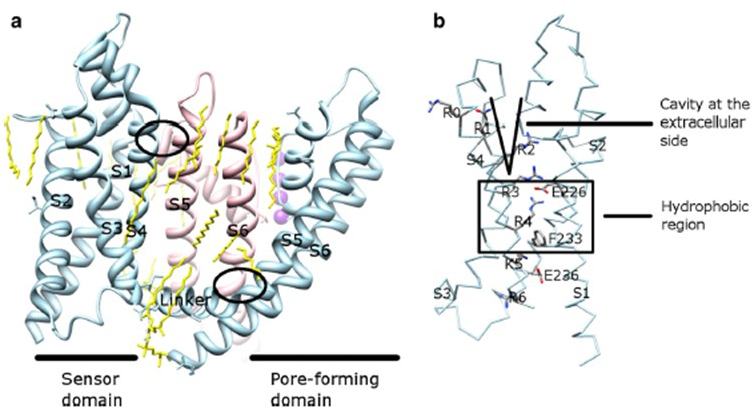
Figur 9. Kontakter mellan pordomänen och spänningssensordomänen för KV-kanaler. (a) KV1.2-KV2.1-chimären (PDB: 2r9r) med spänningssensordomänen för en underenhet (Ljusblå) som kontaktar pordomänen för en angränsande underenhet (rosa). Kontakterna på den intracellulära sidan involverar interaktionen mellan S4-S5-länkaren och S6, och kontakterna på den extracellulära sidan involverar interaktionen mellan S1 och porhelixen . Lipider (gul) som omger kanalen och mellan pordomänen och spänningssensordomänen är detekterbara i kristallstrukturen. B) Basrester av S4 och sura rester i deras närhet i spänningsgivardomänen .
Kanalopatier kopplade till spänningsstyrda kaliumkanaler
spänningsstyrda kaliumkanaler uttrycks i stort sett i en mängd olika vävnader. I neuroner riktar de sig till olika subcellulära fack (Fig. 10), och kanaler med olika subenhetskompositioner kan vara närvarande i olika subpopulationer av neuroner . Mutationer av kv-kanalgener kan orsaka neurologiska sjukdomar såsom episodisk ataxi och epilepsier, hjärtsjukdomar och dövhet . Evolutionär bevarande av KV-kanalfunktionen är uppenbar, till exempel från liknande rörelsestörningar orsakade av mutation av KV1-orthologer hos människa, mus och fruktfluga .
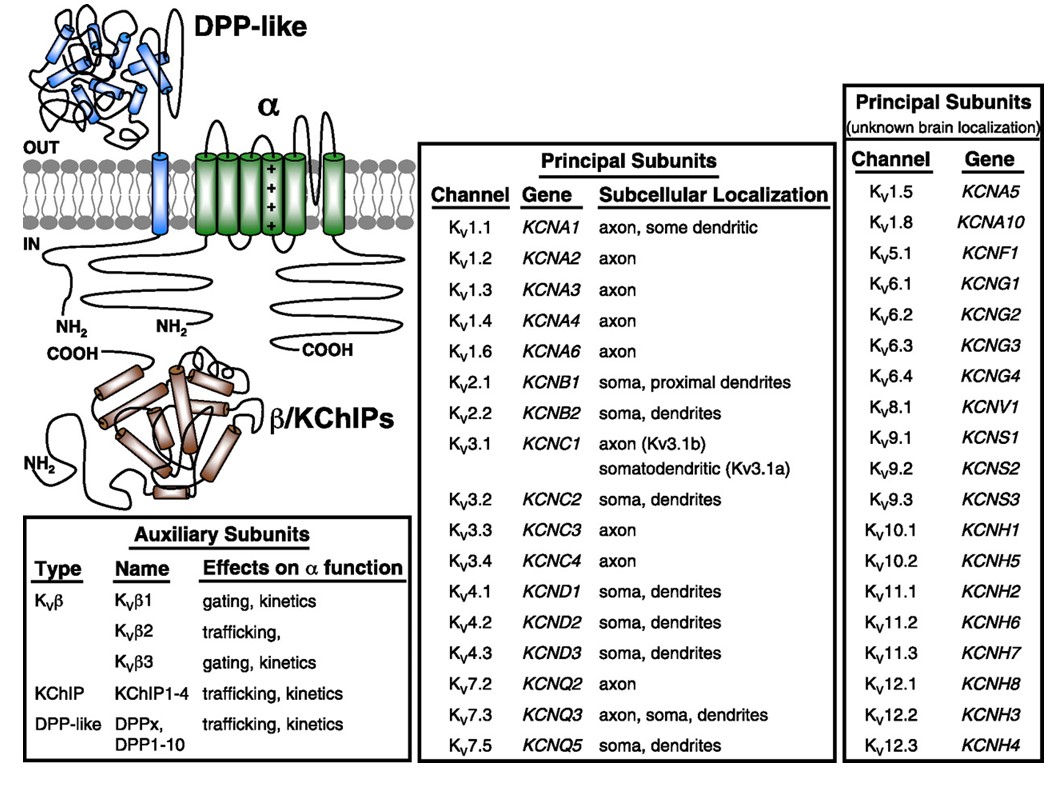
Figur 10. Subcellulär fördelning av spänningsgrindade kaliumkanaler. Schemat längst upp till vänster visar en KV4-kanal med två olika hjälpunderenheter. Subcellulär lokalisering av olika KV-kanaler i däggdjurscentrala neuroner indikeras i mittrutan .
referenser och anteckningar
1.Hille, B., Joniska kanaler av exciterbara membran, 3: e, Ed. 2001: Sinauer Associates Inc.
2.Gonzalez, C., et al., K ( + ) kanaler: funktion-strukturell översikt. Compr Physiol, 2012. 2 (3): s. 2087-149.
3.Vacher, H., D. P. Mohapatra och J. S. Trimmer, lokalisering och inriktning av spänningsberoende jonkanaler i däggdjurscentrala neuroner. Physiol Rev, 2008. 88 (4): s. 1407-47.
4.Jegla, T. J., et al., Utveckling av den mänskliga jonkanaluppsättningen. Kam Chem Hög Genomströmning Skärm, 2009. 12 (1): s. 2-23.
5.Cang, C., et al., TMEM175 är en organell K ( + ) kanal som reglerar Lysosomal funktion. Cell, 2015. 162 (5): s. 1101-12.
6.Hodgkin, A. L. Och A. F. Huxley, strömmar som bärs av natrium-och kaliumjoner genom membranet i den jätte axonen i Loligo. J Physiol, 1952. 116 (4): s. 449-72.
7.Rosenthal, J. J., T. I. Liu och W. F. Gilly, en familj av fördröjd likriktare KV1 cDNA som visar celltypsspecifikt uttryck i squid stellate ganglion/giant fiber lobe complex. J Neurosci, 1997. 17 (13): s. 5070-9.
8.Young, J. Z., sammansmälta neuroner och synaptiska kontakter i bläckfiskens jätte nervfibrer. Phil Trans R Soc Lond B, 1939. 229: s. 465-503.
9.Rosenthal, JJ och F. Bezanilla, omfattande redigering av mRNA för squid fördröjd likriktare K+ kanal reglerar subenhet tetramerisering. Neuron, 2002. 34 (5): s. 743-57.
10.Jan, L. Y. och Y. N. Jan, spänningsstyrda kaliumkanaler och mångfalden av elektrisk signalering. J Physiol, 2012. 590 (11): s. 2591-9.
11.Johnston, J., I. D. Forsythe och C. Kopp-Scheinpflug, går native: spänningsgrindade kaliumkanaler som styr neuronal excitabilitet. J Physiol, 2010. 588 (Pt 17): s. 3187-200.
12.Bocksteins, E., KV5, KV6, KV8 och KV9 underenheter: inga enkla tysta åskådare. J Gen Physiol, 2016. 147 (2): s. 105-25.
13.Wulff, H., na Castle och La Pardo, Spänningsgrindade kaliumkanaler som terapeutiska mål. Nat Rev Drug Discov, 2009. 8 (12): s. 982-1001.
14.Bates, E., Jonkanaler i utveckling och cancer. Annu Rev Cell Dev Biol, 2015. 31: s. 231-47.
15.Huang, X. och L. Y. Jan, som riktar sig mot kaliumkanaler i cancer. J Cell Biol, 2014. 206 (2): s. 151-62.
16.Huang, X., et al., EAG2 kaliumkanal med evolutionärt konserverad funktion som ett hjärntumörmål. Nat Neurosci, 2015. 18 (9): s. 1236-46.
17.Kunzelmann, K., jonkanaler och cancer. J Membr Biol, 2005. 205 (3): s. 159-73.
18.Li, M. och Z. G. Xiong, jonkanaler som mål för cancerterapi. Int J Physiol Pathophysiol Pharmacol, 2011. 3 (2): s. 156-66.
19.Pardo, L. A., Spänningsgrindade kaliumkanaler i cellproliferation. Fysiologi (Bethesda), 2004. 19: s. 285-92.
20.Urrego, D., et al., Kaliumkanaler i cellcykel och cellproliferation. Philos Trans R Soc Lond B Biol Sci, 2014. 369 (1638): s. 20130094.
21.Zhou, Y., et al., Kemi av jonkoordinering och hydrering avslöjad av ett K+-kanal-Fab-komplex vid 2.0 a-upplösning. Natur, 2001. 414 (6859): s. 43-8.
22.MacKinnon, R., kaliumkanaler. FEBS Lett, 2003. 555 (1): s. 62-5.
23.Kuang, Q., P. Purhonen och H. Hebert, struktur av kaliumkanaler. Cell Mol Life Sci, 2015. 72 (19): s. 3677-93.
24.Isacoff, Ey, Ly Jan och dl Minor, Jr., ledningar av livets gnista: ett perspektiv på jonkanalforskning sedan neurons födelse. Neuron, 2013. 80 (3): s. 658-74.
25.Swartz, kj, känner av spänning över lipidmembran. Natur, 2008. 456 (7224): s. 891-7.
26.Nusser, Z., differentiell subcellulär fördelning av jonkanaler och mångfalden av neuronal funktion. Curr Opin Neurobiol, 2012. 22 (3): s. 366-71.
27.Lujan, R., Organisation av kaliumkanaler på neuronytan. J Chem Neuroanat, 2010. 40 (1): s. 1-20.
28.Abriel, H. och E. V. Zaklyazminskaya, Hjärtkanalopatier: genetiska och molekylära mekanismer. Gene, 2013. 517 (1): s. 1-11.
29.Kullmann, D. M. och M. G. Hanna, neurologiska störningar orsakade av ärftliga jonkanalmutationer. Lancet Neurol, 2002. 1 (3): s. 157-66.
30.Lehmann-Horn, F. och K. Jurkat-Rott, Spänningsgrindade jonkanaler och ärftlig sjukdom. Physiol Rev, 1999. 79 (4): s. 1317-72.
31.Villa, C. Och R. Combi, kaliumkanaler och Humana epileptiska fenotyper: en uppdaterad översikt. Främre Cell Neurosci, 2016. 10: s. 81.
32.Long, S. B., E. B. Campbell och R. Mackinnon, kristallstruktur av en däggdjursspänningsberoende Shaker-familj K + – kanal. Vetenskap, 2005. 309 (5736): s. 897-903.
33.Chen, X., et al., Struktur av den fullängds Shaker kaliumkanalen KV1.2 genom normal-mode-baserad Röntgenkristallografisk förfining. Proc Natl Acad Sci USA, 2010. 107 (25): s. 11352-7.
34.Clayton, G. M., et al., Struktur av transmembranregionerna i en bakteriell cyklisk nukleotidreglerad kanal. Proc Natl Acad Sci USA, 2008. 105 (5): s. 1511-5.
35.Payandeh, J., et al., Kristallstrukturen hos en spänningsgrindad natriumkanal. Natur, 2011. 475 (7356): s. 353-8.
36.Zhang, X., et al., Kristallstruktur av en ortolog av NaChBac spänningsstyrd natriumkanal. Natur, 2012. 486 (7401): s. 130-4.
37.Liao, M., et al., Struktur av TRPV1-jonkanalen bestämd av elektronkryomikroskopi. Natur, 2013. 504 (7478): s. 107-12.
38.Long, S. B., et al., Atomstruktur av en spänningsberoende K + – kanal i en lipidmembranliknande miljö. Natur, 2007. 450 (7168): S. 376-82.