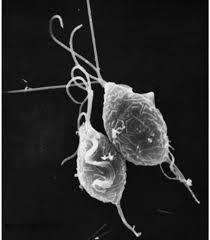
denne bisarre udseende pæreformede organisme er Trichomonas vaginalis, den enkeltcellede parasit, der er ansvarlig for den mest almindelige ikke-viralt seksuelt overførte sygdom i verden, trichomoniasis.
mennesker er den eneste vært for T. vaginalis, og direkte transmission sker fra person til person under samleje. Parasitten reproducerer ved binær fission, og der er ingen tegn på cystedannelse. Det er anaerobt, mangler en mitokondrion, og er en obligatorisk parasit, der befinder sig i de urogenitale kanaler hos mænd og kvinder, hvor den bevæger sig rundt ved hjælp af fire trådlignende filamenter kaldet flagella.
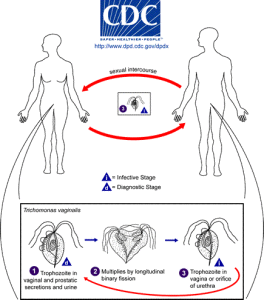
i 2008 anslog Verdenssundhedsorganisationen, at 276 millioner mennesker blev smittet over hele verden. For at sætte dette i sammenhæng er alene i USA 3, 1% af kvinderne mellem 14-45 år smittet. Selvom de fleste af disse infektioner er symptomløse, kan infektion føre til vaginitis, cervicitis eller prostatitis og er forbundet med en øget risiko for HIV-infektion og livmoderhalskræft eller prostatacancer. Det kan også påvirke resultatet af graviditeten negativt.
hvordan forårsager det patologi?
T. vaginalis binder sig til flere typer værtsceller, såsom dem, der forer vagina og næsegrus (epitelceller). Cellerne lyser derefter frigørende næringsstoffer til parasitten. Hvordan det binder sig til celler og forårsager deres lysis er dårligt forstået, selvom kontakt med værtscellerne vides at være nødvendig for deres lysis.
hvis celleadhæsion er et indledende trin i eventuel cellelyse, er det sandsynligt, at molekyler på overfladen af parasitten er involveret i denne proces. Vi ved, at parasitten er belagt med lipophosphoglycan (LPG) molekyler, der binder til et pattedyrprotein på celleoverfladen kaldet galectin-1. Men hvis galectinproduktionen er slået ned i pattedyrceller, reduceres parasitbinding kun en lille mængde. Så dette er ikke hele historien.
det har også vist sig, at T. vaginalis klæber specifikt til vaginal epitelcelle ved hjælp af proteiner kaldet adhæsiner og cysteinproteaser har også vist sig at være involveret i cytoadherens og andre aspekter af patogenese.
i 2010 nærmede Patricia Johnson problemet ved at se på parasitproteiner. Hendes team identificerede proteiner på overfladen af seks stammer af T. vaginalis med varierende evne til at klæbe til værtsceller. De fandt 11 proteiner, der var mere rigelige i de mere klæbende stammer, og når to af disse blev overudtrykt i mindre klæbende stammer, steg adhærensen.
rollen af rhomboidlignende proteiner
for nylig vendte Johnson-gruppen deres opmærksomhed mod to T. vaginalis rhomboid-lignende proteiner. Disse rhomboidproteiner er serinproteaser placeret på cellemembraner med deres aktive steder i lipid-dobbeltlaget. De spalter andre transmembranproteiner, og spaltningsprodukterne frigives normalt til ydersiden af cellen. De regulerer en lang række biologiske funktioner, og i andre protosoiske parasitter har det vist sig at spalteadhæsionsmolekyler.
Bioinformatisk analyse afslørede 4 rhomboidproteiner, der sandsynligvis ville være aktive proteaser i T. vaginalis. En af disse, TvROM1 viste sig at være placeret på celleoverfladen. TvROM2 og 3 var placeret til Golgi-apparatet, og TvROM4 kunne ikke lokaliseres og blev slettet fra undersøgelsen.
for at bestemme, om rhomboidproteiner faktisk var involveret i værtscelleadhæsion og lysis, blev der anvendt monolag af ektocervikale celler. T. vaginalis parasitter blev anbragt i kultursystemet i nærvær af en rhomboid proteasehæmmer. Både fastgørelse til cellerne og deres lysis blev hæmmet på en dosisafhængig måde, hvilket tyder på, at rhomboidproteaser faktisk spiller en rolle i både fastgørelse af parasitten til værtsceller og deres ødelæggelse.
når disse tre rhomboidproteaser imidlertid blev overudtrykt i transficerede parasitter, forårsagede kun TvROM1, den rhomboide protease placeret ved celleoverfladen, en stigning i cellebinding og lysis.
søgning efter substrater til TvROM1
hypotese om, at substratet spaltet af TvROM1 ville være frigivelse fra overfladen af T. vaginalis, Johnson-gruppen indsamlede molekyler frigivet fra de transficerede parasitter i dyrkningsmediet i nærvær eller fravær af en serinproteasehæmmer og udsatte dem for massespektrometri. Kvantitative proteomics-og bioinformatikmetoder identificerede to lignende proteiner som TvROM1-substrater med små aminosyrer, der omgiver de potentielle spaltningssteder, der sandsynligvis vil være i transmembrandomænet. Disse proteiner kunne ikke spaltes af TvROM3.
TvROM1 kunne kun spalte transmembrandomænet i et substrat, spaltning forekommer ved eller nær den ydre flade af transmembrandomænet.
ved at transficere T. vaginalis, så spaltningsstedet for dette substrat blev deaktiveret og ikke kunne spaltes af TvROM1, viste gruppen substratakkumulering på parasitoverfladen. Vedhæftning af mutante parasitter til værtsceller blev signifikant forøget, hvilket tyder på en direkte rolle for dette substrat i vedhæftning. Imidlertid steg lysis ikke, hvilket indikerer, at yderligere faktorer er involveret i værtscellelyse.
denne elegante serie af undersøgelser understøtter synspunktet om, at et rhomboidprotein placeret i plasmamembranen af T. vaginalis og dets substrat har en rolle at spille i patologien af trichomaniasis. Forfatterne antyder, at tvrom1-spaltning af dets substrat kan signalere en stigning i klæbende proteiner på parasitten eller værtscelleoverfladen i den indledende fase af bindingen.
nyttig information
celleadhæsion og lysis af værtsceller er helt klart en kompleks proces, der kræver flere faktorer af parasitoprindelse. Tilsætningen af rhomboidlignende proteiner til denne liste har udvidet antallet af kandidatmolekyler, der kunne målrettes af multifacetterede vacciner rettet mod T. vaginalis. Indtil videre har produktionen af en vaccine mod enhver protosoisk parasit undgået vores samfund, men måske har dette taget os et lille skridt videre mod dette mål.