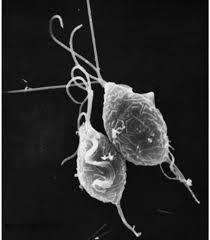
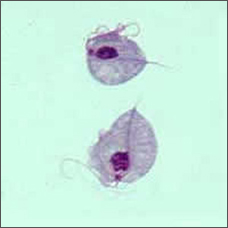
Dieser bizarr aussehende birnenförmige Organismus ist Trichomonas vaginalis, der einzellige Parasit, der für die häufigste nicht viral sexuell übertragbare Krankheit der Welt, Trichomoniasis, verantwortlich ist.
Der Mensch ist der einzige Wirt für T. vaginalis und die direkte Übertragung erfolgt von Person zu Person während des Geschlechtsverkehrs. Der Parasit vermehrt sich durch binäre Spaltung und es gibt keine Hinweise auf Zystenbildung. Es ist anaerob, ohne Mitochondrien, und ist ein obligater Parasit, der die Urogenitaltrakte von Männern und Frauen bewohnt, wo er sich mit vier fadenartigen Filamenten, den Flagellen, bewegt.
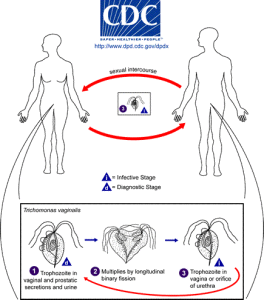
Im Jahr 2008 schätzte die Weltgesundheitsorganisation, dass weltweit 276 Millionen Menschen infiziert waren. Allein in den USA sind 3, 1% der Frauen zwischen 14 und 45 Jahren infiziert. Obwohl die meisten dieser Infektionen symptomlos sind, kann eine Infektion zu Vaginitis, Zervizitis oder Prostatitis führen und ist mit einem erhöhten Risiko für HIV-Infektionen und Gebärmutterhals- oder Prostatakrebs verbunden. Es kann auch das Ergebnis der Schwangerschaft negativ beeinflussen.
Wie verursacht es Pathologie?
T.vaginalis bindet an verschiedene Arten von Wirtszellen, z. B. an die Vagina und die Prostata (Epithelzellen). Die Zellen lysieren dann und setzen Nährstoffe für den Parasiten frei. Wie es sich an Zellen anlagert und ihre Lyse verursacht, ist wenig bekannt, obwohl bekannt ist, dass der Kontakt mit den Wirtszellen für ihre Lyse erforderlich ist.
Wenn die Zelladhäsion ein erster Schritt bei der eventuellen Zelllyse ist, ist es wahrscheinlich, dass Moleküle auf der Oberfläche des Parasiten an diesem Prozess beteiligt sind. Wir wissen, dass der Parasit mit Lipophosphoglycan (LPG) -Molekülen überzogen ist, die an ein Säugetierprotein namens Galectin-1 auf der Zelloberfläche binden. Wenn jedoch die Galektin-Produktion in Säugetierzellen abgebaut wird, wird die Parasitenbindung nur geringfügig reduziert. Das ist also nicht die ganze Geschichte.
Es wurde auch gezeigt, dass T. vaginalis spezifisch an Vaginalepithelzellen mittels Proteinen haftet, die Adhäsine genannt werden, und es wurde auch gezeigt, dass Cysteinproteaseenzyme an der Zytoadhärenz und anderen Aspekten der Pathogenese beteiligt sind.
Im Jahr 2010 näherte sich Patricia Johnson dem Problem, indem sie Parasitenproteine untersuchte. Ihr Team identifizierte Proteine auf der Oberfläche von sechs Stämmen von T. vaginalis mit unterschiedlicher Fähigkeit, an Wirtszellen zu haften. Sie fanden 11 Proteine, die in den adhäsiveren Stämmen häufiger vorkamen, und wenn zwei davon in weniger adhäsiven Stämmen überexprimiert wurden, nahm die Adhäsion zu.
Die Rolle rhomboidähnlicher Proteine
Vor kurzem wandte sich die Johnson-Gruppe zwei rhomboidähnlichen Proteinen von T. vaginalis zu. Diese rhomboiden Proteine sind Serinproteasen, die sich auf Zellmembranen mit ihren aktiven Stellen innerhalb der Lipiddoppelschicht befinden. Sie spalten andere Transmembranproteine und die Produkte der Spaltung werden normalerweise an die Außenseite der Zelle abgegeben. Sie regulieren eine Vielzahl biologischer Funktionen und spalten bei anderen Protozoenparasiten nachweislich Adhäsionsmoleküle.
Die bioinformatische Analyse ergab 4 rhomboide Proteine, die wahrscheinlich aktive Proteasen in T. vaginalis sind. Eines davon, TvROM1, befand sich an der Zelloberfläche. TvROM2 und 3 wurden am Golgi-Apparat lokalisiert und TvROM4 konnte nicht lokalisiert werden und wurde aus der Studie gelöscht.
Um festzustellen, ob rhomboide Proteine tatsächlich an der Adhäsion und Lyse von Wirtszellen beteiligt waren, wurden Monoschichten ektozervikaler Zellen verwendet. T. vaginalis-Parasiten wurden in Gegenwart eines rhomboiden Proteaseinhibitors in das Kultursystem eingebracht. Sowohl die Bindung an die Zellen als auch ihre Lyse wurden dosisabhängig gehemmt, was darauf hindeutet, dass Rhomboidproteasen tatsächlich sowohl bei der Bindung des Parasiten an Wirtszellen als auch bei deren Zerstörung eine Rolle spielen.
Wenn diese drei Rhomboidproteasen jedoch in transfizierten Parasiten überexprimiert wurden, verursachte nur TvROM1, die Rhomboidprotease, die sich an der Zelloberfläche befindet, eine Zunahme der Zellanhaftung und Lyse.
Suche nach Substraten für TvROM1
Hypothese, dass das von TvROM1 gespaltene Substrat von der Oberfläche von T gelöst würde. vaginalis sammelte die Johnson-Gruppe Moleküle, die von den transfizierten Parasiten in Gegenwart oder Abwesenheit eines Serinproteaseinhibitors in das Kulturmedium freigesetzt wurden, und unterzog sie einer Massenspektrometrie. Quantitative Proteomik- und Bioinformatikansätze identifizierten zwei ähnliche Proteine als TvROM1-Substrate mit kleinen Aminosäuren, die die potenziellen Schnittstellen umgeben, die sich wahrscheinlich in der Transmembrandomäne befinden. Diese Proteine konnten durch TvROM3 nicht gespalten werden.
TvROM1 konnte nur die Transmembrandomäne eines Substrats spalten, wobei die Spaltung an oder nahe der Außenseite der Transmembrandomäne erfolgte.
Durch Transfektion von T. vaginalis, so dass die Schnittstelle dieses Substrats deaktiviert war und nicht durch TvROM1 gespalten werden konnte, zeigte die Gruppe eine Substratakkumulation auf der Parasitenoberfläche. Die Anheftung mutierter Parasiten an Wirtszellen war signifikant erhöht, was auf eine direkte Rolle dieses Substrats bei der Anheftung hindeutet. Die Lyse nahm jedoch nicht zu, was darauf hindeutet, dass zusätzliche Faktoren an der Lyse der Wirtszelle beteiligt sind.
Diese elegante Reihe von Untersuchungen unterstützt die Ansicht, dass ein rhomboides Protein, das sich in der Plasmamembran von T. vaginalis befindet, und sein Substrat eine Rolle bei der Pathologie der Trichomaniasis spielen. Die Autoren schlagen vor, dass die TvROM1-Spaltung seines Substrats eine Zunahme der adhärenten Proteine auf der Parasiten- oder Wirtszellenoberfläche während der Anfangsphase der Bindung signalisieren kann.
Nützliche Informationen
Zelladhäsion und Lyse von Wirtszellen ist eindeutig ein komplexer Prozess, der mehrere Faktoren parasitären Ursprungs erfordert. Die Hinzufügung von rhomboidähnlichen Proteinen zu dieser Liste hat die Anzahl der Kandidatenmoleküle erweitert, auf die die gegen T. vaginalis gerichteten Impfstoffe abzielen könnten. Bisher ist die Herstellung eines Impfstoffs gegen jeden Protozoenparasiten unserer Gemeinschaft entgangen, aber vielleicht sind wir damit einen kleinen Schritt weiter in Richtung dieses Ziels gegangen.